Содержание
- 2. Найпростіша органічна сполука вуглецю з воднем, природний безбарвний газ без запаху, хімічна формула — CH4. Зустрічається
- 3. Метан — безбарвний газ без запаху і смаку, майже у два рази легший від повітря. У
- 4. Вибухонебезпечний при концентрації в повітрі від 4,4 % до 17 % . Найбільш вибухонебезпечна концентрація 9,5
- 5. Характерна для метану також реакція з хлором, яка відбувається при звичайній температурі під впливом розсіяного світла.
- 6. Застосування метану
- 7. Паливна промисловість СН4 + 2О2 = СО2 + 2Н2О + 880 Дж
- 8. Добування формальдегіду для пластмас Добування ацетилен, водню
- 9. Добування хлорпохідних СН4 + Cl2 CH3Cl + HCl СН4 + Cl2 =CH3Cl + HCl
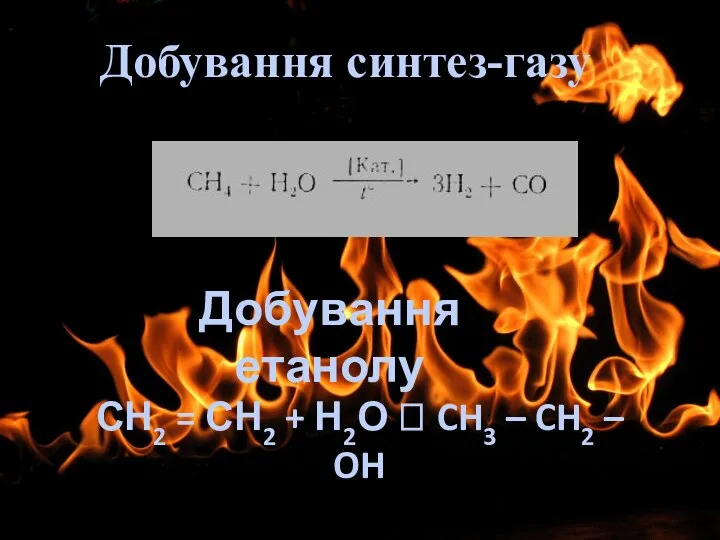
- 10. Добування синтез-газу Добування етанолу СН2 = СН2 + Н2О CH3 – CH2 – OH
- 12. Скачать презентацию








 Нафта та її переробка
Нафта та її переробка  Смазки. Состав смазки
Смазки. Состав смазки Химия: измерения
Химия: измерения Елементи вторинної структури пептидів і білків
Елементи вторинної структури пептидів і білків Количество вещества
Количество вещества Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Молибден. Получение молибдена
Молибден. Получение молибдена Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5)
Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5) Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений обобщение знаний
обобщение знаний Химическая связь
Химическая связь Генетическая связь классов соединений
Генетическая связь классов соединений Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф История изучения углеродных нанотрубок и композиционных материалов на основе полиуретанового связующего
История изучения углеродных нанотрубок и композиционных материалов на основе полиуретанового связующего Моделирование химических процессов
Моделирование химических процессов Моделирование химических процессов
Моделирование химических процессов Пластмаси, синтетичні каучуки Підготував учень 11 класу Петро Ферій
Пластмаси, синтетичні каучуки Підготував учень 11 класу Петро Ферій  Общие способы получения металлов
Общие способы получения металлов Присадки к маслам
Присадки к маслам Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока
Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока Углеводороды. (Лекция 5)
Углеводороды. (Лекция 5) Химическая термодинамика
Химическая термодинамика Алкены Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна
Алкены Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна  Предмет физиологии центральной нервной системы
Предмет физиологии центральной нервной системы Химическая связь
Химическая связь Кислотно-основное титрование
Кислотно-основное титрование Зымыран сұрақтар
Зымыран сұрақтар