Содержание
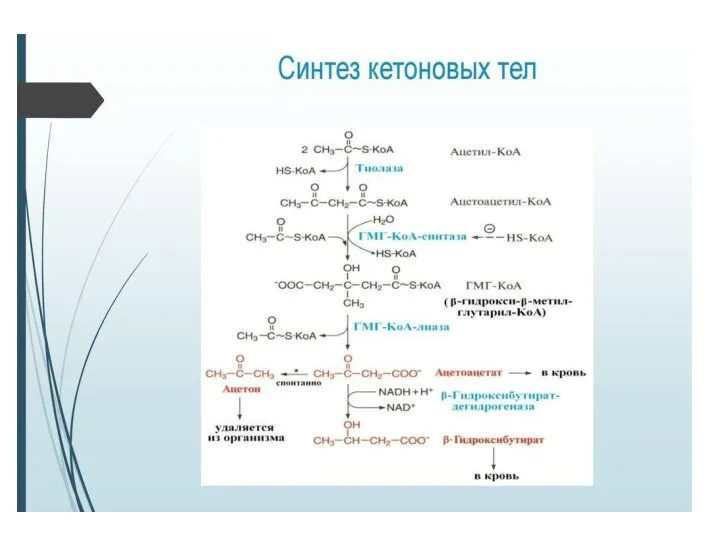
- 2. Биосинтез кетоновых тел. Ацетоновые тела являются водорастворимыми формами липидных энергетических источников. Двумя основными видами ацетоновых тел
- 4. Эти реакции происходят в митохондриях. В цитозоле имеются изоферменты - β-кетотиолазы и ГМГ~КоА-синтетазы, которые также катализируют
- 5. Образование кетоновых тел в печени контролируется состоянием питания. Такое контрольное действие усиливается инсулином и глюкагоном. Принятие
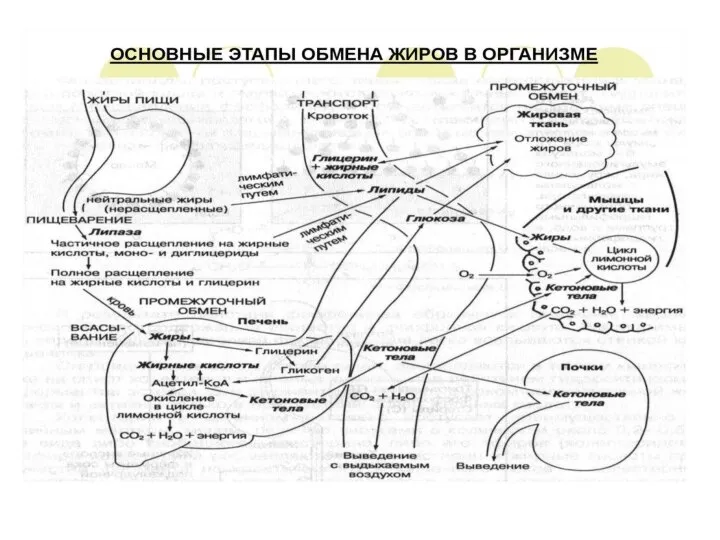
- 6. В норме кетоновые тела являются источником энергии для мышц; при продолжительном голодании они могут использоваться центральной
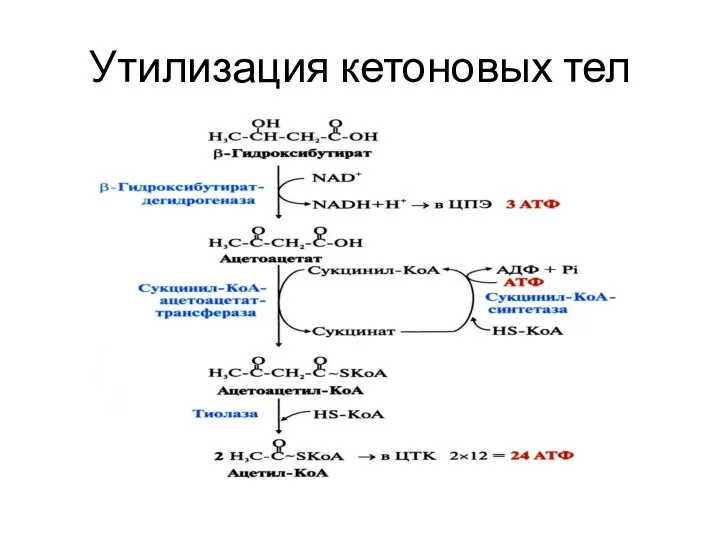
- 7. Утилизация кетоновых тел
- 8. Интенсивность окисления кетоновых тел во внепеченочных тканях пропорциональна их концентрации в крови. Общая концентрация кетоновых тел
- 9. Состояние организма, при котором концентрация кетоновых тел в крови выше нормальной, называется кетонемией. Повышенное содержание кетоновых
- 10. Кетоз возникает в результате недостатка доступных углеводов. Например, при голодании их мало поступает (или не поступает)
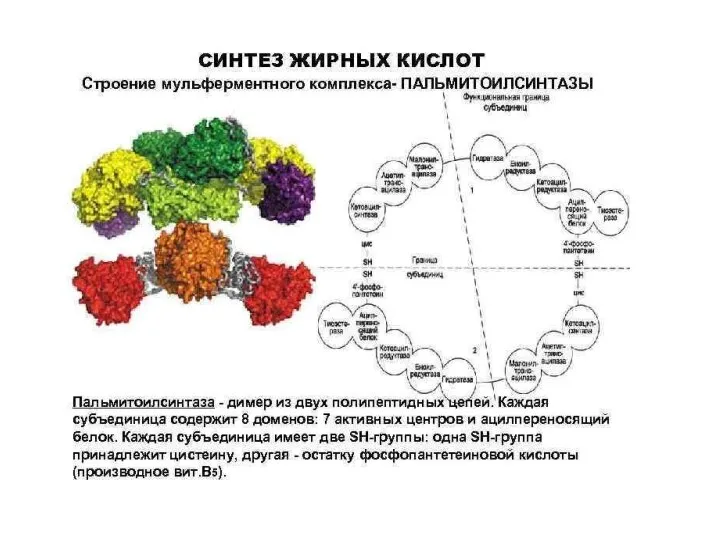
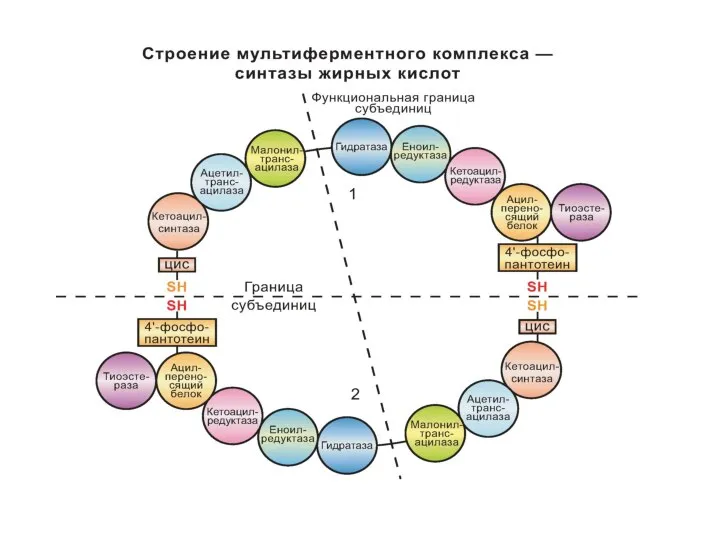
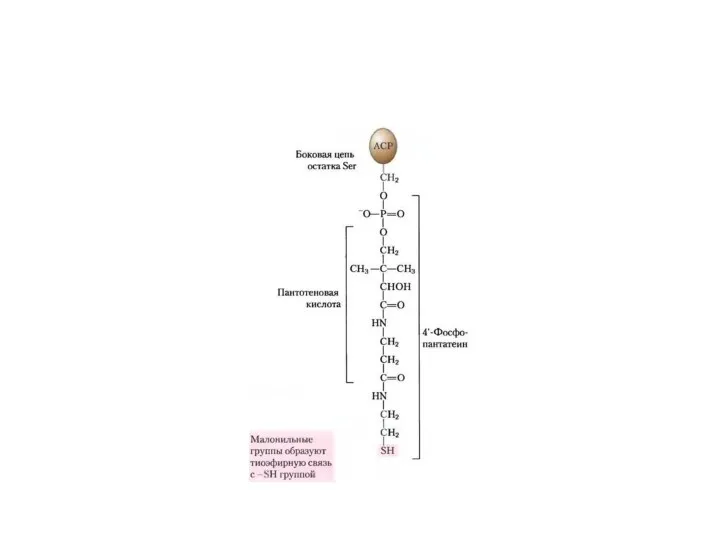
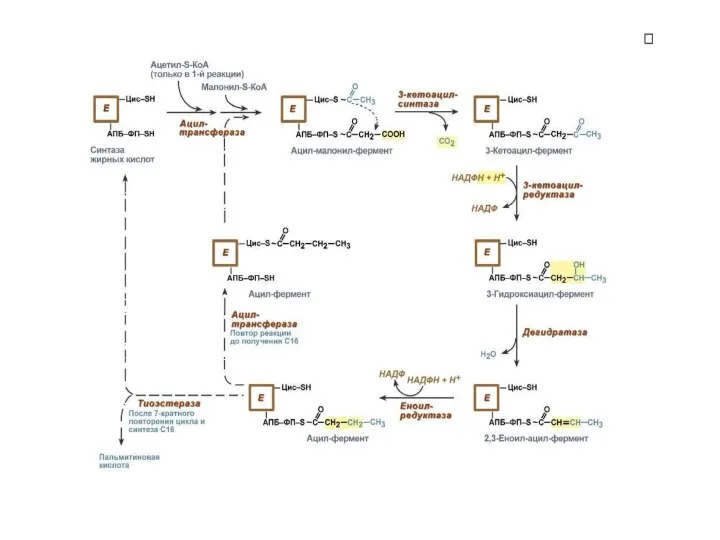
- 11. БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ
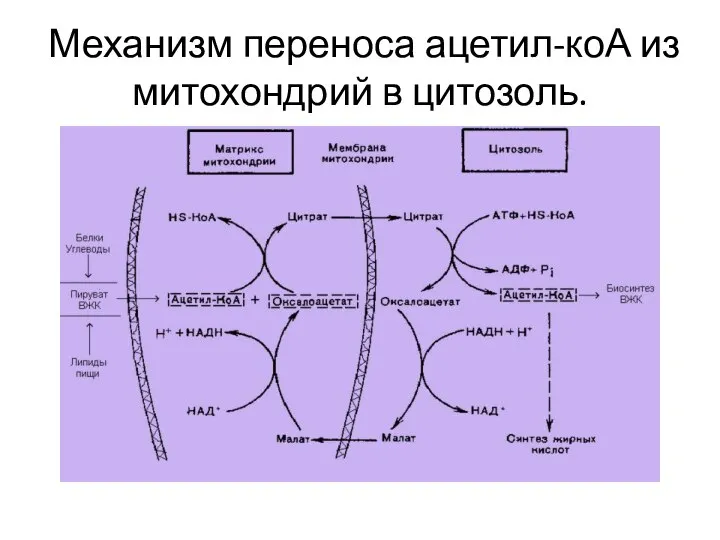
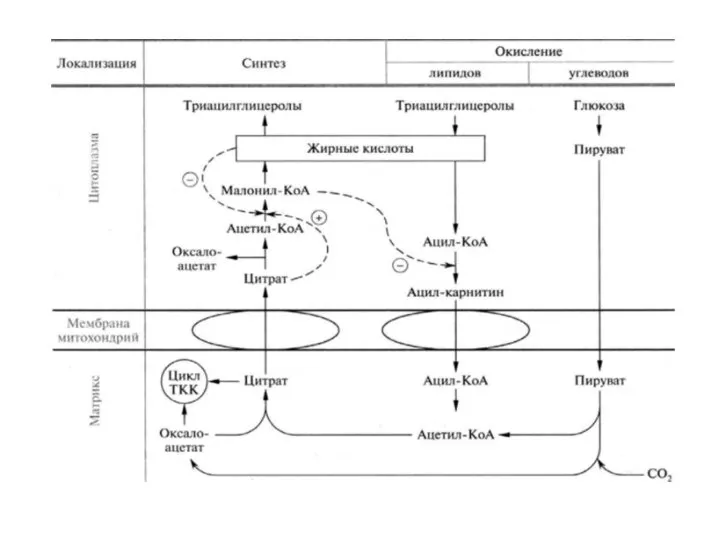
- 14. Механизм переноса ацетил-коА из митохондрий в цитозоль.
- 15. Malic –фермент.
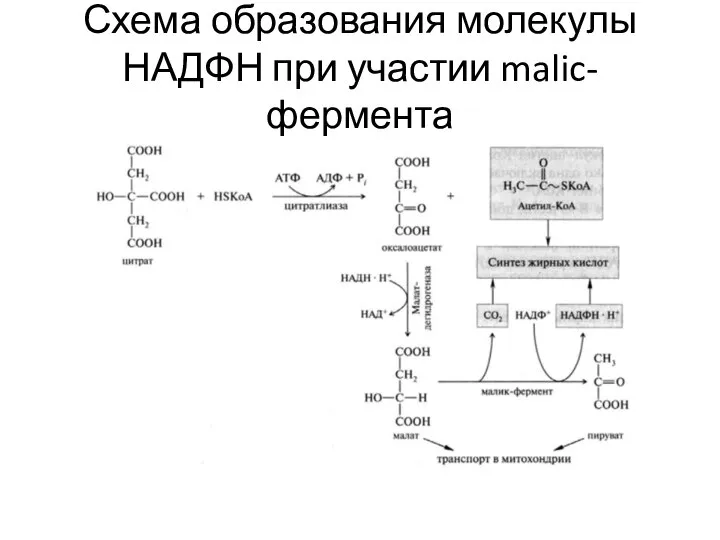
- 16. Схема образования молекулы НАДФН при участии malic-фермента
- 17. Синтез малонил-коА
- 18. Биосинтез жирных кислот Печень, почки, мозг, легкие, молочная железа, жировая ткань. Цитозольный процесс. Субстрат – ацетил-коА.
- 23. Суммарное уравнение синтеза пальмитиновой кислоты. Ац-коА + 7малонил-коА +14 НАДФН·Н + = пальмитиновая кислота + 7СО
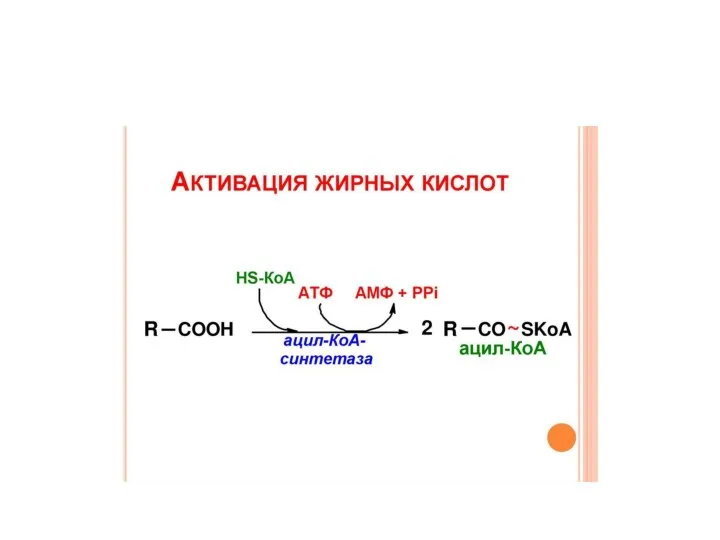
- 24. Процессы окисления и биосинтеза жирных кислот отличаются: Биосинтез Окисление Расположение Цитоплазма Митохондрия Переносчики АПБ КоА Форма,
- 26. Удлинение цепи жирных кислот Данный процесс в основном происходит в микросомах. Факторы, обеспечивающие элонгацию жирных кислот:
- 27. Элонгация происходит путем добавления двухуглеродного фрагмента к карбоксильному концу жирной кислоты. Существуют две раздельных системы элонгации
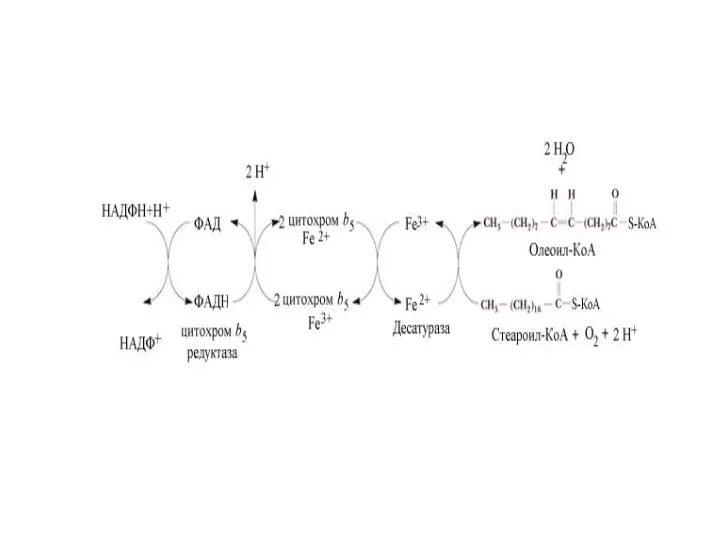
- 28. Происхождение ненасыщенных жирных кислот в клетках организма, метаболизм арахидоновой кислоты Среди ненасыщенных жирных кислот в организме
- 31. У человека при недостатке в пище незаменимых жирных кислот описаны дерматологические изменения. Обычный рацион взрослых людей
- 32. Специфическое значение полиненасыщенных жирных кислот для организма, с одной стороны заключается в том, что они являются
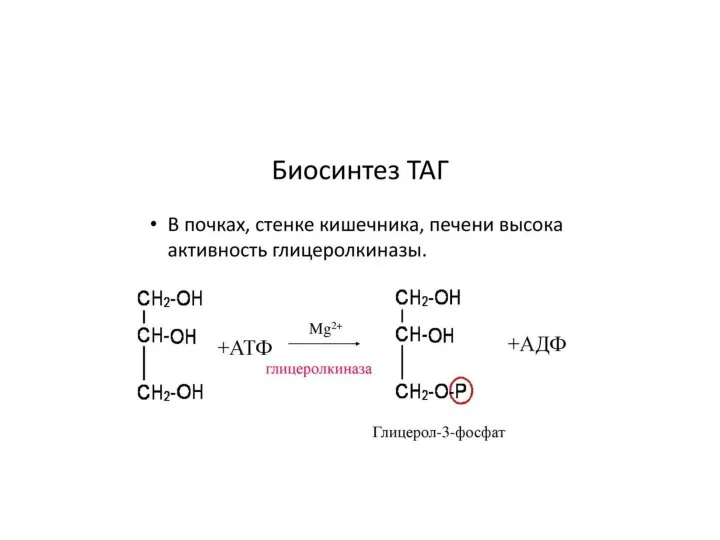
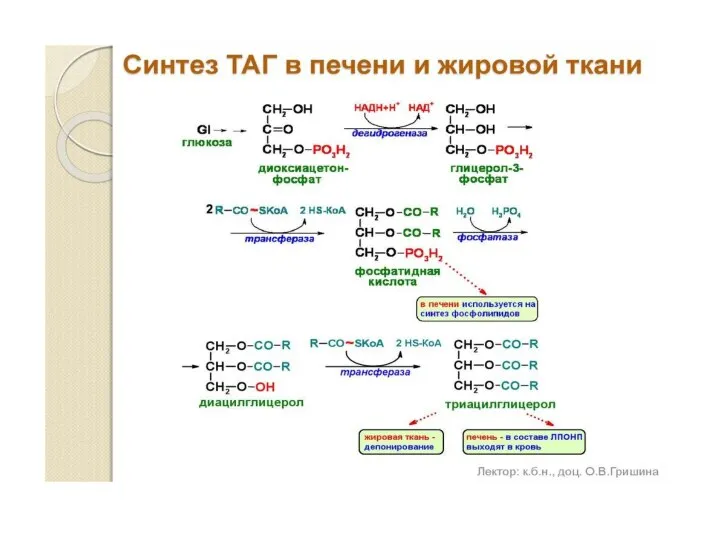
- 33. БИОСИНТЕЗ ТАГ
- 34. ТАГ составляют 90 % среди всех липидов, содержащихся в организме. Наиболее часто встречающимися жирными кислотами в
- 39. Избыточное содержание ТАГ в адипоцитах ведет к ожирению. Гуморальная регуляция синтеза и распада ТАГ в жировой
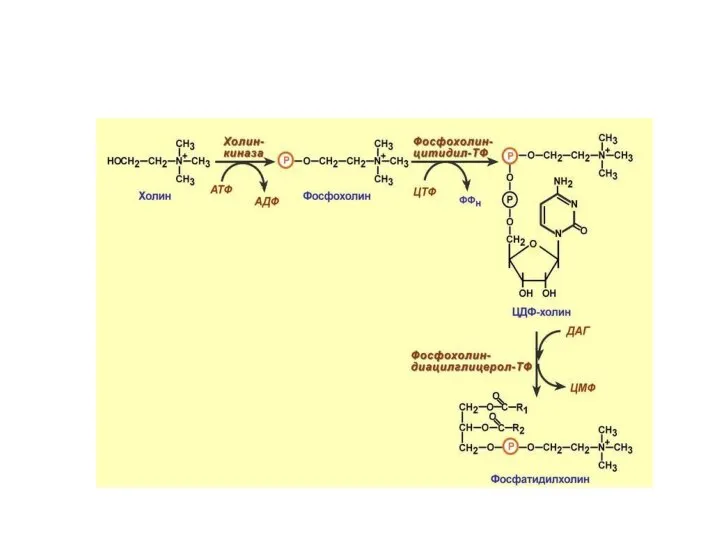
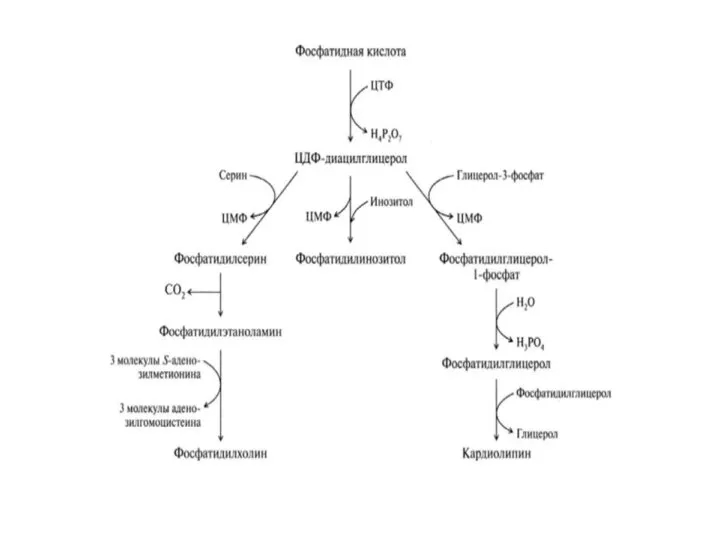
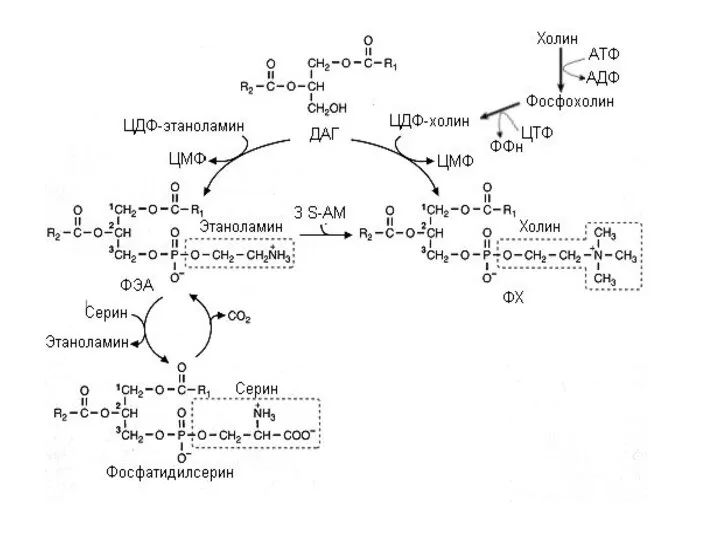
- 40. БИОСИНТЕЗ ФОСФОЛИПИДОВ
- 46. Фосфолипиды в организме осуществляют активный транспорт жирных кислот из печени. Нарушение синтеза фосфолипидов ведет за собой
- 47. Сурфактант легких Примером реакций деацилирования-реацилирования является образование в клетках дипальмитоилфосфатидилхолина. Синтез этого типа ФХ особенно интенсивно
- 48. Частой причиной смерти недоношенных и, реже, доношенных новорожденных является синдром дыхательной недостаточности (респираторный дистресс-синдром), или болезнь
- 49. Состав сурфактанта легких у взрослого человека Состав сурфактанта легких у взрослого человека Липиды – 80 %-90
- 50. Жировое перерождение печени Существует два типа жирового перерождения. 1-й тип связан с увеличением свободных жирных кислот
- 51. Вышеперечисленные состояния вызываются следующими причинами: 1. Низкое количество липотропных факторов. 2. Действие токсических веществ таких как:
- 52. Процесс жирового перерождения печени и ожирения подавляют вещества, которые направляют процессы биосинтеза липидов на образование фосфолипидов.
- 53. К липотропным факторам относятся: 1. Компоненты фосфолипидов - холин, этаноламин, инозит и серин. 2. Метионин -
- 54. Регуляция обмена жирных кислот Регуляция ацетил-коА-карбоксилазы. Эта реакция является лимитирующей на пути липогенеза. Активатором выступает цитрат,
- 55. 2. Регуляция пируватдегидрогеназы. Существует обратная связь между концентрацией свободных жирных кислот и отношением активной и неактивной
- 56. 3. Гормональная регуляция. Существует несколько механизмов стимуляции липогенеза инсулином. 1. Инсулин ускоряет перенос глюкозы в клетки
- 57. Глюкагон и адреналин. 1. Вызывают ингибирование ацетил-коА –карбоксилазы и, следовательно, процесса липогенезе в целом, путем увеличения
- 58. ТРАНСПОРТНЫЕ ФОРМЫ ЛИПИДОВ
- 59. Основными липидами плазмы крови человека являются свободные жирные кислоты (СЖК), ТАГ, фосфолипиды (ФЛ), свободный холестерол (СХС)
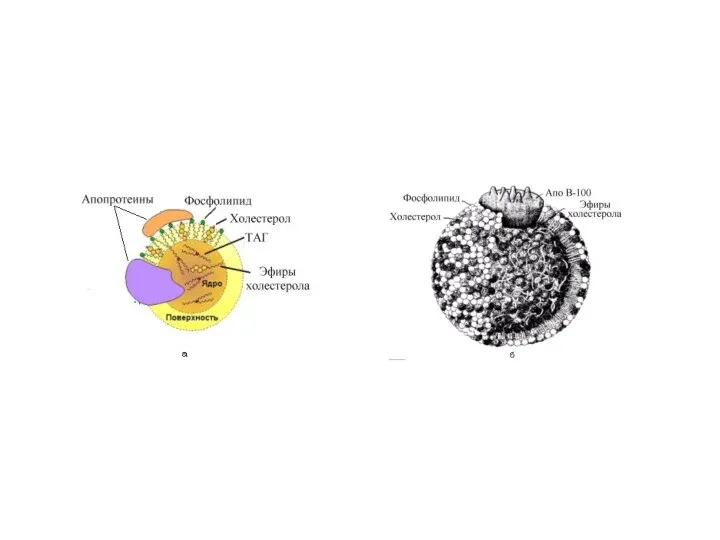
- 60. Структура липопротеина. Электронная микроскопия выделенных видов ЛП показала, что они представляют собой сферические частицы, диаметр которых
- 62. Классификация липопротеинов В основу классификации ЛП положен следующий принцип: деление ЛП на классы по их различиям
- 63. Хиломикроны Хиломикроны (ХМ) известны с 1774 г., когда английский врач У. Хьюсон обнаружил белесоватый вид крови
- 64. Повышение содержания в крови отмечается при гиперлипопротеинемии I и V типа, небольшое повышение при III типе.
- 65. Липопротеины очень низкой плотности (ЛПОНП) Выделены в 1955 г. Р. Гавелом. Синтезируются главным образом в печени.
- 66. Функции ЛПОНП 1. Доставляют новосинтезированные в организме ТАГ к жировой ткани. 2. Являются предшественниками следующего класса
- 67. Образование ТАГ и секреция ЛПОНП печенью усиливается в следующих условиях: 1. При потреблении богатой углеводами пищи
- 68. Нормальное содержание в крови составляет 0,8 - 1,5 г/л; у мужчин - 0,67 ± 0,33 г/л,
- 69. Липопротеины низкой плотности (ЛПНП) Липопротеины низкой плотности (ЛПНП) при электорофорезе мигрируют с β-глобулинами. Являются самыми богатыми
- 70. ЛПНП являются атерогенными, поскольку существует прямая зависимость между вероятностью возникновения коронарного атеросклероза и концентрацией ЛПНП в
- 71. Липопротеины высокой плотности (ЛПВП) Липопротеины высокой плотности (ЛПВП) при электрофорезе мигрируют вместе с α-глобулинами. Синтезируются в
- 73. Скачать презентацию




















































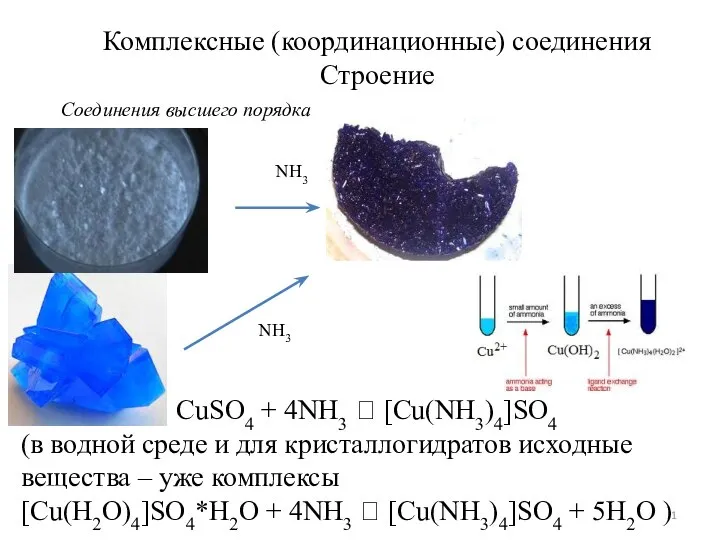 Комплексные (координационные) соединения. Строение
Комплексные (координационные) соединения. Строение МБОУ «СОШ № 22» Расчеты по уравнениям реакций, протекающих в растворах
МБОУ «СОШ № 22» Расчеты по уравнениям реакций, протекающих в растворах Введение. Тренажер
Введение. Тренажер Введение в химию. 8 класс
Введение в химию. 8 класс Металлы в продуктах питания
Металлы в продуктах питания Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Применение дизельных топлив
Применение дизельных топлив Периодическая система
Периодическая система Применение ацетилена
Применение ацетилена Определение предмета биофизики
Определение предмета биофизики Методические подходы к формированию и развитию личностных качеств учащихся на уроках химии
Методические подходы к формированию и развитию личностных качеств учащихся на уроках химии Коллекция учебных динамических слайдов по химии (8 класс)
Коллекция учебных динамических слайдов по химии (8 класс) Миметик глицина на основе производного Гераниола
Миметик глицина на основе производного Гераниола 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Перегонка с водяным паром
Перегонка с водяным паром Химическая связь
Химическая связь Насичені вуглеводні (алкани, парафіни)
Насичені вуглеводні (алкани, парафіни) Химиялык кару
Химиялык кару Аммиак
Аммиак Оксиды
Оксиды Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Стеклопластики. Типы стеклопластиков и их классификация
Стеклопластики. Типы стеклопластиков и их классификация Химические реакции
Химические реакции Многоликая уксусная кислота
Многоликая уксусная кислота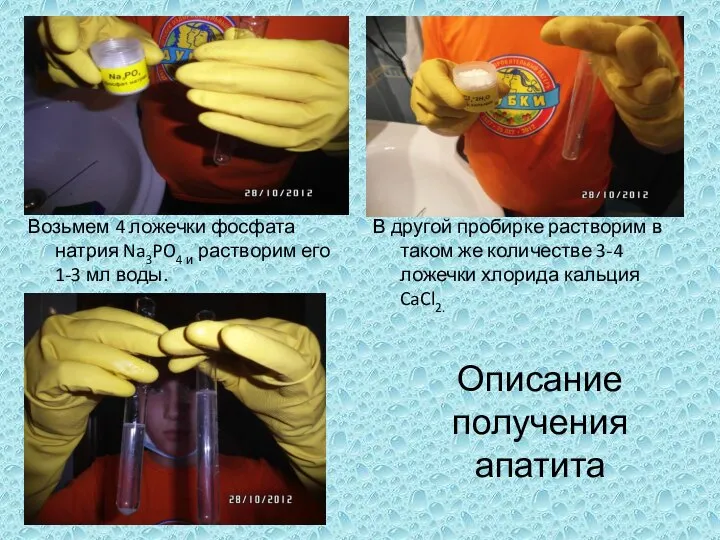 Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды.
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. Основания
Основания