Содержание
- 2. План лекции Белковый обмен. Ограниченный и тотальный протеолиз. Функции протеолиза. Характеристика протеолитических ферментов. Пищевые белки. Расщепление
- 3. Обмен белков Деградация пищевых и тканевых белков Белковый обмен - важнейший процесс, в ходе которого осуществляется
- 4. Обмен белков Деградация пищевых и тканевых белков Катаболизм белков в организме Расщепление белков (протеолиз) осуществляется ферментами,
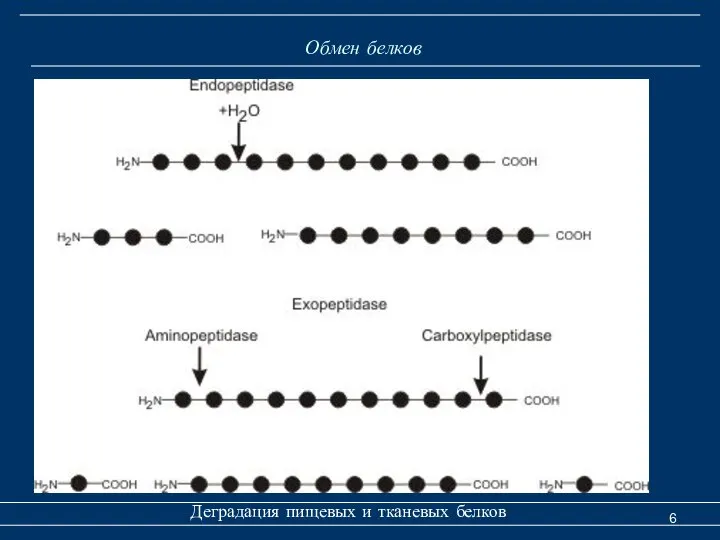
- 5. Обмен белков Деградация пищевых и тканевых белков 1. Эндопептидазы (протеиназы) - расщепляют пептидные связи внутри молекулы
- 6. Обмен белков Деградация пищевых и тканевых белков
- 7. Обмен белков Деградация пищевых и тканевых белков Классификация протеолитических ферментов По механизму катализа: • Серин/Треониновые (трипсин,
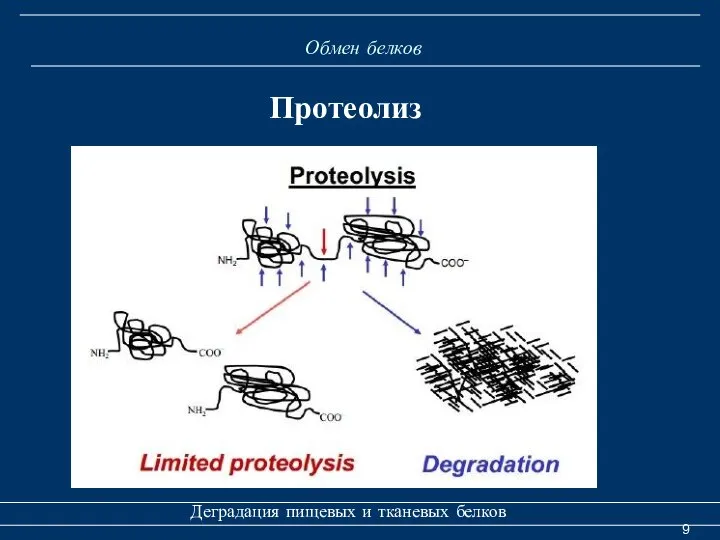
- 8. Обмен белков Деградация пищевых и тканевых белков Протеолиз Различают два типа протеолиза: 1. Ограниченный протеолиз –
- 9. Обмен белков Деградация пищевых и тканевых белков Протеолиз
- 10. Обмен белков Деградация пищевых и тканевых белков Функции ограниченного протеолиза • Деление клетки. • Процессинг (созревание)
- 11. Обмен белков Деградация пищевых и тканевых белков Функции тотального протеолиза • Снижение иммуногенности белков. • Лишение
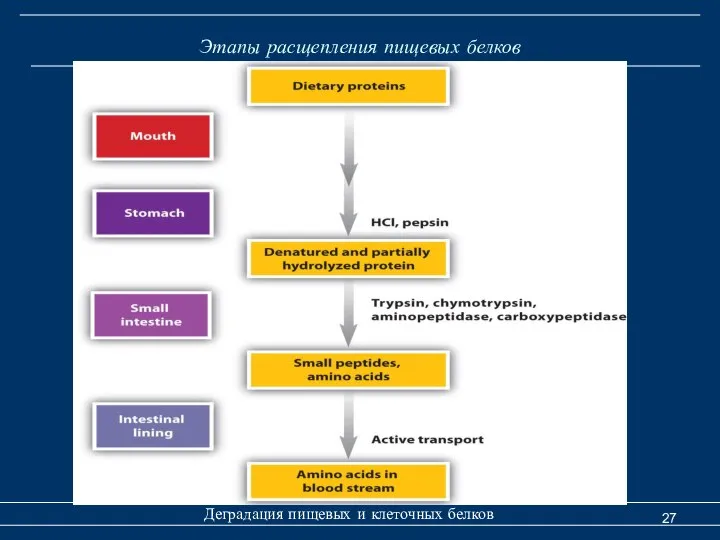
- 12. Расщепление пищевых белков Деградация пищевых и тканевых белков Этапы метаболизма пищевых белков 1) расщепление в желудочно-кишечном
- 13. Обмен белков Деградация пищевых и тканевых белков Качество (пищевая ценность) белков Биологическая ценность белков животного и
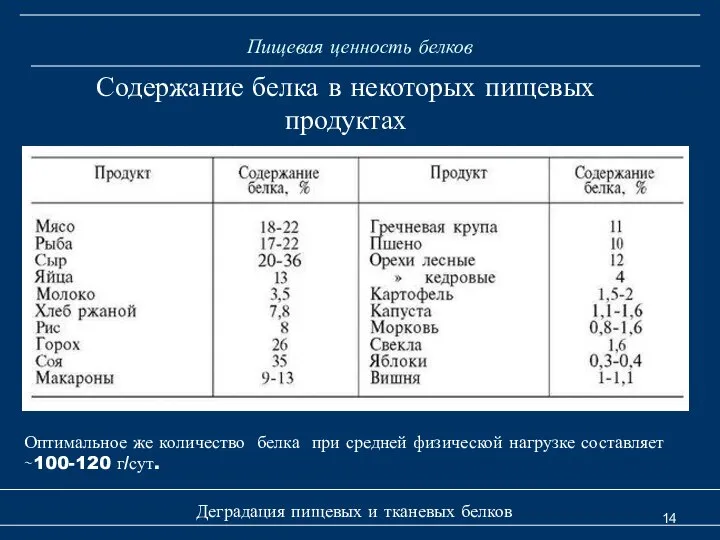
- 14. Пищевая ценность белков Деградация пищевых и тканевых белков Содержание белка в некоторых пищевых продуктах Оптимальное же
- 15. Расщепление пищевых белков Деградация пищевых и тканевых белков В желудочно-кишечный тракт белки поступают из 2-х источников:
- 16. Расщепление пищевых белков Деградация пищевых и тканевых белков Переваривания белков начинается в желудке, где под действием
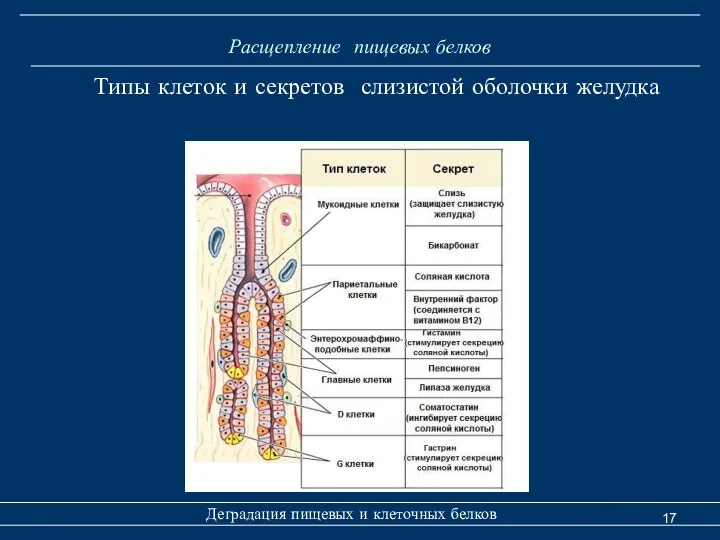
- 17. Расщепление пищевых белков Деградация пищевых и клеточных белков Типы клеток и секретов слизистой оболочки желудка
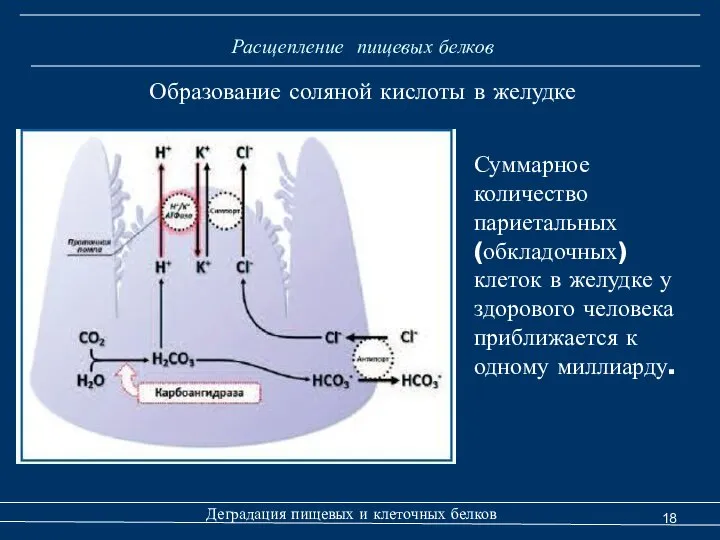
- 18. Расщепление пищевых белков Образование соляной кислоты в желудке Деградация пищевых и клеточных белков Суммарное количество париетальных
- 19. Расщепление пищевых белков Деградация пищевых и тканевых белков Секреция соляной кислоты в желудке Механизм секреции соляной
- 20. Расщепление пищевых белков Деградация пищевых и тканевых белков Роль соляной кислоты в переваривании белков 1. Денатурация
- 21. Расщепление белков в желудке Деградация пищевых и клеточных белков Протеолитические ферменты желудка Пепсин – главный протеолитический
- 22. Расщепление пищевых белков Деградация пищевых и тканевых белков Расщепление белков в тонком кишечнике Переваривания белков в
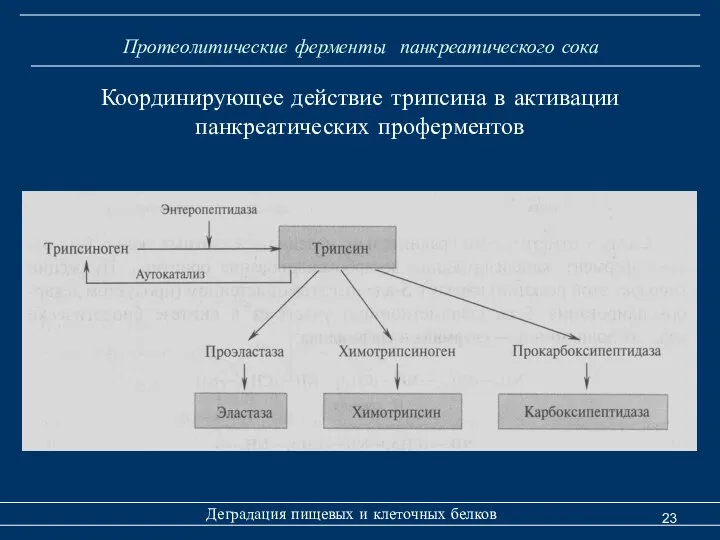
- 23. Протеолитические ферменты панкреатического сока Деградация пищевых и клеточных белков Координирующее действие трипсина в активации панкреатических проферментов
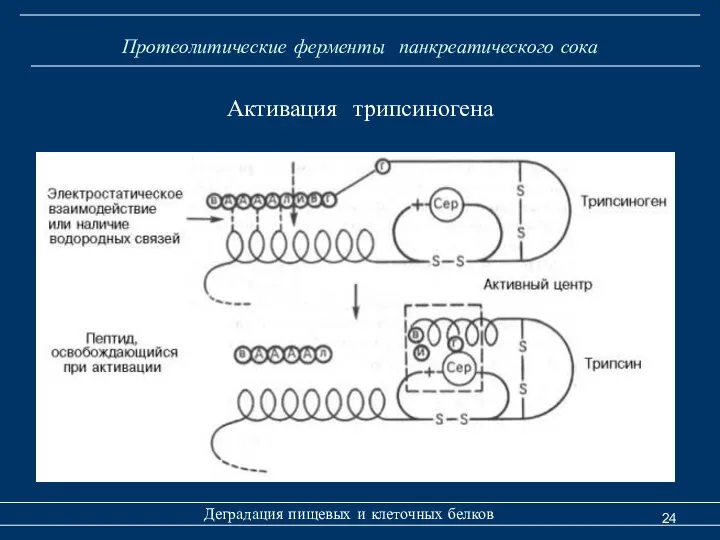
- 24. Протеолитические ферменты панкреатического сока Деградация пищевых и клеточных белков Активация трипсиногена
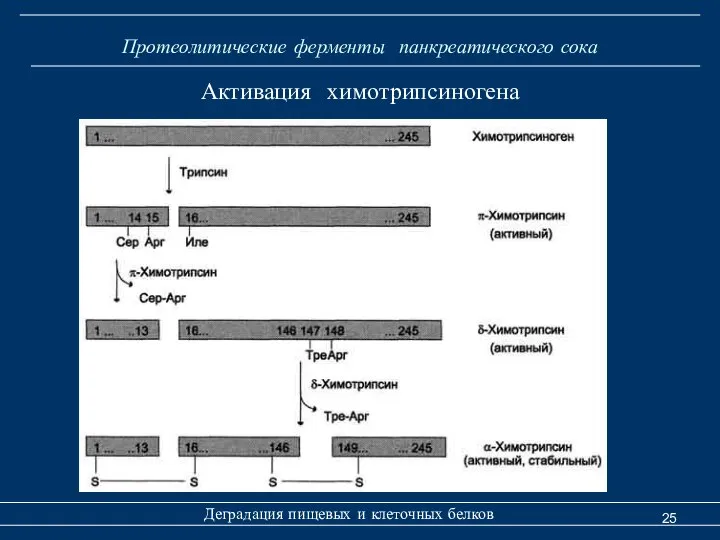
- 25. Протеолитические ферменты панкреатического сока Деградация пищевых и клеточных белков Активация химотрипсиногена
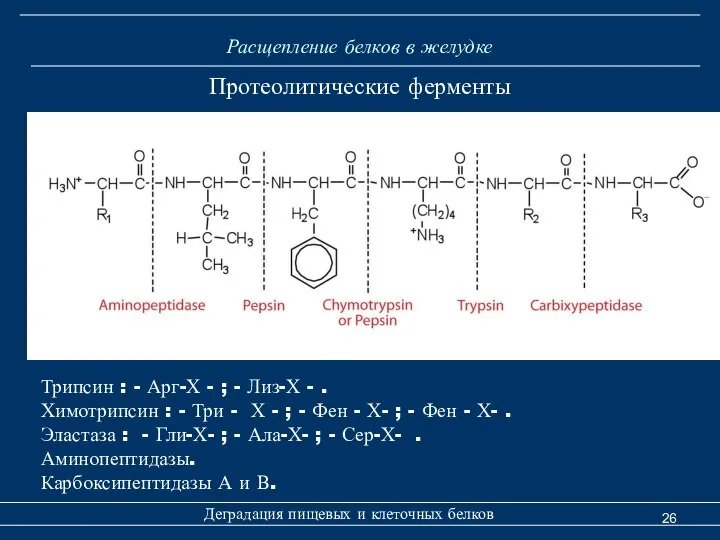
- 26. Расщепление белков в желудке Деградация пищевых и клеточных белков Протеолитические ферменты Трипсин : - Арг-Х -
- 27. Этапы расщепления пищевых белков Деградация пищевых и клеточных белков
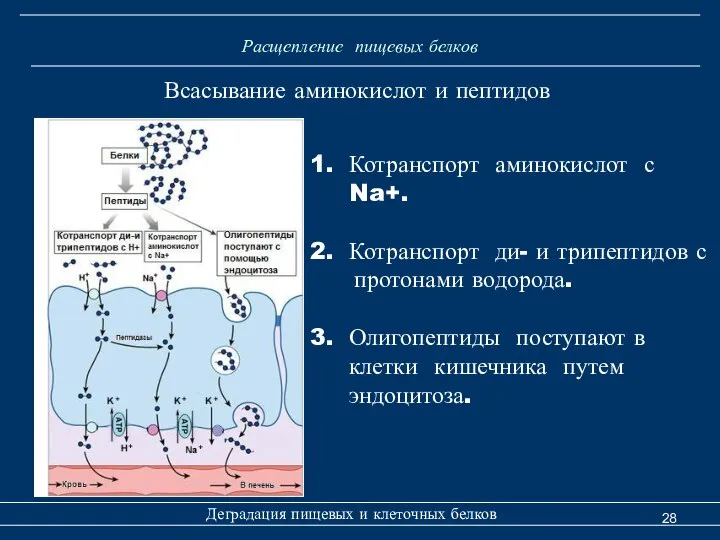
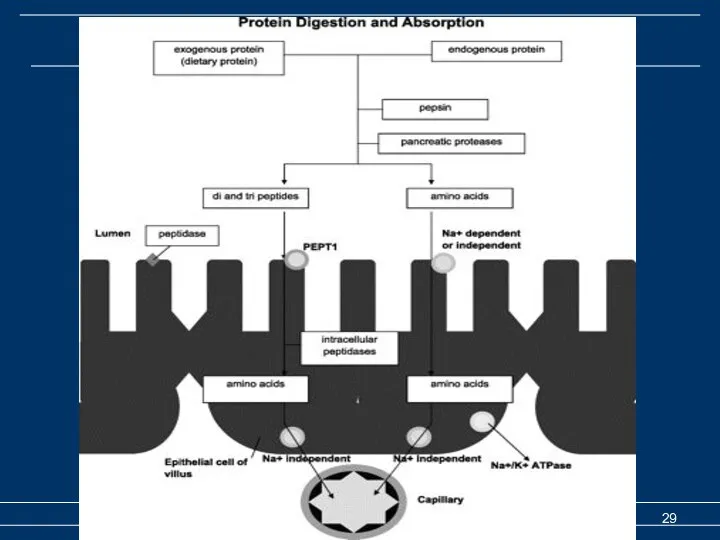
- 28. Расщепление пищевых белков Всасывание аминокислот и пептидов Деградация пищевых и клеточных белков Котранспорт аминокислот с Na+.
- 29. Расщепление пищевых белков Деградация пищевых и клеточных белков
- 30. Деградация клеточных белков Деградация пищевых и клеточных белков Расщепление клеточных белков Индивидуальные клеточные белки расщепляются и
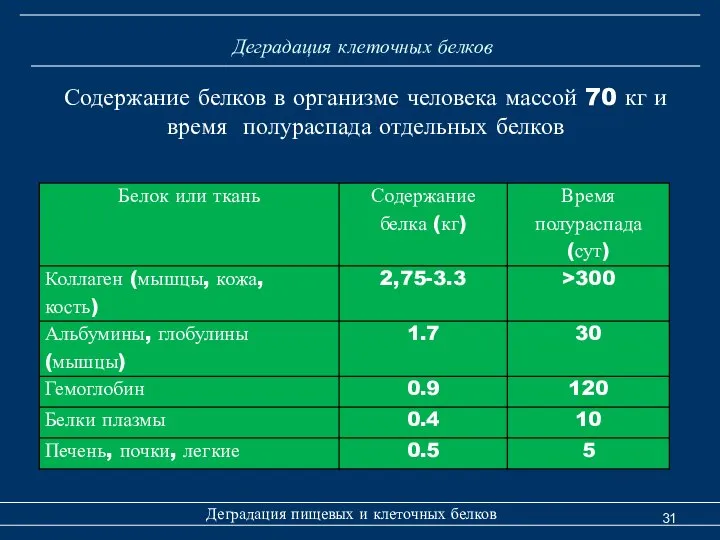
- 31. Деградация клеточных белков Деградация пищевых и клеточных белков Содержание белков в организме человека массой 70 кг
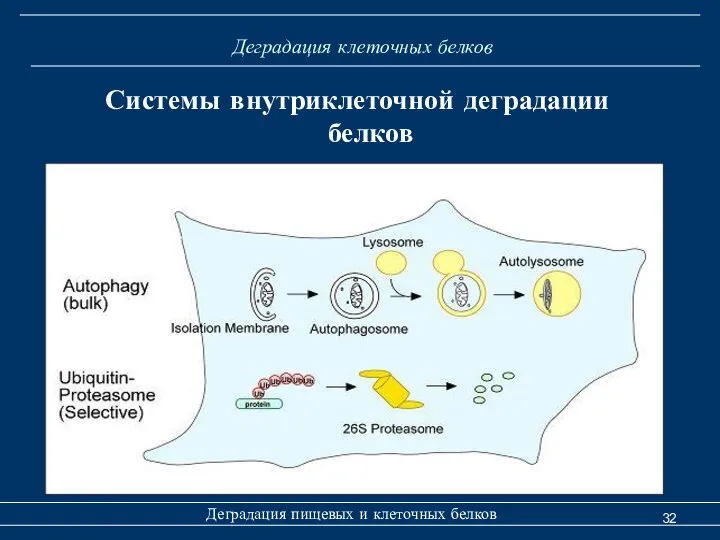
- 32. Деградация клеточных белков Деградация пищевых и клеточных белков Системы внутриклеточной деградации белков
- 33. Деградация клеточных белков Деградация пищевых и клеточных белков Системы внутриклеточной деградации белков Главный путь деградации большинства
- 34. Деградация клеточных белков Деградация пищевых и клеточных белков Убиквитин УБИКВИТИН (от лат. ubique – вездесущий) –
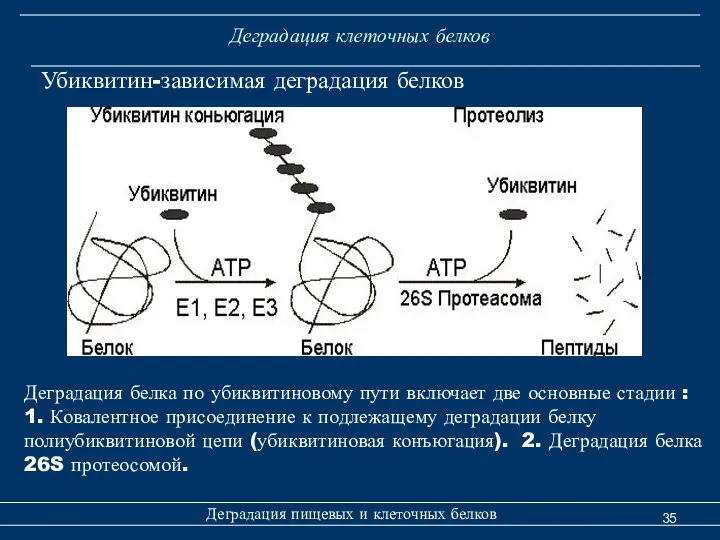
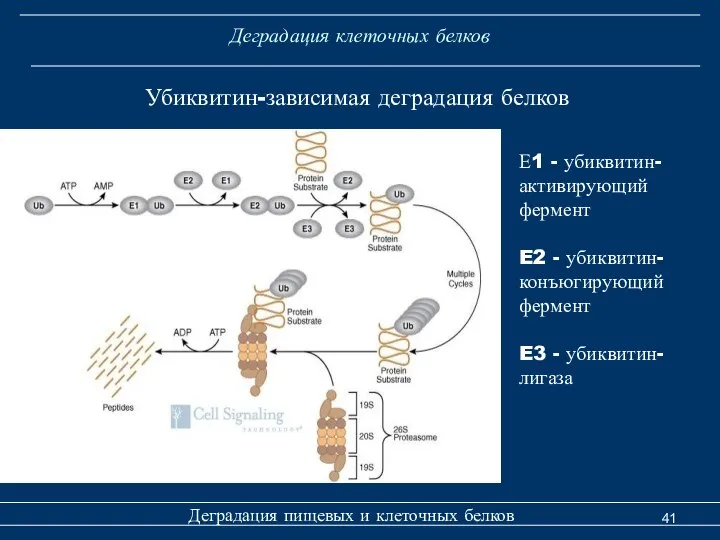
- 35. Деградация клеточных белков Деградация пищевых и клеточных белков Убиквитин-зависимая деградация белков Деградация белка по убиквитиновому пути
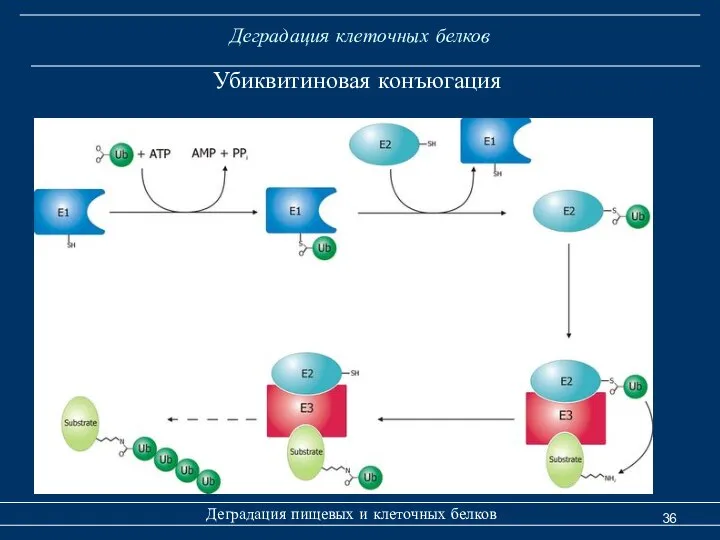
- 36. Деградация клеточных белков Деградация пищевых и клеточных белков Убиквитиновая конъюгация
- 37. Деградация клеточных белков Протеосома Деградация пищевых и клеточных белков Протеосомы выделяют в виде индивидуальных частиц с
- 38. Деградация клеточных белков Протеосома Деградация пищевых и клеточных белков Протеосома представляет собой мультисубъединичный белковый комплекс, который
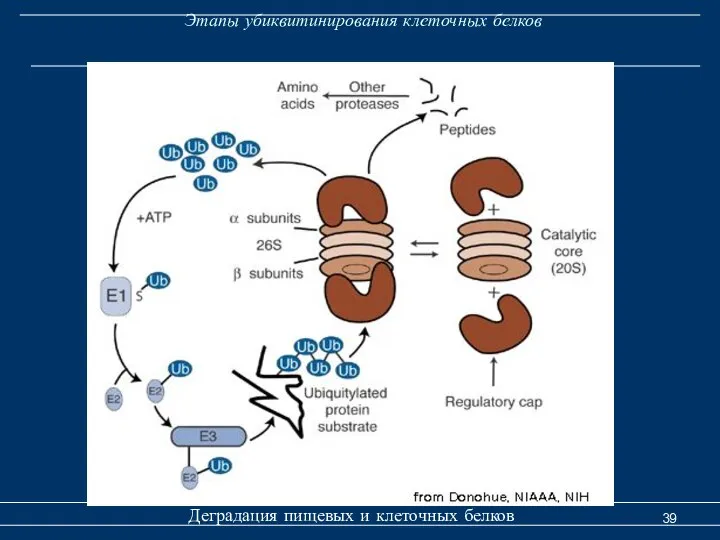
- 39. Этапы убиквитинирования клеточных белков Деградация пищевых и клеточных белков
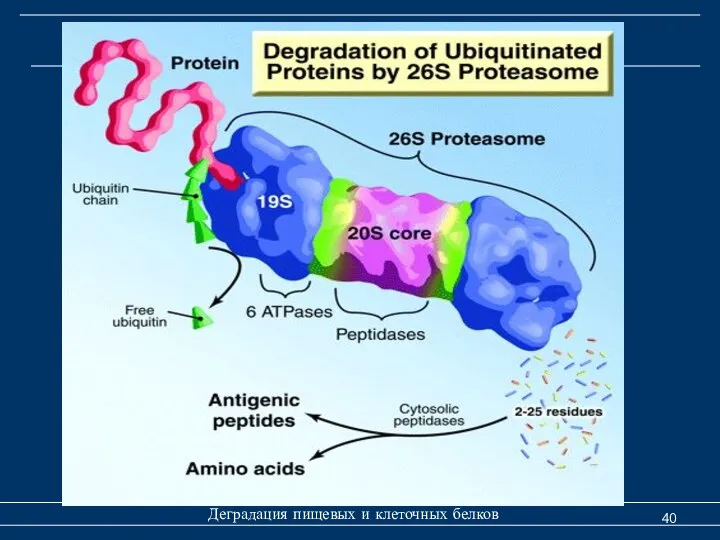
- 40. Деградация клеточных белков Деградация пищевых и клеточных белков
- 41. Деградация клеточных белков Деградация пищевых и клеточных белков Убиквитин-зависимая деградация белков Е1 - убиквитин- активирующий фермент
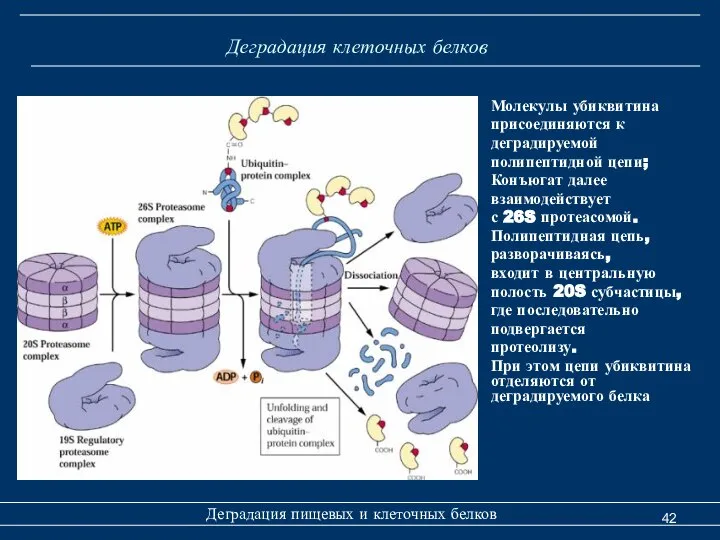
- 42. Деградация клеточных белков Деградация пищевых и клеточных белков Молекулы убиквитина присоединяются к деградируемой полипептидной цепи; Конъюгат
- 43. Деградация клеточных белков Деградация пищевых и тканевых белков Лизосомальный путь Лизосомы - это главные пищеварительные органеллы
- 45. Скачать презентацию






















 Физические свойства минералов
Физические свойства минералов Дифузія у побуті
Дифузія у побуті Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс Физико – химические характеристики электротехнических материалов
Физико – химические характеристики электротехнических материалов Сера и её соединения
Сера и её соединения Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Особенности металла" - скачать смотреть
Презентация по Химии "Особенности металла" - скачать смотреть  Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро
Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро Наука химия. Роль химии в промышленности
Наука химия. Роль химии в промышленности Соединения терпеноидной структуры. Тема № 3
Соединения терпеноидной структуры. Тема № 3 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Биоэнергетика. Часть первая
Биоэнергетика. Часть первая ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  The law of mass conservation
The law of mass conservation Предпрофильный курс Мир химии
Предпрофильный курс Мир химии Металлы. Общая характеристика
Металлы. Общая характеристика Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения
Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения Основы общей химии
Основы общей химии Підготувала Учениця 11 класу Лемак Андріана
Підготувала Учениця 11 класу Лемак Андріана  Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Агрохимия растений
Агрохимия растений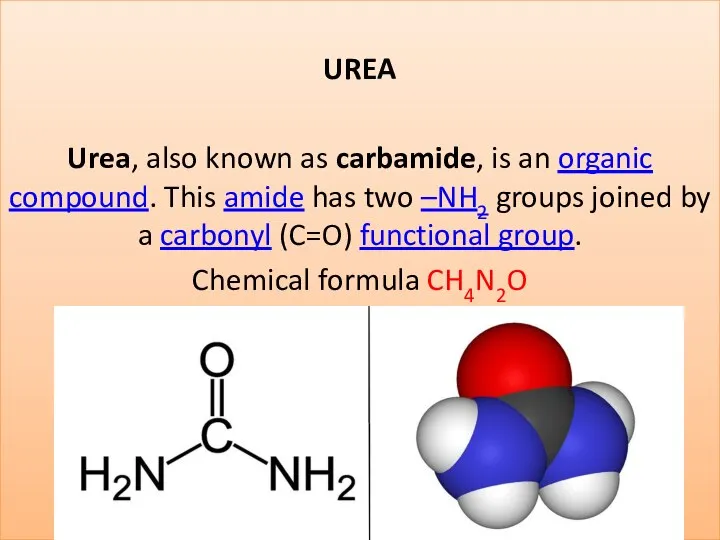 Urea (carbamide)
Urea (carbamide) Химия в строительстве
Химия в строительстве ИК-спектроскопия органических соединений
ИК-спектроскопия органических соединений Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ