Содержание
- 2. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
- 3. Физические свойства серы Твёрдое кристаллическое вещество желтого цвета, без запаха Плохо проводит теплоту и не проводит
- 4. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
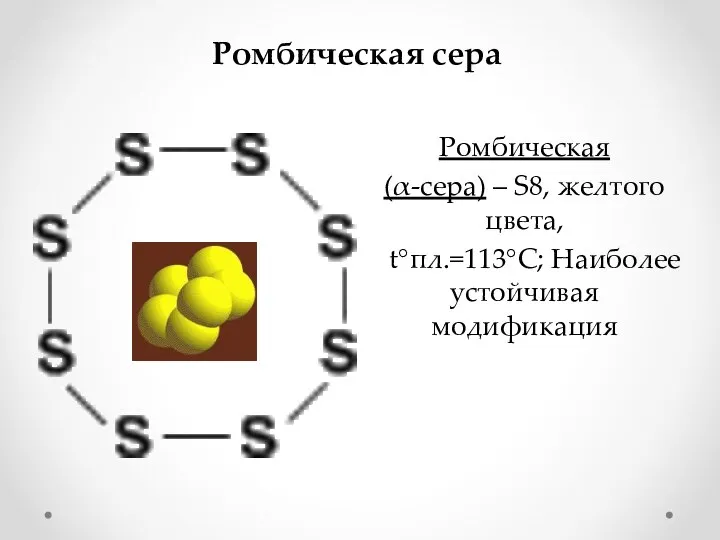
- 6. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
- 7. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
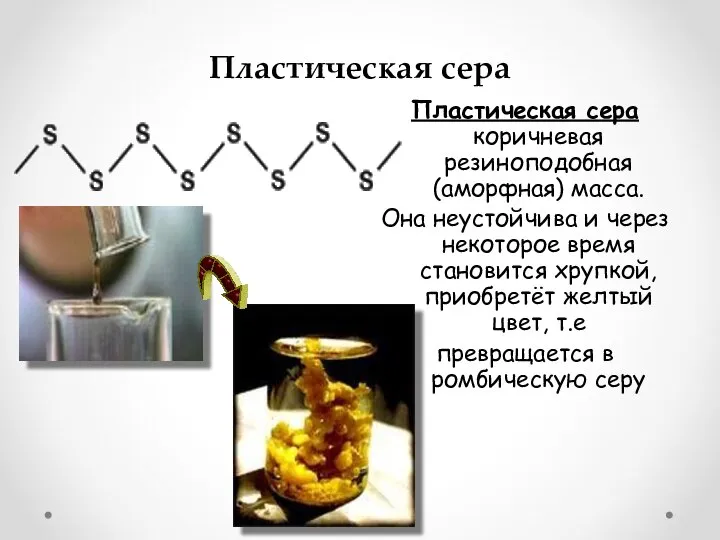
- 8. Пластическая сера Пластическая сера коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 9. Химические свойства серы (восстановительные) Сера проявляет в реакциях с сильными окислителями: S - 2ē → S+2;
- 10. Химические свойства серы (окислительные) S0 + 2ē → S-2 4) Сера реагирует со щелочными металлами без
- 11. Сероводород Газ бесцветный запах тухлых яиц ядовит хорошо растворим в воде (сероводородная кислота) FeS + 2HCl=
- 12. 1) Горение сероводорода. Полное сгорание (при избытке O2) 2H2S-2 + 3O2 → 2S+4O2 + 2H2O Неполное
- 13. . H2S-2 + Br2 → S0 + 2HBr H2S-2 + 2FeCl3 → 2FeCl2 + S0 +
- 14. . Взаимодействует с основаниями: H2S + 2NaOH изб. → Na2S + 2H2O H2S изб. + NaOH
- 15. . Н2S + Pb(NO3)2 → PbS↓ + 2HNO3 Pb2+ + S2- → PbS↓ черный черный 4)
- 16. Диоксид серы 4 Fe S2 + 11 O2 = 2 Fe2 O3 + 8 S O2
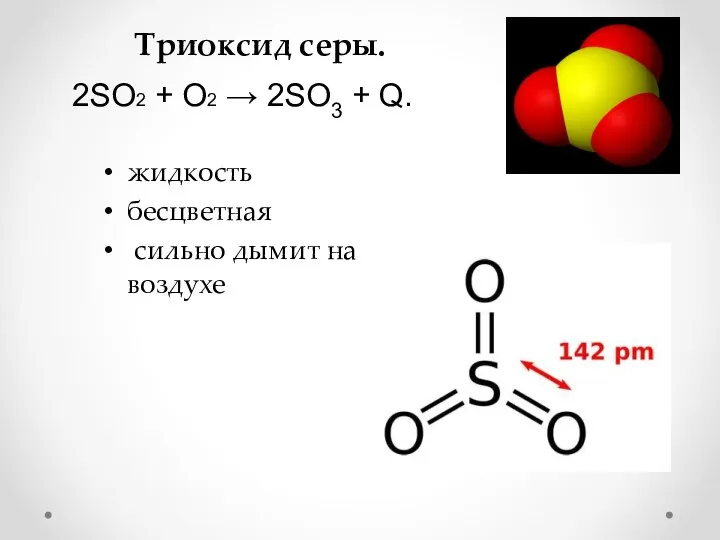
- 17. Триоксид серы. жидкость бесцветная сильно дымит на воздухе 2SO2 + O2 → 2SO3 + Q.
- 19. Скачать презентацию













 Общие свойства металлов. Сплавы
Общие свойства металлов. Сплавы Ионная химическая связь
Ионная химическая связь Вода и минеральные вещества. (Лекция 2)
Вода и минеральные вещества. (Лекция 2) Обмен нуклеопротеинов. (Лекция 17)
Обмен нуклеопротеинов. (Лекция 17) Структура периодической системы элементов
Структура периодической системы элементов ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Современные проблемы химической технологии керамики
Современные проблемы химической технологии керамики Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1)
Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1) Титрування. Хімічний посуд в титриметричному аналізі
Титрування. Хімічний посуд в титриметричному аналізі Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Fuel cells
Fuel cells Экоаналитический контроль воздуха
Экоаналитический контроль воздуха Окислительно-востановительные реакции
Окислительно-востановительные реакции Анализ эфирного масла. Физические и химические показатели
Анализ эфирного масла. Физические и химические показатели Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11
Технологічні і біохімічні властивості м´яса і м´ясопродуктів. Лекція 11 Соли и реакции ионного обмена
Соли и реакции ионного обмена Основы молекулярной биологии
Основы молекулярной биологии Сірники Гончарук О. 10-Б
Сірники Гончарук О. 10-Б  Важнейшие бинарные соединения
Важнейшие бинарные соединения Предмет органической химии
Предмет органической химии Экспериментальные методы СВС-технологии. Микровидеосъемка
Экспериментальные методы СВС-технологии. Микровидеосъемка Биологиялық белсенді қосылыстардың иондалу және липофильділік мәселелері
Биологиялық белсенді қосылыстардың иондалу және липофильділік мәселелері Углерод. Кремний
Углерод. Кремний Коррозия металлов
Коррозия металлов Горение водорода
Горение водорода Элективный курс "Решение задач по химии повышенного уровня сложности"
Элективный курс "Решение задач по химии повышенного уровня сложности"