Содержание
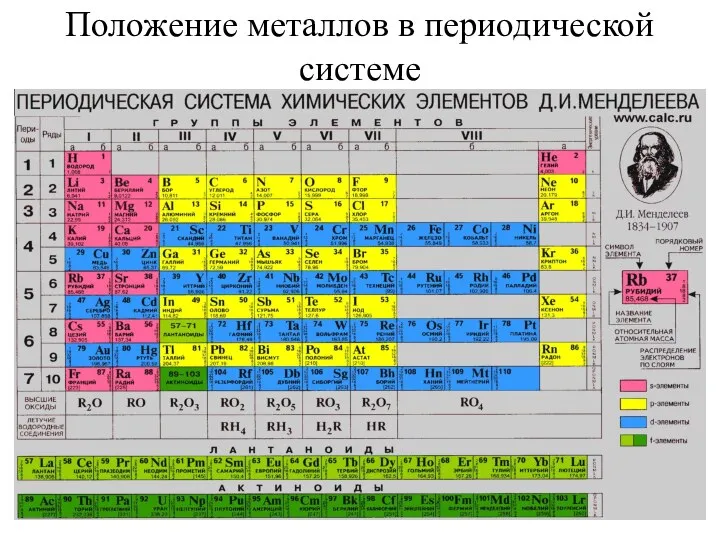
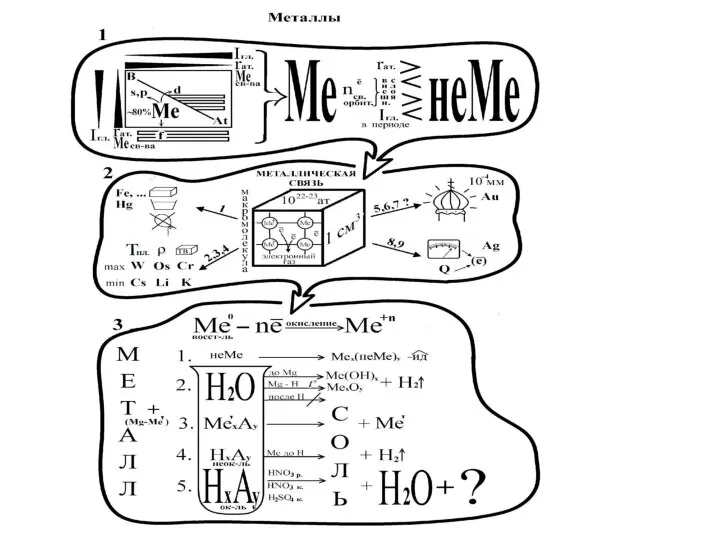
- 2. Положение металлов в периодической системе
- 3. Содержание металлов в земной коре Al–7,5% по массе, Fe – 4,7 Mn – 0,1 Cr –
- 4. Металлическая связь является делокализованной и ненаправленной, поскольку свободные е- принадлежат всему кристаллу металла. В соответствии с
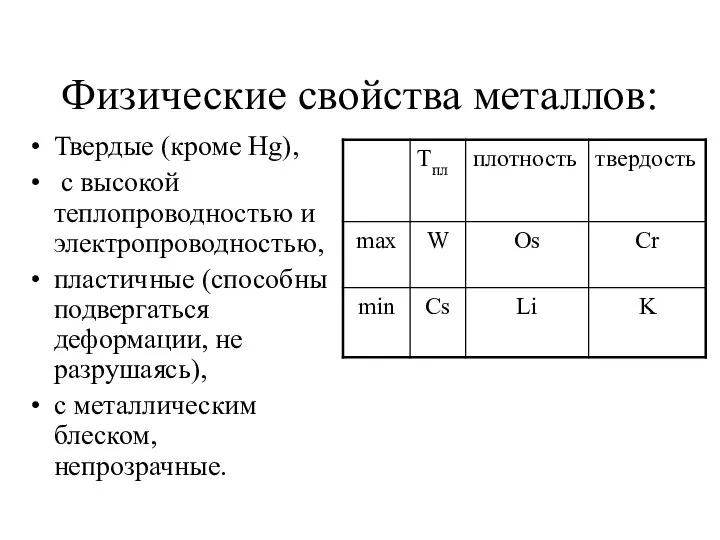
- 5. Физические свойства металлов: Твердые (кроме Hg), с высокой теплопроводностью и электропроводностью, пластичные (способны подвергаться деформации, не
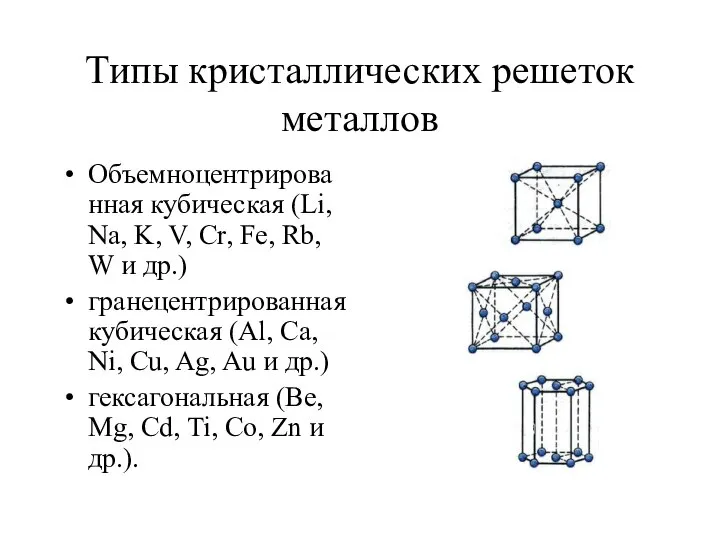
- 6. Типы кристаллических решеток металлов Объемноцентрированная кубическая (Li, Na, K, V, Cr, Fe, Rb, W и др.)
- 7. Получение металлов
- 8. Пирометаллургия - извлечение металлов из руд при высоких температурах: CuO+C=2Cu+CO↑ Fe2O3+3CO =2Fe+3CO2 2ZnS+3O2=2ZnO+2SO2; ZnO+C=Zn+CO Металлотермия -
- 9. Гидрометаллургия - извлечение металлов из руд водными растворами реагентов с последующим выделением из раствора: 4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH 2Na[Au(CN)2]+Zn=2Na[Zn(CN)2]+2Au
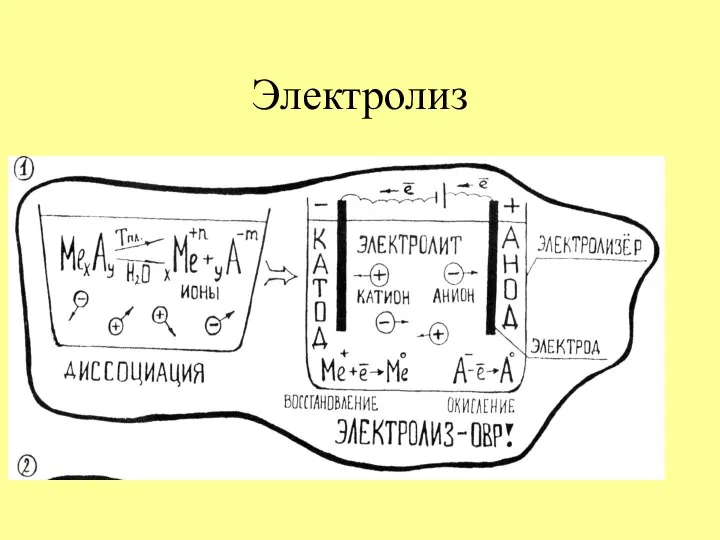
- 10. Электролиз
- 11. Общие химические свойства металлов Ме - восстановители, способные отдавать 1-2 е-, превращаясь в положительные ионы.
- 12. Взаимодействие с неметаллами 4Fe+3O2=2Fe2O3 оксид железа (III) в-ль 2Fe0-6e-=2Fe3+ 6|2 ок-ль O20+4e-=2O2- 4|3 2Na+H2=2NaH гидрид натрия
- 13. Восстановительные свойства металлов в растворах характеризуются значением стандартного электродного потенциала (положением в ряду стандартных электродный потенциалов).
- 14. Взаимодействие с водой Ме до Н →восстанавливают H2↑: Активные металлы → гидроксиды: 2Li+2H2O=2LiOH+H2↑ Li0-e-=Li+ │2 2H++2e-=H2
- 15. С растворами щелочей взаимодействуют Ме, оксиды и гидроксиды которых обладают амфотерными свойствами: Be, Al, Zn, Sn,
- 16. С кислотами - неокислителями Ме, стоящие до Н → соль + H2↑ . Zn+2HCl=ZnCl2+H2↑ Zn0-2e-=Zn2+ 2│1
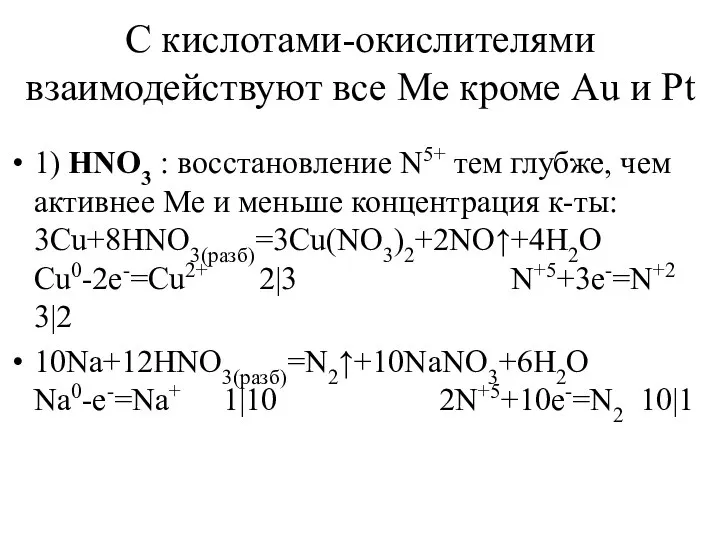
- 17. С кислотами-окислителями взаимодействуют все Ме кроме Au и Pt 1) HNO3 : восстановление N5+ тем глубже,
- 18. 2) c H2SO4(конц) по Mg (включ.) → H2S Mg – Zn → S после Zn →
- 19. С растворами солей Ме, начиная с Mg, вытесняют правее стоящие Ме из растворов их солей: Zn+Pb(NO3)2=Pb+Zn(NO3)2
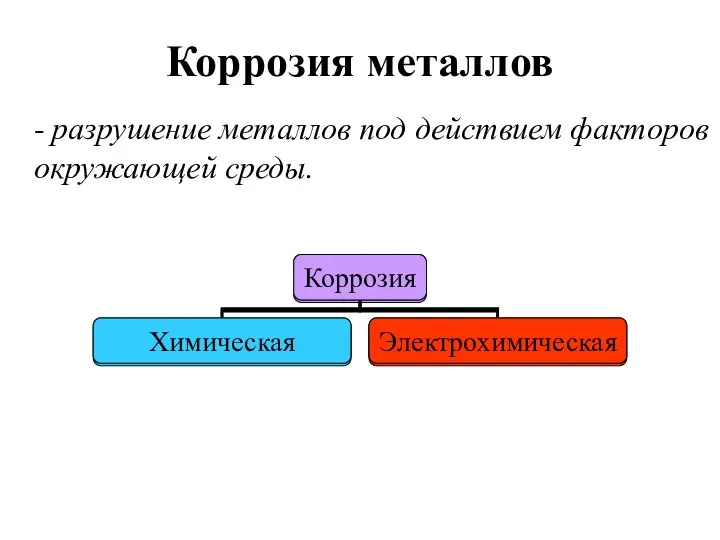
- 21. Коррозия металлов - разрушение металлов под действием факторов окружающей среды.
- 22. Химическая коррозия - гетерогенный процесс, протекающий при высоких to, в атмосфере агрессивных газов (газовая коррозия), или
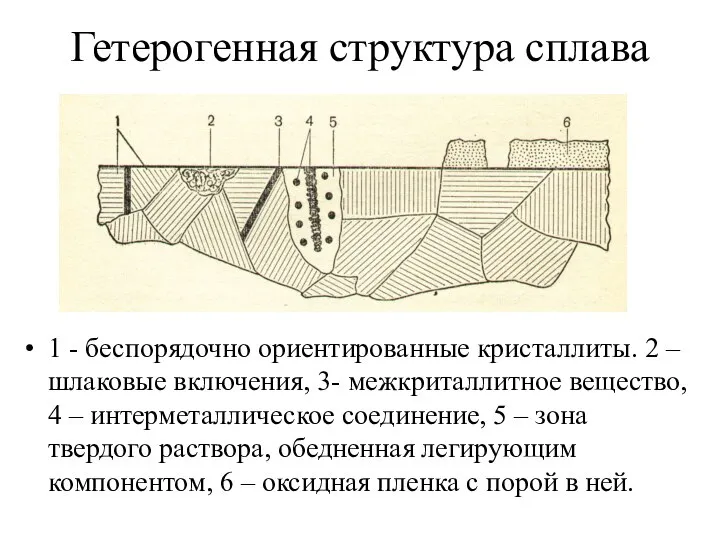
- 23. Гетерогенная структура сплава 1 - беспорядочно ориентированные кристаллиты. 2 – шлаковые включения, 3- межкриталлитное вещество, 4
- 24. Электрохимическая коррозия - разрушение металла в среде электролита. Поверхность Ме неоднородна (включения, дефекты, грязь). В растворе
- 25. Модель гальвано-пары Fe-Cu в кислой и нейтральной средах: Fe (более активный металл, с более отрицательным электродным
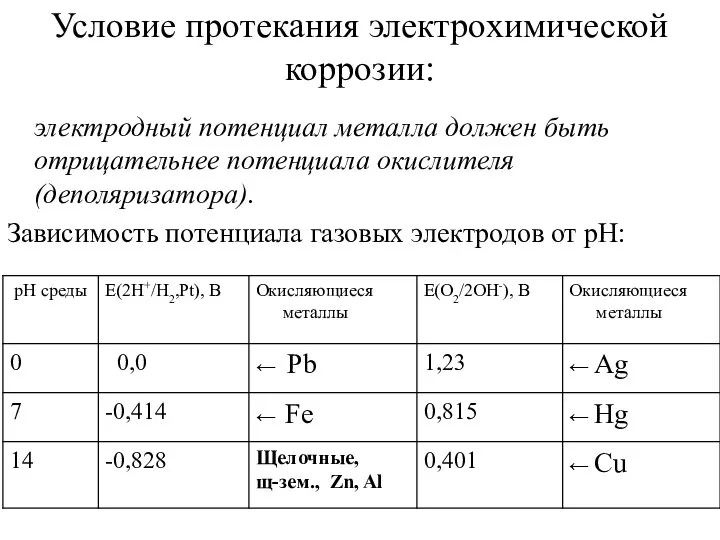
- 26. Условие протекания электрохимической коррозии: электродный потенциал металла должен быть отрицательнее потенциала окислителя (деполяризатора). Зависимость потенциала газовых
- 27. Пассивность металла – состояние повышенной коррозионной устойчивости металлов, которое не соответствует их термодинамической устойчивости. Fe,Cr, Al
- 28. Защита металлов от коррозии 1). Электрохимическая защита : а). Анодная защита – перевод пассивирующихся металлов (Fe,
- 29. 2) Легирование сплавов – введение в сплавы добавок, повышающих химическую стойкость. 3) Изоляция поверхности металлов от
- 31. Скачать презентацию




![Гидрометаллургия - извлечение металлов из руд водными растворами реагентов с последующим выделением из раствора: 4Au+O2+8NaCN+2H2O=4Na[Au(CN)2]+4NaOH 2Na[Au(CN)2]+Zn=2Na[Zn(CN)2]+2Au](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/665369/slide-8.jpg)






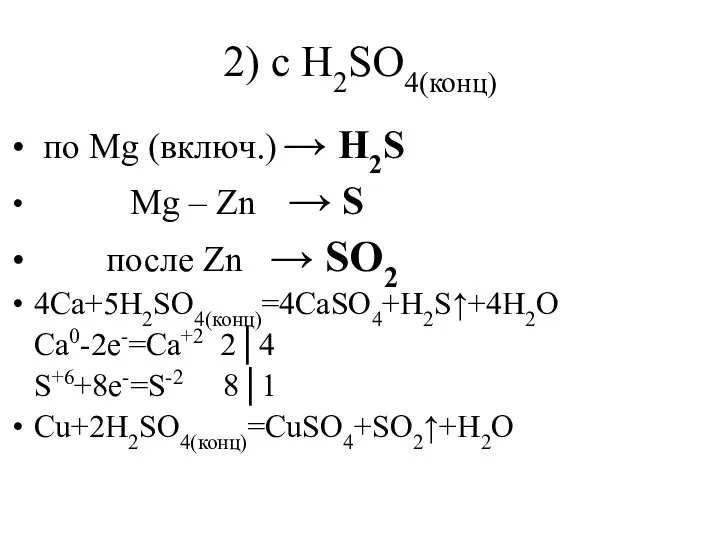







 Химия наука о веществах и законах их превращений
Химия наука о веществах и законах их превращений Парфюмерия. Основные химические элементы, производство
Парфюмерия. Основные химические элементы, производство Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Происхождение химических элементов
Происхождение химических элементов Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом Повторительное обобщение по неорганической химии, подготовка к ГИА
Повторительное обобщение по неорганической химии, подготовка к ГИА Автомобильные масла. Классификация и применение автомобильных масел
Автомобильные масла. Классификация и применение автомобильных масел Типы химических реакций
Типы химических реакций Полимеры
Полимеры Минералы и Близнецы
Минералы и Близнецы Дисперсные системы. Строение коллоидных частиц лиофобных золей
Дисперсные системы. Строение коллоидных частиц лиофобных золей Типы химических реакций
Типы химических реакций  Термодинамика. 2 закон термодинамики. Энтропия
Термодинамика. 2 закон термодинамики. Энтропия Химическая очистка воды
Химическая очистка воды Реакции окисления-восстановления в химическом анализе. (Лекция 8.3)
Реакции окисления-восстановления в химическом анализе. (Лекция 8.3) Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13)
Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13) Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове
Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове  Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Гидротермальные месторождения. (Лекция 10)
Гидротермальные месторождения. (Лекция 10) Структура ЕГЭ по химии. Электролиз
Структура ЕГЭ по химии. Электролиз Весь курс химии. Кратко
Весь курс химии. Кратко Уравнения химических реакций
Уравнения химических реакций Атомы, молекулы и ионы
Атомы, молекулы и ионы Химическая связь
Химическая связь Характеристика химического элемента-металла на основании его положения в ПСХЭ Д.И.Менделеева
Характеристика химического элемента-металла на основании его положения в ПСХЭ Д.И.Менделеева Известные ученые и их открытия
Известные ученые и их открытия Химические свойства воды
Химические свойства воды Азотная кислота. Состав. Строение. Физические свойства
Азотная кислота. Состав. Строение. Физические свойства