Содержание
- 2. Простые правила
- 3. Лекция 1. РАСТВОРЫ Якоб Хендрик Вант-Гофф 1852-1911 Сванте Август Аррениус 1859-1927 Фридрих Вильгельм Оствальд 1853-1932 Рихард
- 4. Раствор - гомогенная (однородная) система переменного состава, состоящая из двух и более компонентов. Компоненты раствора Растворитель
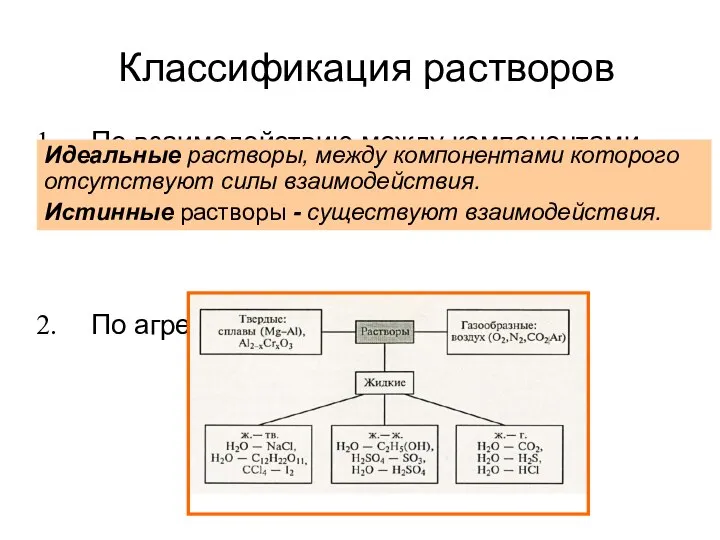
- 5. Классификация растворов По взаимодействию между компонентами раствора (идеальные и истинные (реальные)) По агрегатному состоянию Идеальные растворы,
- 6. 3. По размеру частиц растворенного вещества : истинные растворы – однородные (гомогенные) системы с размером частиц
- 7. концентрированные (с большим содержанием растворенного вещества) и разбавленные (с небольшим содержанием). 5. По количеству растворенного вещества:
- 8. Подробнее о способах выражения состава растворов и связи между ними вы познакомитесь на лабораторных занятиях Способы
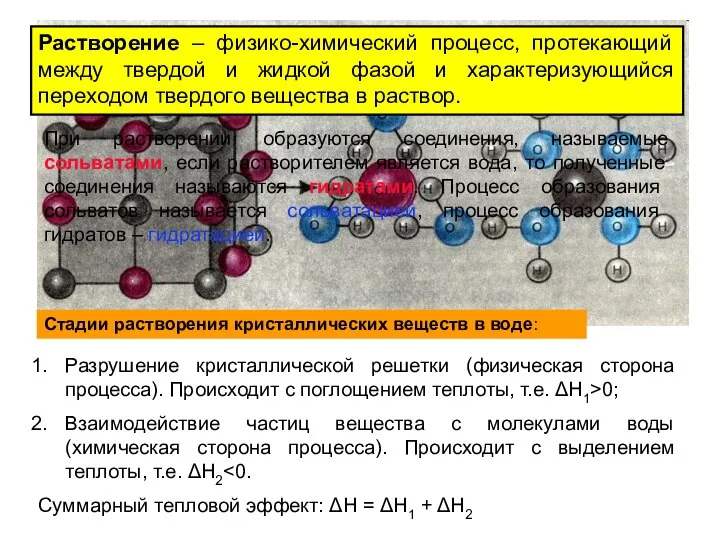
- 9. Растворение – физико-химический процесс, протекающий между твердой и жидкой фазой и характеризующийся переходом твердого вещества в
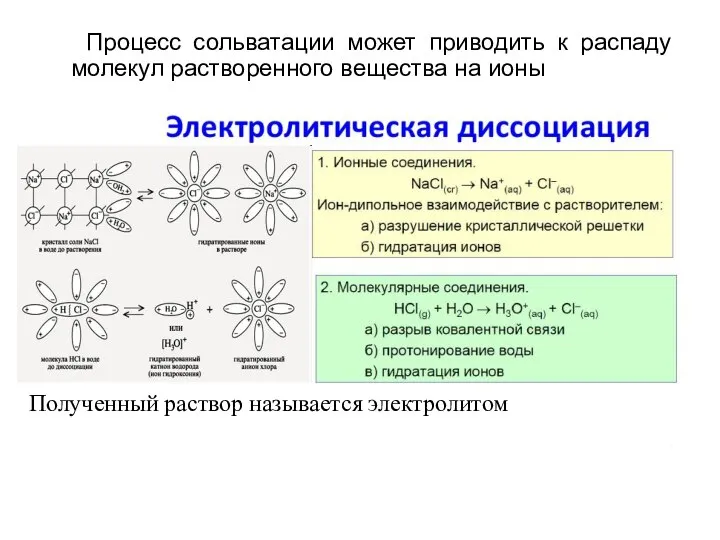
- 10. Процесс сольватации может приводить к распаду молекул растворенного вещества на ионы
- 11. Слабые и сильные электролиты
- 12. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации. Степень диссоциации (α – греческая буква
- 13. Степень диссоциации зависит от: - природы электролита и растворителя: чем полярнее химическая связь в молекуле электролита
- 14. Константа диссоциации Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса, является обратимой реакцией, например: KA ↔ K+
- 15. Связь константы диссоциации и степени диссоциации (закон разведения Оствальда) Для очень слабых электролитов при α
- 16. Особенности растворов сильных электролитов Вследствие полной диссоциации число ионов в растворе сильных электролитов больше, чем в
- 17. В разбавленных растворах γ = 1, тогда а = С. Коэффициент активности иона (γ) зависит от
- 18. Ионная сила раствора (I) - величина, характеризующая силу электростатического взаимодействия ионов в растворе, которая равна полусумме
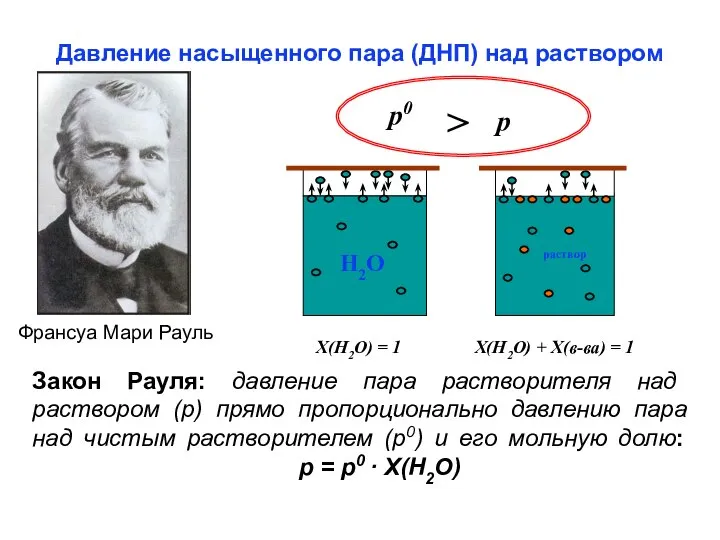
- 20. Давление насыщенного пара (ДНП) над раствором Франсуа Мари Рауль p0 > p Х(Н2О) = 1 Х(Н2О)
- 21. Вторая формулировка закона Рауля: относительное понижение давления насыщенного пара растворителя (p0) над раствором (p) нелетучего неэлектролита
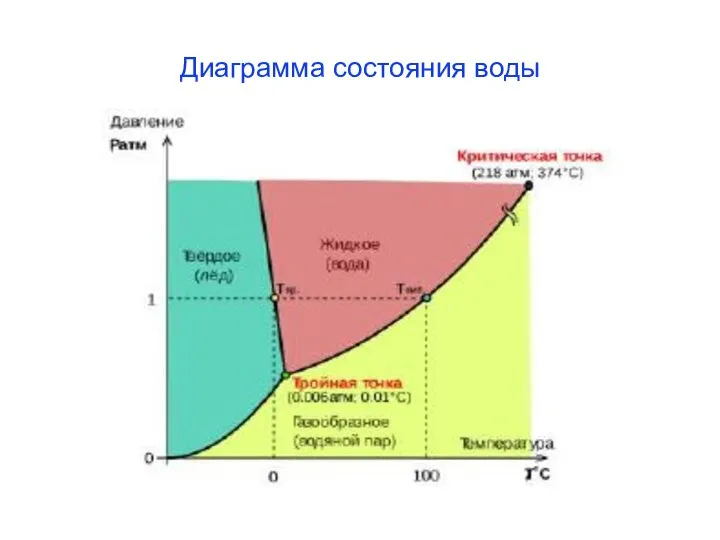
- 22. Диаграмма состояния воды
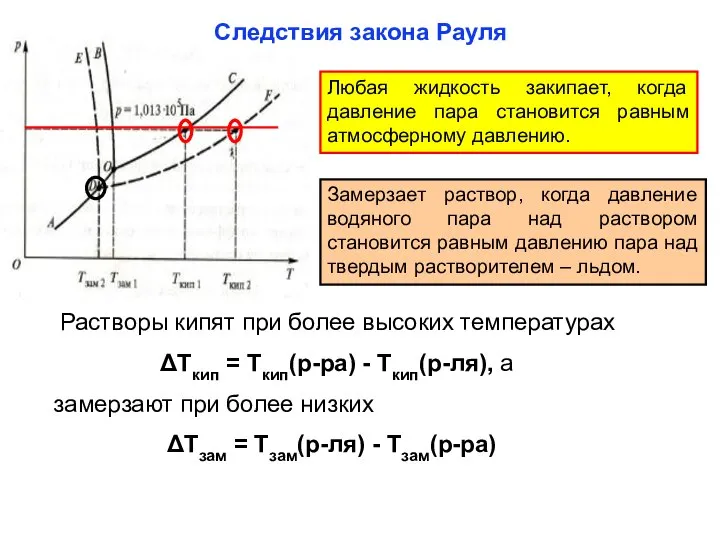
- 23. Следствия закона Рауля Любая жидкость закипает, когда давление пара становится равным атмосферному давлению. Замерзает раствор, когда
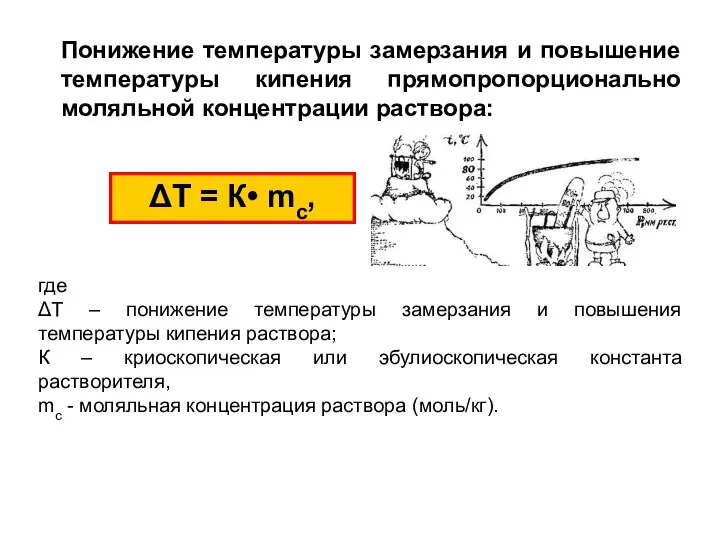
- 24. Понижение температуры замерзания и повышение температуры кипения прямопропорционально моляльной концентрации раствора: ΔТ = К• mс, где
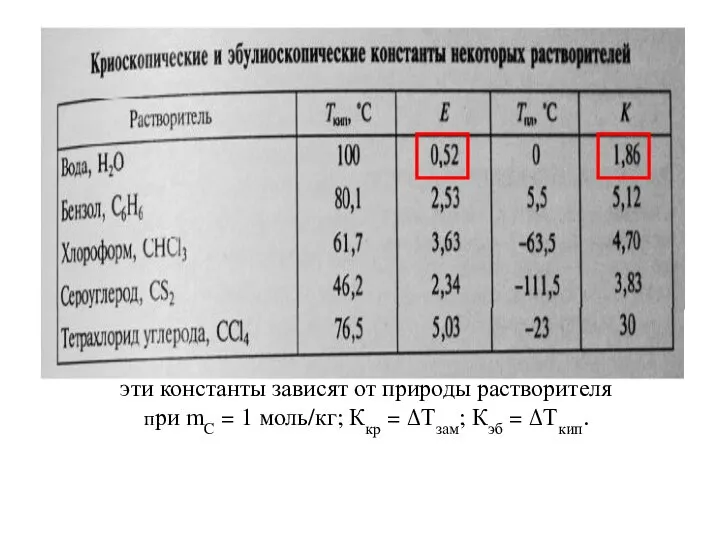
- 25. эти константы зависят от природы растворителя при mC = 1 моль/кг; Ккр = ΔТзам; Кэб =
- 26. В растворах электролитов число частиц больше из-за диссоциации. Вант-Гофф дал поправочный изотонический коэффициент i, который учитывает
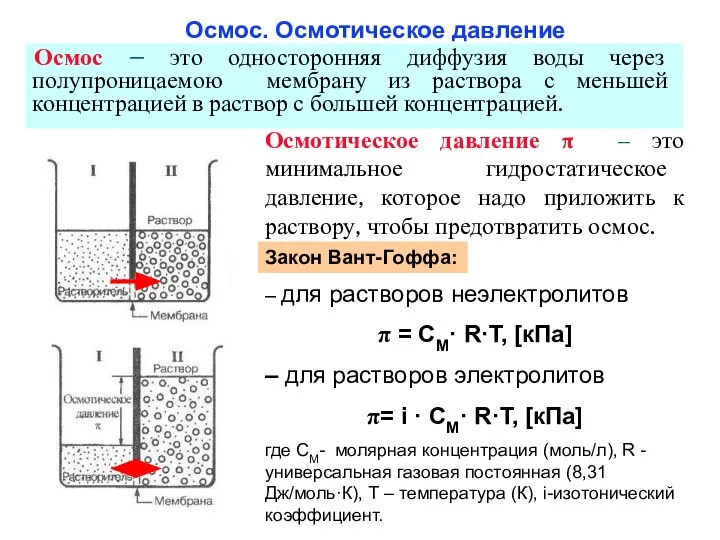
- 27. Осмос. Осмотическое давление Осмос – это односторонняя диффузия воды через полупроницаемою мембрану из раствора с меньшей
- 28. В организме осмотическое давление должно быть постоянным (изоосмия): π (плазмы)=7,7 атм= 740-780 кПа = 280-310 мОсм/л
- 29. Растворы, у которых π больше, чем у π (плазмы) , называются гипертоническими. В медицине они применяются
- 30. Растворы, у которых π меньше, чем у π (плазмы) , называются гипотоническими. В медицине они практически
- 31. Значение осмоса ⮚ упругость, тургор клеток ⮚ эластичность тканей, форма органов ⮚ усвоение пищи, образование лимфы,
- 32. Методы, основанные на изучении коллигативных свойств растворов осмометрия – измерение π, криоскопия – измерение ΔТзам (р-ра),
- 33. Применяются для определения : молекулярных масс различных веществ, чаще всего биополимеров (белков); суммарной концентрации всех растворенных
- 34. Криоскопическому методу исследования отдается предпочтение, поскольку температуру замерзания можно измерить с большой точностью и при низких
- 36. Скачать презентацию
























 Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Презентация по Химии "Бензол" - скачать смотреть бесплатно
Презентация по Химии "Бензол" - скачать смотреть бесплатно Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) Минералы
Минералы Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Синильная Кислота - циановодород
Синильная Кислота - циановодород Решение задач на растворы и смеси
Решение задач на растворы и смеси Фенолы и их производные
Фенолы и их производные Неотъемлемый аксессуар современного человека
Неотъемлемый аксессуар современного человека Нефть
Нефть  Презентация по Химии "Синтетические моющие средства" - скачать смотреть
Презентация по Химии "Синтетические моющие средства" - скачать смотреть  Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Українські вчені-хіміки
Українські вчені-хіміки Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Жиры. Классификация
Жиры. Классификация Химиялық байланыстың табиғаты
Химиялық байланыстың табиғаты Судың құрамы және физикалық қасиеттері
Судың құрамы және физикалық қасиеттері Марки бензина
Марки бензина Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1
Соли в природе. Реакции с участием солей. Модуль 2. Лекция 2.1 Химия в сельском хозяйстве
Химия в сельском хозяйстве Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Природный и синтетический каучуки
Природный и синтетический каучуки Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Презентация по Химии "Уравнение Менделеева - Клапейрона" - скачать смотреть
Презентация по Химии "Уравнение Менделеева - Клапейрона" - скачать смотреть  Химия вокруг нас
Химия вокруг нас Омыляемые Липиды
Омыляемые Липиды Группа рассеянных химических элементов
Группа рассеянных химических элементов Сера
Сера