Содержание
- 2. Дисциплина Химия. Общая химия. Тема: Электролиз расплавов.
- 3. Понятие электролиза Электролиз – это окислительно-восстановительная реакция, которая протекает под действием электрического тока на электродах, погруженных
- 4. Понятие электролиз Существует два типа электродов. Анод – это электрод, на котором происходит окисление. Катод –
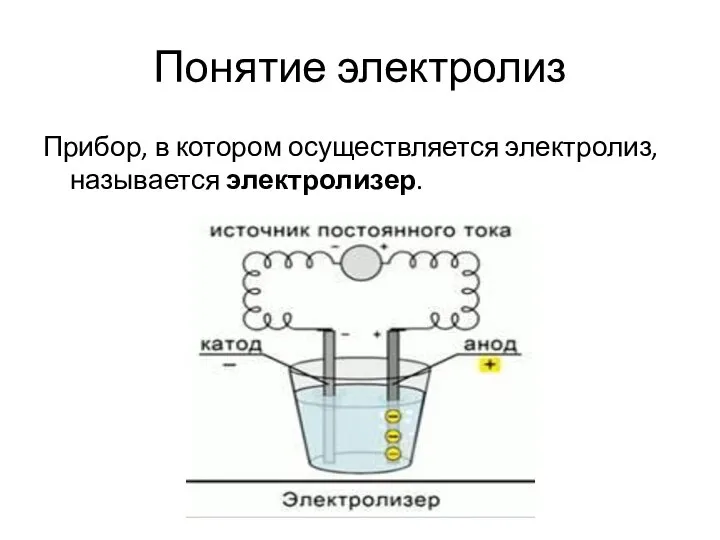
- 5. Понятие электролиз Прибор, в котором осуществляется электролиз, называется электролизер.
- 6. Электролиз расплава В расплавах электролиты диссоциируют на ионы. Это термическая диссоциация электролитов. При пропускании электрического тока
- 7. Электролиз расплава Пример №1. Электролиз расплава хлорида натрия При термической диссоциации хлорида натрия образуются ионы натрия
- 8. Электролиз расплава – суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2) 2 Na+ +
- 9. Электролиз расплава Пример №2. Электролиз расплава гидроксида калия При диссоциации гидроксида калия образуются ионы калия и
- 10. Электролиз расплава – суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4) 4К+ + 4ОН−
- 11. Электролиз расплавов Пример №3. Электролиз расплава сульфата натрия При диссоциации расплава сульфата натрия образуются ионы натрия
- 12. Электролиз расплавов – суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4) 4 Na+ +
- 14. Скачать презентацию










 Катализаторы для синтеза лекарственных препаратов и их строительных блоков
Катализаторы для синтеза лекарственных препаратов и их строительных блоков Оксосоединения. Основные понятия
Оксосоединения. Основные понятия Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица
Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица  Алкены (этен)
Алкены (этен) Химические свойства альдегидов
Химические свойства альдегидов Диэлектрофорез: движение клеток или частиц в неоднородном переменном электрическом поле
Диэлектрофорез: движение клеток или частиц в неоднородном переменном электрическом поле Химическая кинетика
Химическая кинетика Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Типы химических реакций
Типы химических реакций Химические свойства металлов Урок химии в 11 классе
Химические свойства металлов Урок химии в 11 классе Занимательная игра по химии
Занимательная игра по химии Презентация по Химии "Подгруппа углерода." - скачать смотреть бесплатно_
Презентация по Химии "Подгруппа углерода." - скачать смотреть бесплатно_ Металлы. Классификация металлов
Металлы. Классификация металлов Одинокие атомы
Одинокие атомы Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Количественное определение лекарственных средств
Количественное определение лекарственных средств Полимеры
Полимеры  Биологическая химия
Биологическая химия Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Основы составления балансов
Основы составления балансов Спирты и фенолы
Спирты и фенолы Липидтердің метаболизмі
Липидтердің метаболизмі Химия вокруг нас
Химия вокруг нас Химическая кинетика
Химическая кинетика Основы расчета реакторов
Основы расчета реакторов 140 лет дому, который построил Д.И. Менделеев
140 лет дому, который построил Д.И. Менделеев Кислородосодержащие органические соединения
Кислородосодержащие органические соединения