Содержание
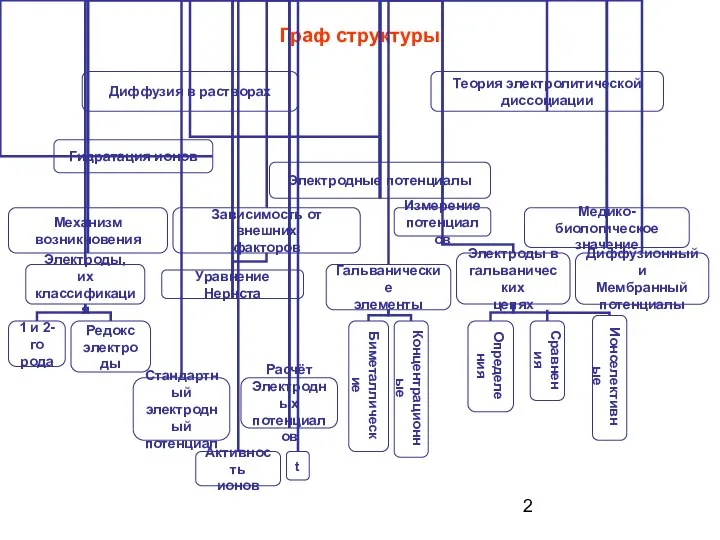
- 2. Граф структуры
- 3. Граф структуры
- 4. (22.09.1791 - 25.08.1867) Директор лаборатории (1825 г.) и профессор Королевского института (1827 г.). Самостоятельно проводил исследования
- 5. Электролиз – окислительно-восстановительный процесс, происходящий на электродах при прохождении постоянного электрического тока через раствор или расплав
- 6. Анод(+) – положительно заряженный электрод, на аноде окисляются (теряют электроны) анионы (АА)!!!!!!! – к Аноду идут
- 7. При электролизе растворов или расплавов различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ,
- 8. Задача Рассчитать массу хрома полученного электролизом раствора сульфата хрома(III) в течение 100 мин при силе тока
- 9. Решение Электролиз раствора сульфата хрома(III) можно представить cледующей схемой: Cr2(SO4)3 + 4H2O→2Cr + H2↑ + 2O2↑
- 10. Значение электролиза 1. Получение чистых металлов электролизом
- 11. Инертный анод Восстановление на катоде (–) Окисление на аноде (+) Инертный катод Схема электролиза
- 13. Электролитическое копирование гравированных пластин для печатания бумажных денег 2. Гальваническое осаждение металлов
- 14. 3. Создание химических источников тока. а) бытовые батарейки
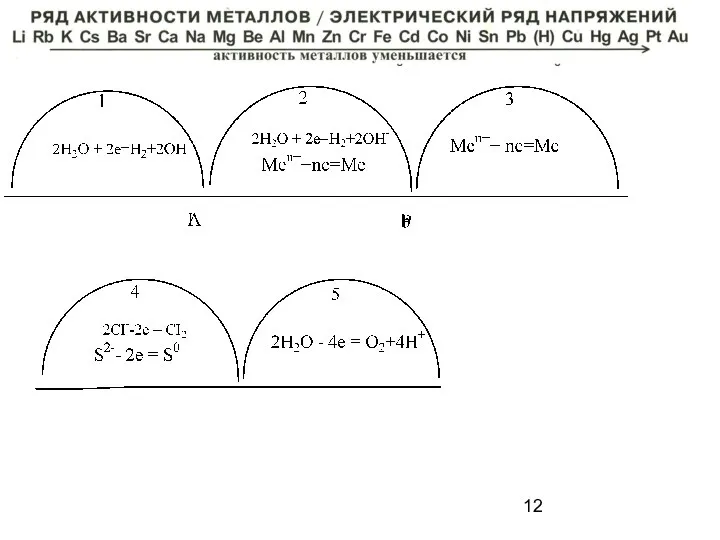
- 15. Коррозия – совокупность самопроизвольных окислительно -восстановительных процессов под воздействием окружающей среды, приводящих к разрушению металла. Men+-ne→
- 16. а) химическая – взаимодействие металлов с газами или жидкостями - неэлектролитами 2Fe+3SO2+3O2 Fe2(SO4)3
- 17. б) электрохимическая (распространена в гораздо большей степени! ее и обсудим!)
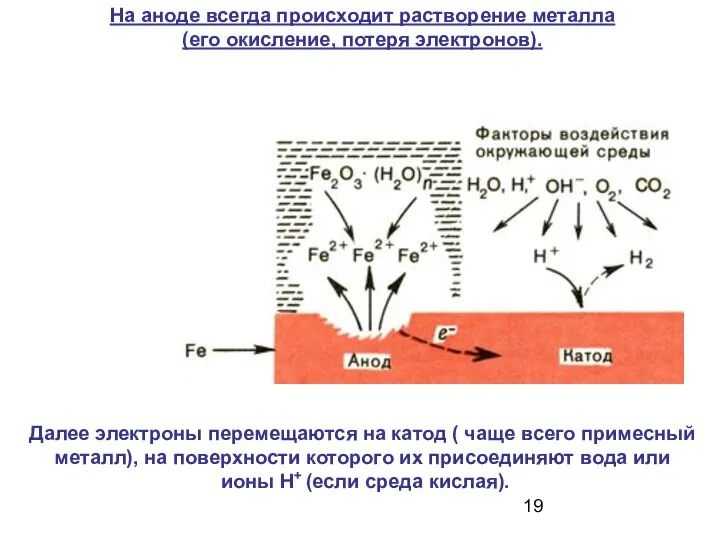
- 18. Металлы и их сплавы неоднородны, поэтому при контакте с водой на поверхности образуется множество гальванических пар.
- 19. Далее электроны перемещаются на катод ( чаще всего примесный металл), на поверхности которого их присоединяют вода
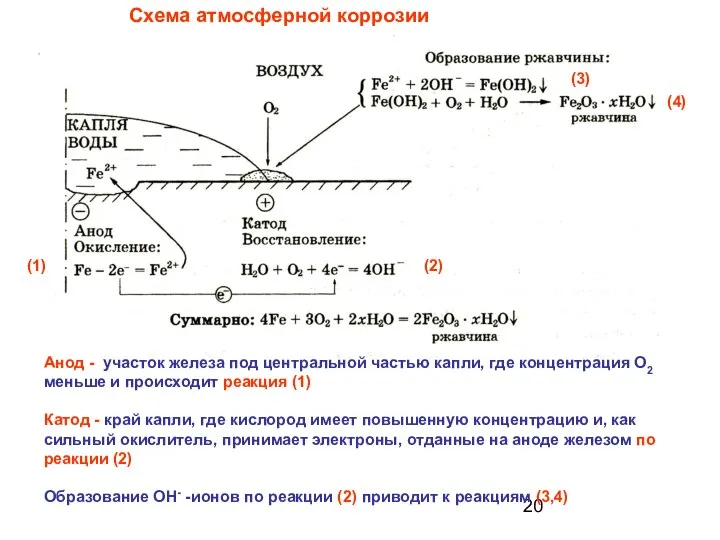
- 20. Схема атмосферной коррозии Анод - участок железа под центральной частью капли, где концентрация О2 меньше и
- 21. Процесс коррозии резко усиливается из-за наличия микропримесей менее активных, чем железо металлов, которые начинают выполнять роль
- 22. Защита от коррозии
- 23. 1. Защитное покрытие (лаки, краски, пленки, смазки) – блокируется выход металла в виде ионов и доступ
- 24. 3. Введение ингибиторов коррозии –чаще всего при транспортировке агрессивных жидкостей по железной дороге или трубопроводам 4.
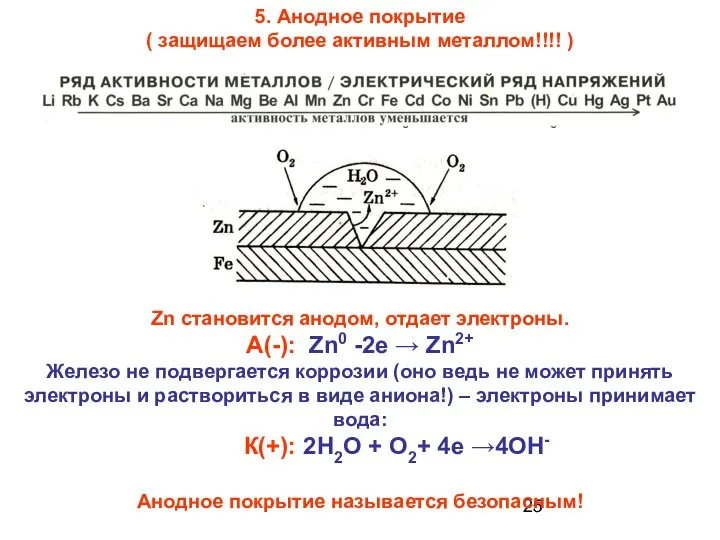
- 25. 5. Анодное покрытие ( защищаем более активным металлом!!!! ) Zn становится анодом, отдает электроны. А(-): Zn0
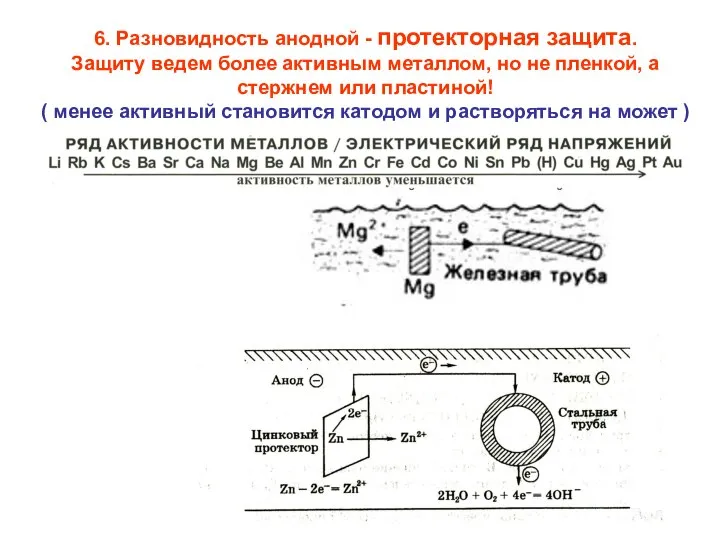
- 26. 6. Разновидность анодной - протекторная защита. Защиту ведем более активным металлом, но не пленкой, а стержнем
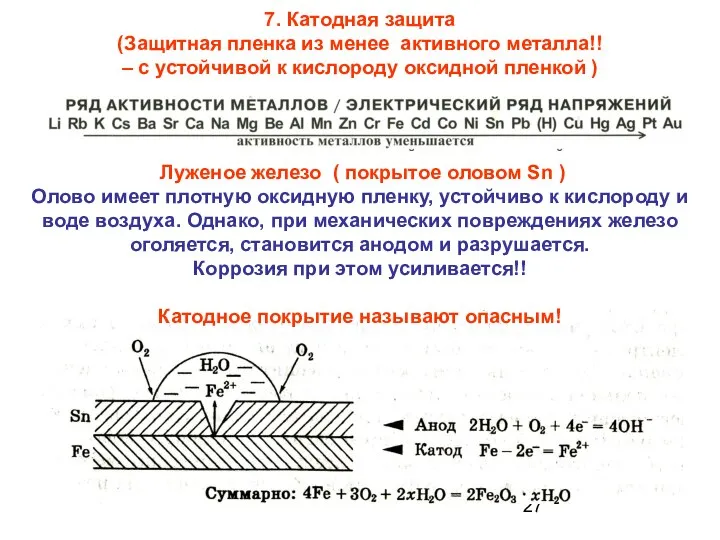
- 27. 7. Катодная защита (Защитная пленка из менее активного металла!! – с устойчивой к кислороду оксидной пленкой
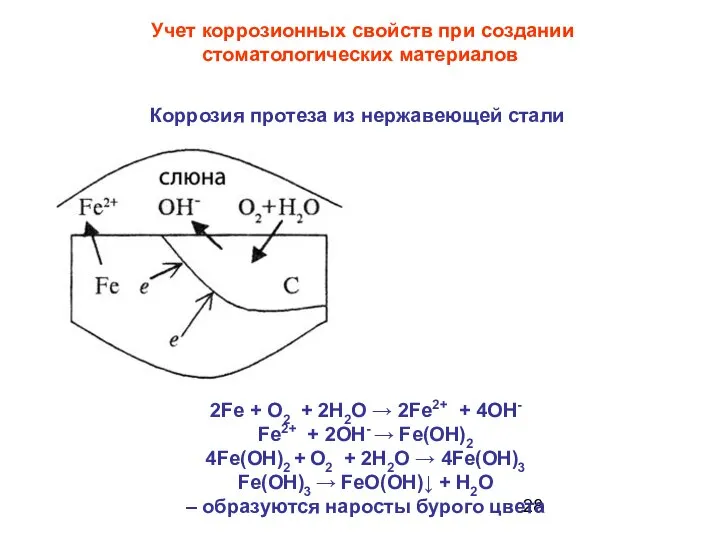
- 28. Учет коррозионных свойств при создании стоматологических материалов Коррозия протеза из нержавеющей стали 2Fe + О2 +
- 29. Параллельно протекает реакция Fe + 2Н2O - 2е→ Fe(ОН)2 + 2Н+ - у больных с протезами
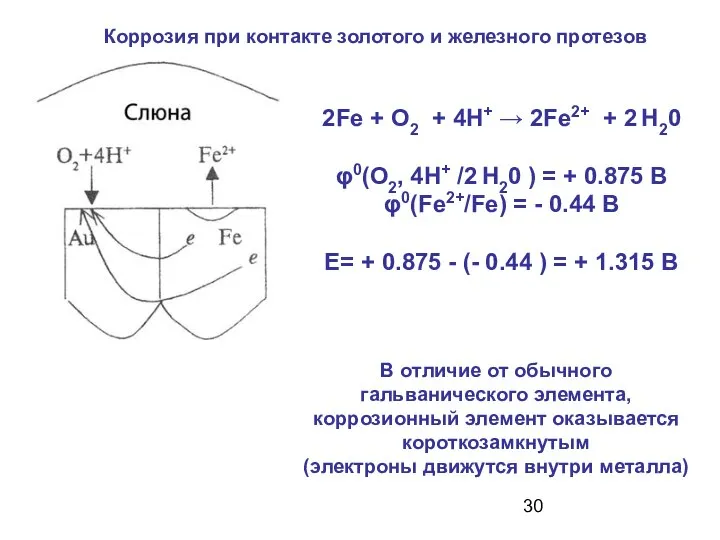
- 30. Коррозия при контакте золотого и железного протезов 2Fe + О2 + 4Н+ → 2Fe2+ + 2
- 31. В 1888-1889 гг. Нернст изучал поведение электролитов при пропускании электрического тока и открыл фундаментальный закон, известный
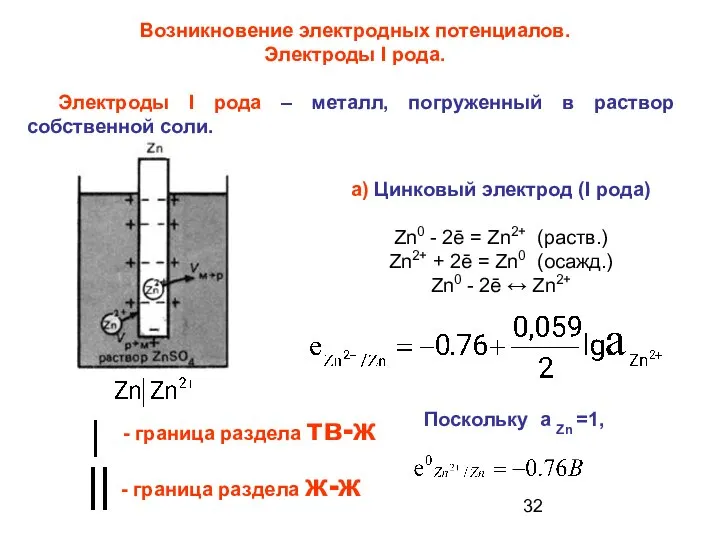
- 32. Возникновение электродных потенциалов. Электроды I рода. Электроды I рода – металл, погруженный в раствор собственной соли.
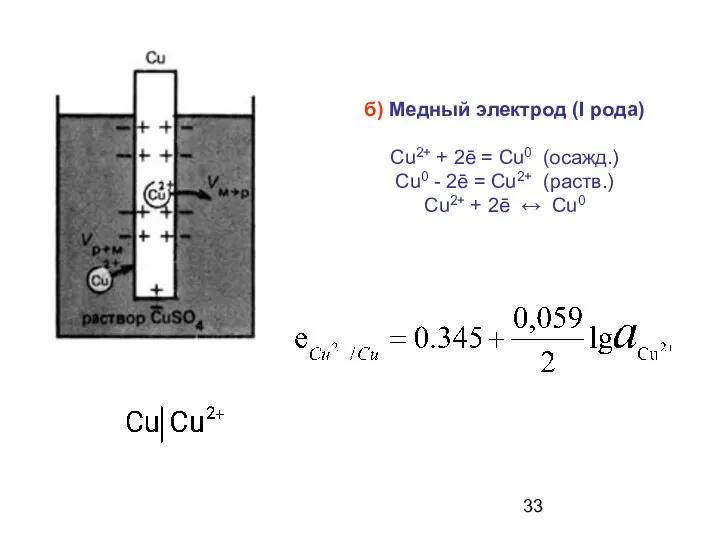
- 33. б) Медный электрод (I рода) Cu2+ + 2ē = Cu0 (осажд.) Cu0 - 2ē = Cu2+
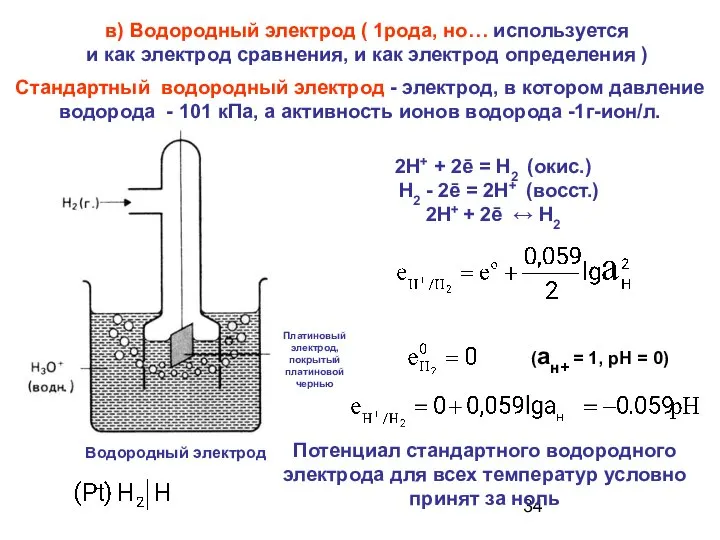
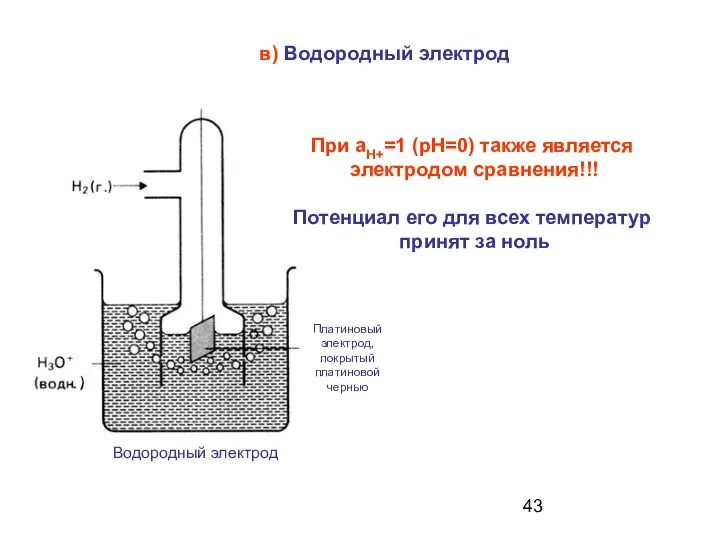
- 34. в) Водородный электрод ( 1рода, но… используется и как электрод сравнения, и как электрод определения )
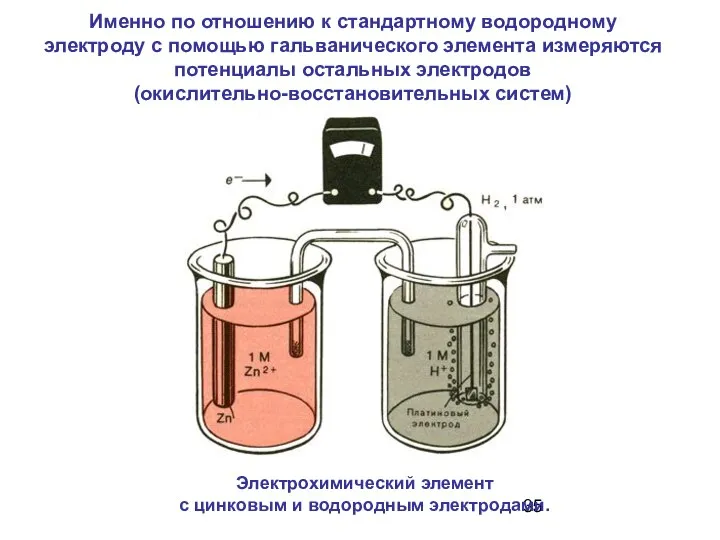
- 35. Электрохимический элемент с цинковым и водородным электродами. Именно по отношению к стандартному водородному электроду с помощью
- 36. Стандартные электродные потенциалы в водной среде при 198 К.
- 37. Пользуясь значениями ео, можно прогнозировать возможность протекания и направление окислительно-восстановительной реакции. F2 + 2e → 2F-
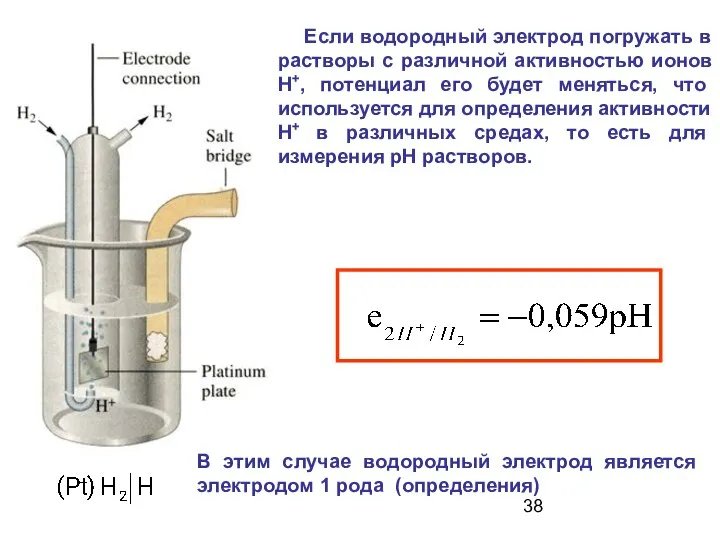
- 38. Если водородный электрод погружать в растворы с различной активностью ионов Н+, потенциал его будет меняться, что
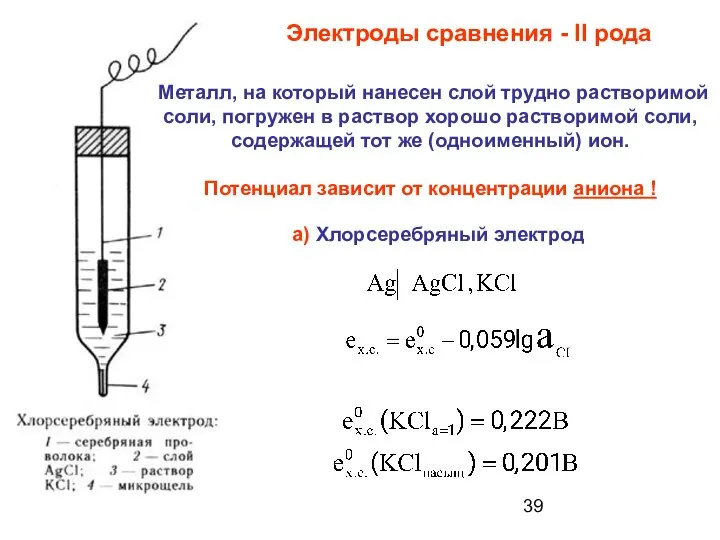
- 39. Электроды сравнения - II рода а) Хлорсеребряный электрод Металл, на который нанесен слой трудно растворимой соли,
- 40. Вывод уравнения потенциала хлорсеребряного электрода: 1 – серебряная проволока 2 – слой АgCI 3 – раствор
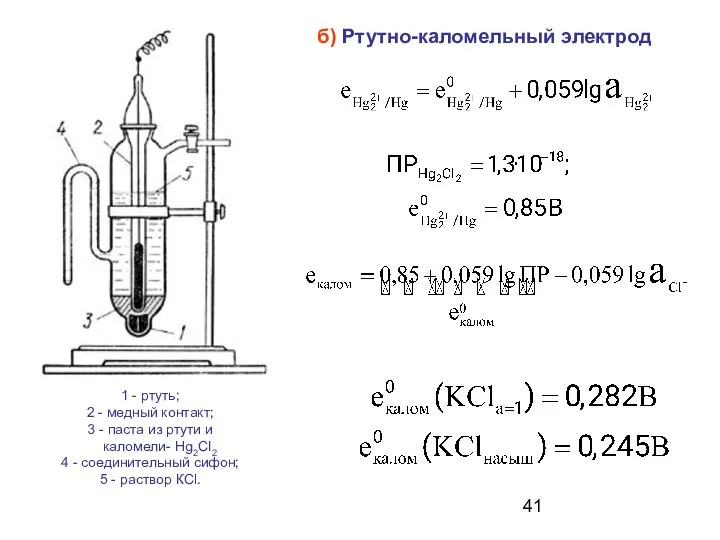
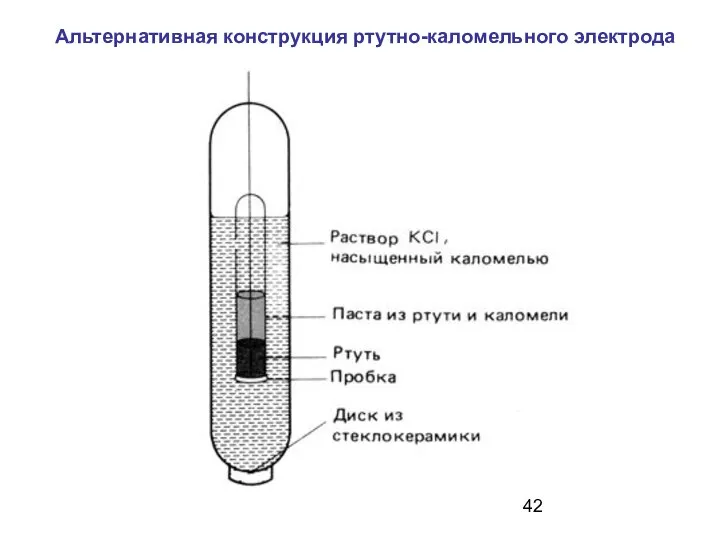
- 41. б) Ртутно-каломельный электрод 1 - ртуть; 2 - медный контакт; 3 - паста из ртути и
- 42. Альтернативная конструкция ртутно-каломельного электрода
- 43. в) Водородный электрод При аН+=1 (рН=0) также является электродом сравнения!!! Потенциал его для всех температур принят
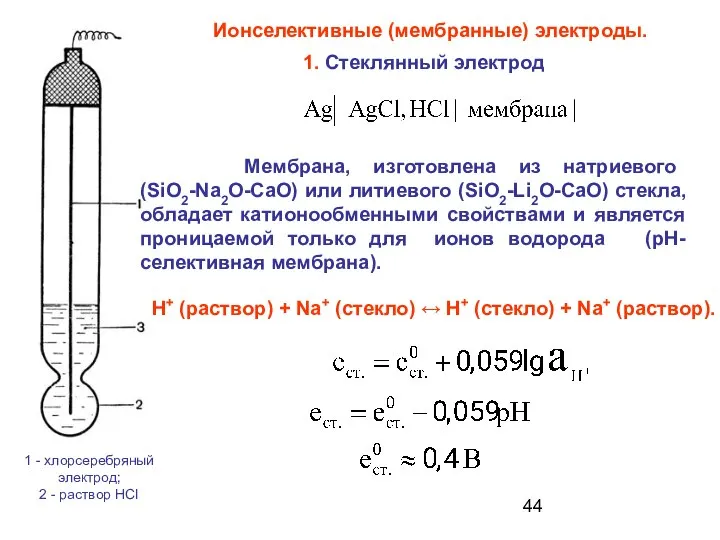
- 44. Ионселективные (мембранные) электроды. 1 - хлорсеребряный электрод; 2 - раствор HCI 1. Стеклянный электрод Н+ (раствор)
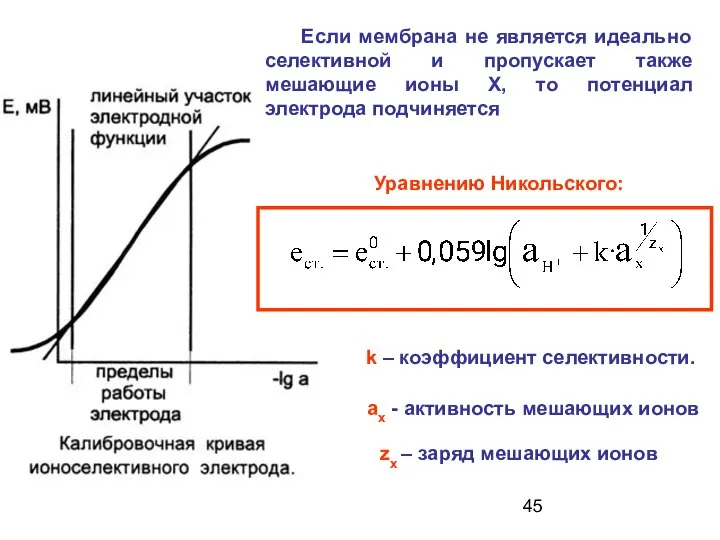
- 45. Если мембрана не является идеально селективной и пропускает также мешающие ионы Х, то потенциал электрода подчиняется
- 46. Советский физико-химик и радиохимик, академик. Окончил Ленинградский университет в 1925 году. НИКОЛЬСКИЙ Борис Петрович (14.10.1900 –
- 47. С 1925 года работал в ЛГУ, одновременно с 1946 – в Радиевом институте. Предложил (1932–1937) ионообменную
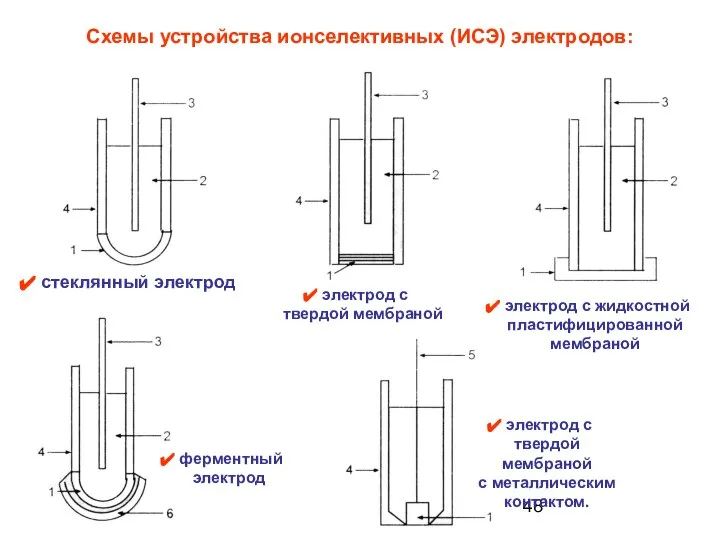
- 48. Схемы устройства ионселективных (ИСЭ) электродов: электрод с твердой мембраной с металлическим контактом. стеклянный электрод электрод с
- 49. Обладают селективностью к катионам Cu2+, Mg2+, Mn2+, NH4+, анионам NO3–, СО32–, SO42-. Наиболее важными для решения
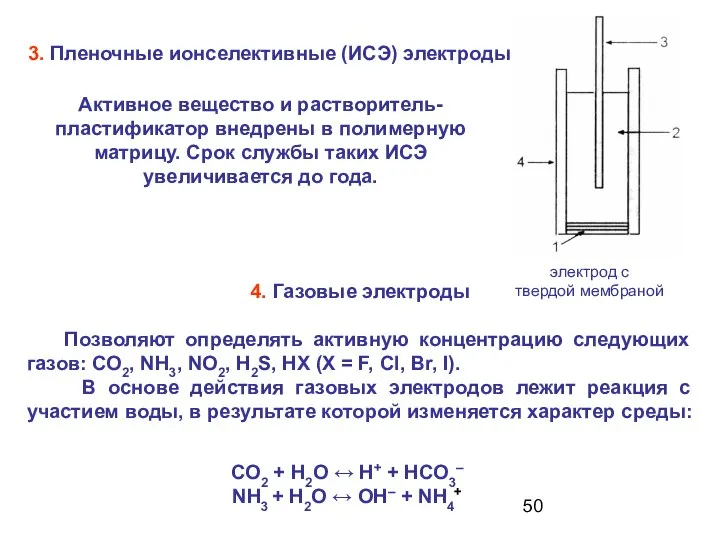
- 50. 3. Пленочные ионселективные (ИСЭ) электроды 4. Газовые электроды Позволяют определять активную концентрацию следующих газов: СО2, NH3,
- 51. Созданы на основе иммобилизованных ферментов включенных в мембрану. Потенциал их зависит от концентрации продуктов распада. Используются
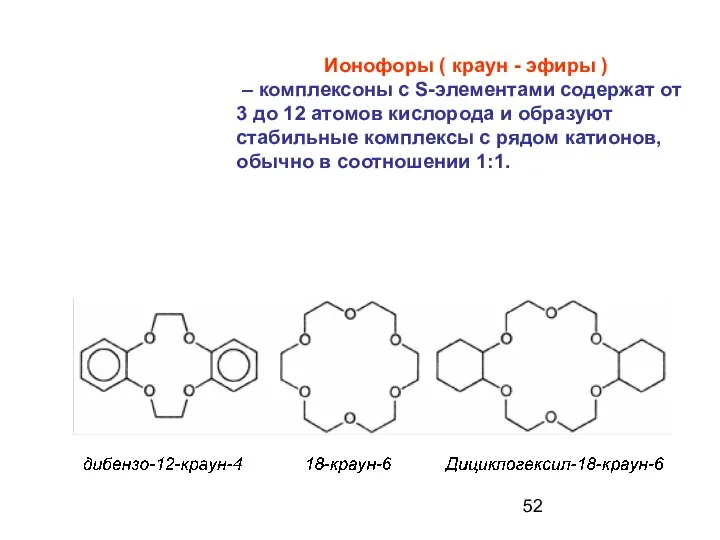
- 52. Ионофоры ( краун - эфиры ) – комплексоны с S-элементами содержат от 3 до 12 атомов
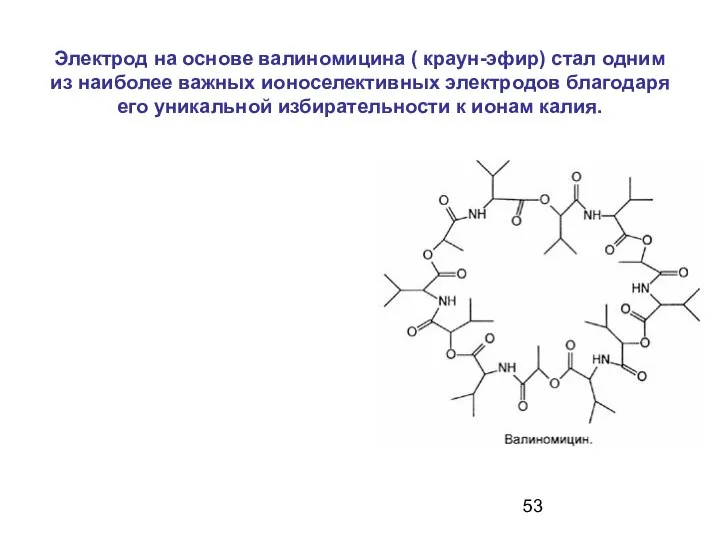
- 53. Электрод на основе валиномицина ( краун-эфир) стал одним из наиболее важных ионоселективных электродов благодаря его уникальной
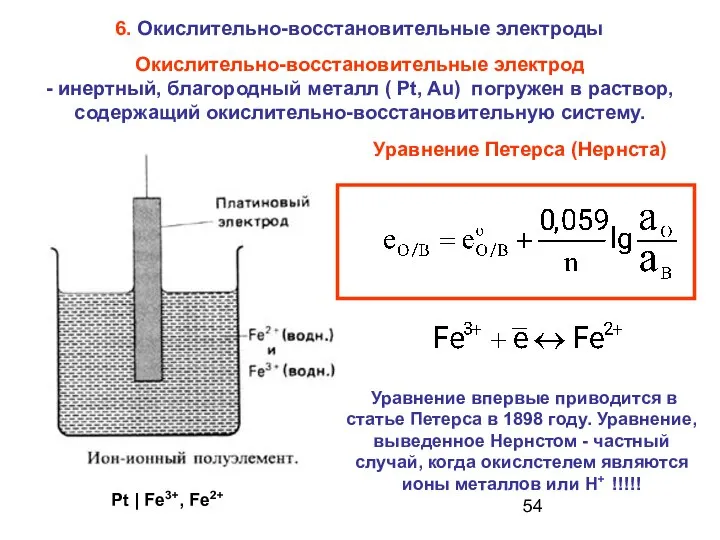
- 54. Окислительно-восстановительные электрод - инертный, благородный металл ( Pt, Au) погружен в раствор, содержащий окислительно-восстановительную систему. Уравнение
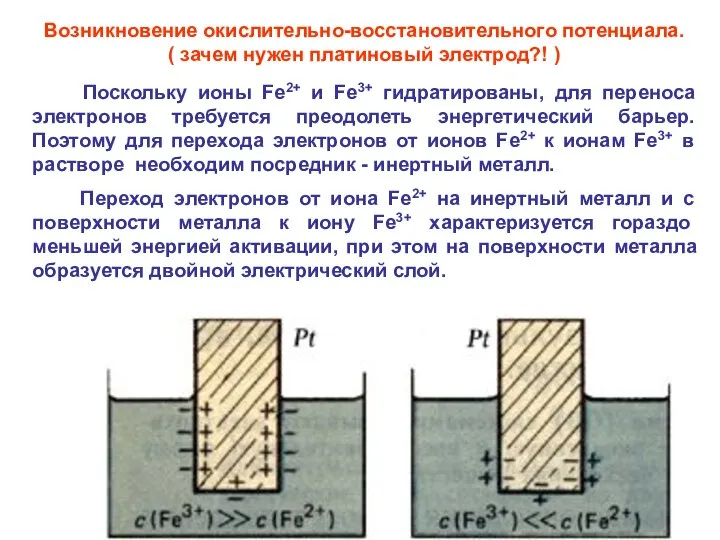
- 55. Возникновение окислительно-восстановительного потенциала. ( зачем нужен платиновый электрод?! ) Поскольку ионы Fe2+ и Fe3+ гидратированы, для
- 56. Если в окислительно-восстановительное уравнение входят ионы водорода, то потенциал данной системы зависит также от рН раствора:
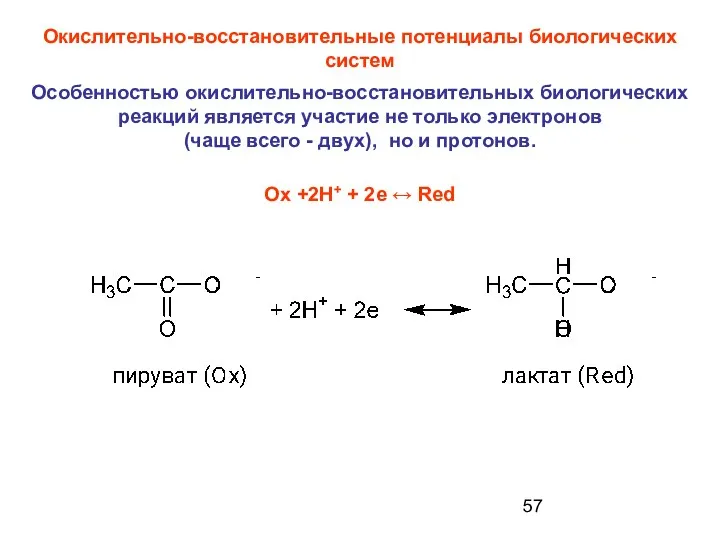
- 57. Окислительно-восстановительные потенциалы биологических систем Особенностью окислительно-восстановительных биологических реакций является участие не только электронов (чаще всего -
- 58. Так как большинство физиологических жидкостей имеют значение рН, близкое к 7, для биологических систем вводится нормальный
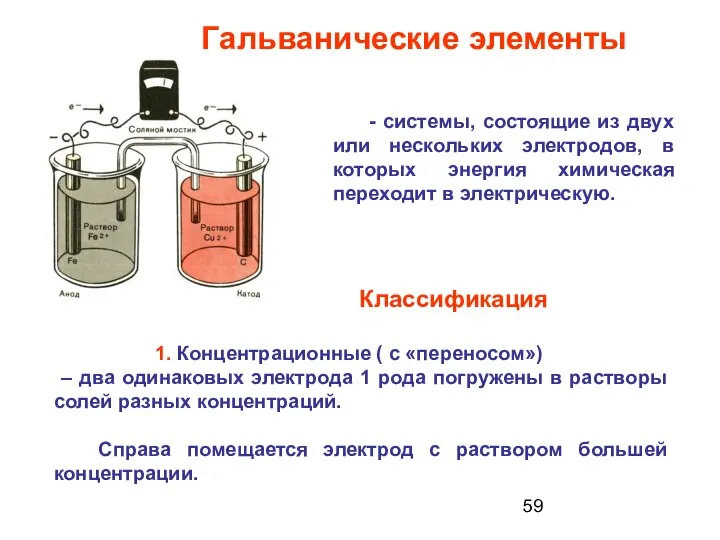
- 59. - системы, состоящие из двух или нескольких электродов, в которых энергия химическая переходит в электрическую. 1.
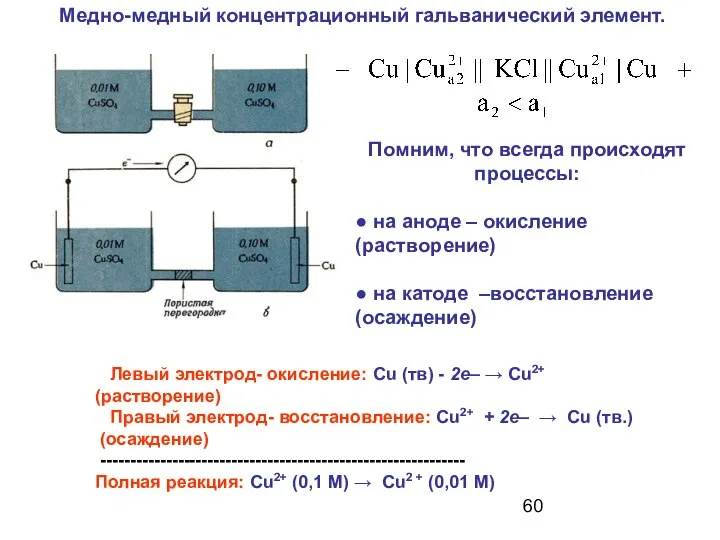
- 60. Медно-медный концентрационный гальванический элемент. Левый электрод- окисление: Сu (тв) - 2е– → Сu2+ (растворение) Правый электрод-
- 61. Расчет ЭДС для концентрационных гальванических элементов Е= е1 - е2 Ток в цепи прекращается, когда концентрации
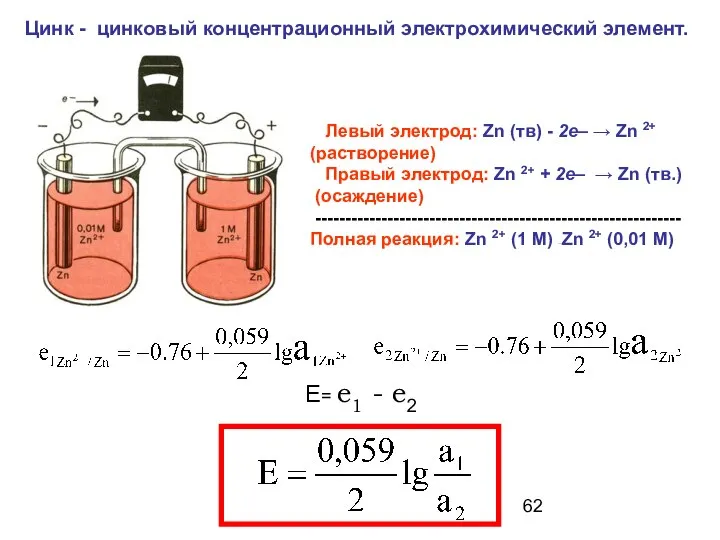
- 62. Цинк - цинковый концентрационный электрохимический элемент. Е= е1 - е2 Левый электрод: Zn (тв) - 2е–
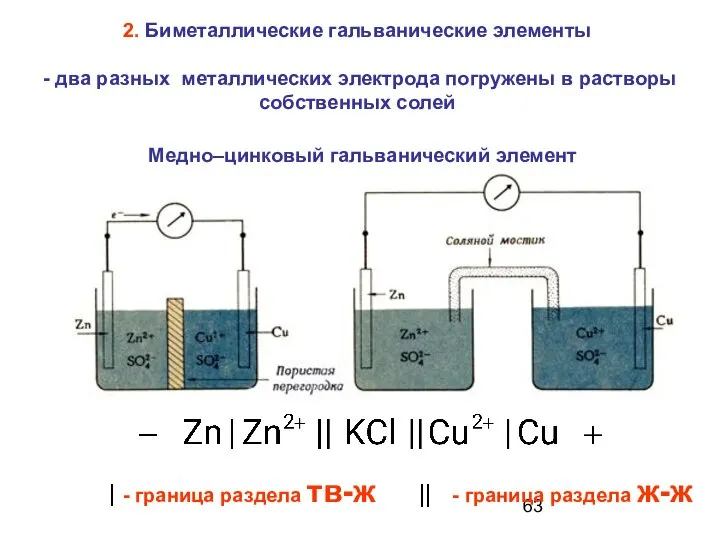
- 63. Медно–цинковый гальванический элемент - граница раздела тв-ж - граница раздела ж-ж 2. Биметаллические гальванические элементы -
- 64. Расчет ЭДС в биметаллических гальванических элементах При разных активностях:
- 65. 3. Гальванические элементы без переноса Правила составления: Справа помещаем электрод с большим е0; Для электрода определения
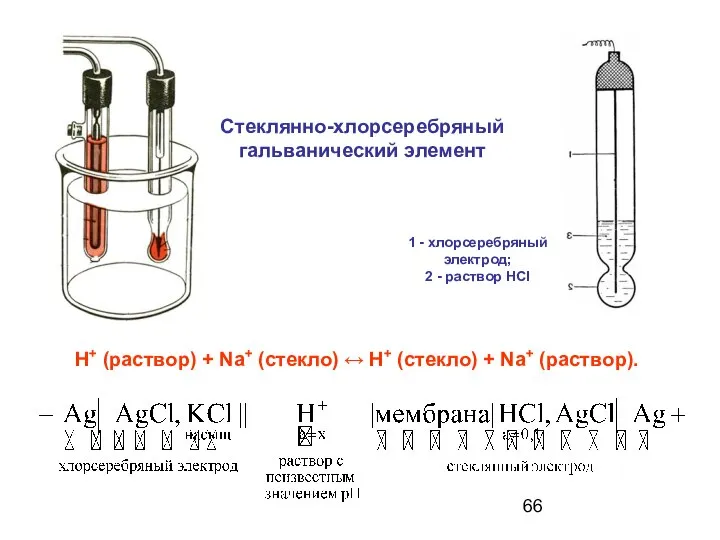
- 66. Стеклянно-хлорсеребряный гальванический элемент Н+ (раствор) + Na+ (стекло) ↔ Н+ (стекло) + Na+ (раствop). 1 -
- 67. Расчет ЭДС для стеклянно-хлорсеребряного гальванического элемента
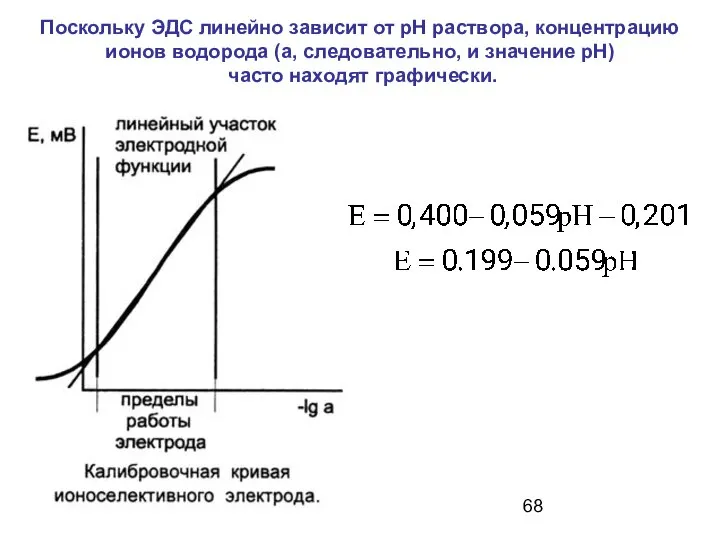
- 68. Поскольку ЭДС линейно зависит от рН раствора, концентрацию ионов водорода (а, следовательно, и значение рН) часто
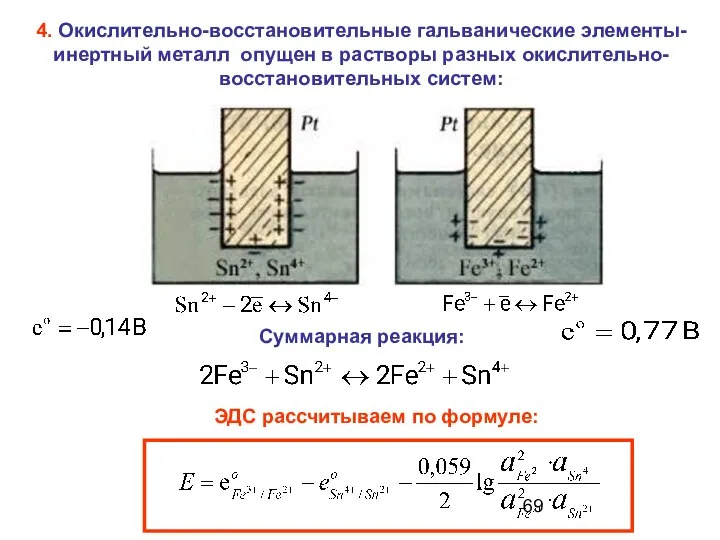
- 69. 4. Окислительно-восстановительные гальванические элементы- инертный металл опущен в растворы разных окислительно-восстановительных систем: Суммарная реакция: ЭДС рассчитываем
- 70. Использование ЭДС в потенциометрическом титровании Потенциометрическое титрование имеет ряд преимуществ перед титрованием с индикатором: возможность титрования
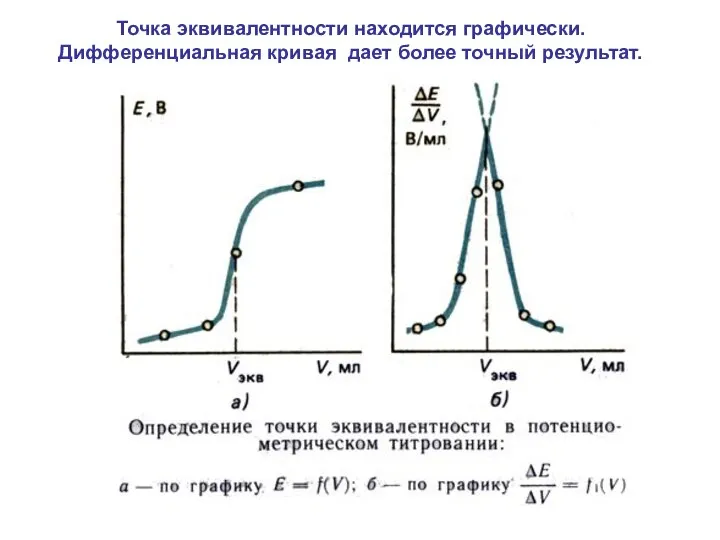
- 71. Точка эквивалентности находится графически. Дифференциальная кривая дает более точный результат.
- 72. рН – метрическое - используются стеклянный и хлорсеребряный электроды
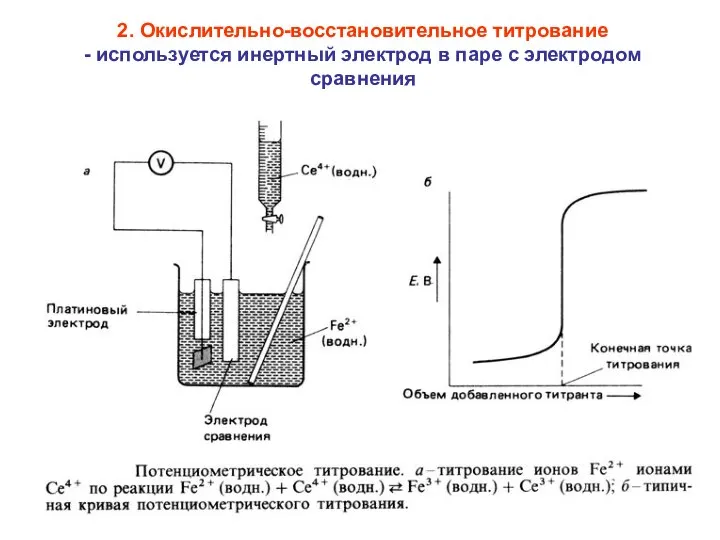
- 73. 2. Окислительно-восстановительное титрование - используется инертный электрод в паре с электродом сравнения
- 75. 1. Прогноз совместимости лекарственных препаратов (иодид калия и нитрит натрия, перманганат калия и тиосульфат натрия –
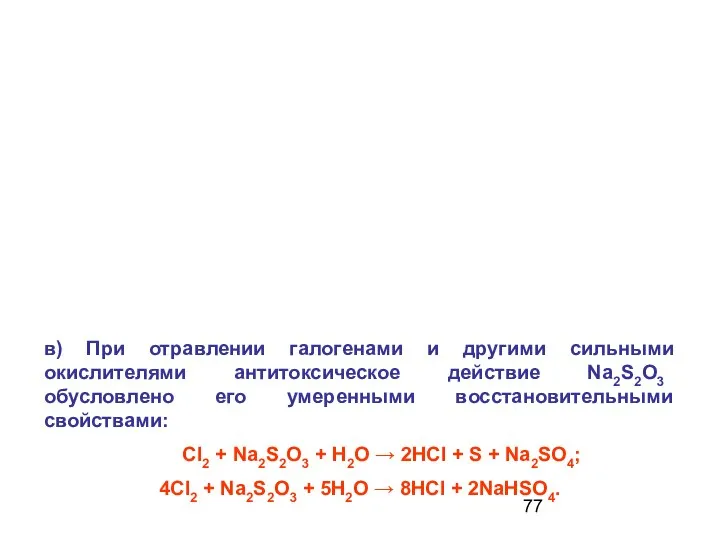
- 76. Тиосульфат натрия Na2S2O3 – универсальный антидот!!! а) При отравлении тяжелыми металлами образуются трудно растворимые и поэтому
- 77. в) При отравлении галогенами и другими сильными окислителями антитоксическое действие Na2S2O3 обусловлено его умеренными восстановительными свойствами:
- 78. 5. Расчет потенциалов в схеме дыхательной цепи В основе процесса дыхания лежит экзэргоническая окислительно-восстановительная реакция О2(г)
- 79. ФАД – флавинадениндинуклеотид НАД – никотинамидадениннуклеотид КоQ – кофермент Q
- 80. Значение ионометрии 1. Контроль водно-электролитного баланса и кислотно-щелочного состояния организма и его отдельных органов
- 81. 2. Определение состава лекарственных препаратов, ферментов, физиологических растворов, продуктов питания, почв, природных вод, атмосферы.
- 82. 3. Определение кислотности желудочного сока путем введения в желудок больного капсулы с двумя миниатюрными электродами-стеклянного и
- 83. 4. Непрерывный контроль кислотности во время хирургических операций.
- 84. 5. Диагностика ряда кожных заболеваний
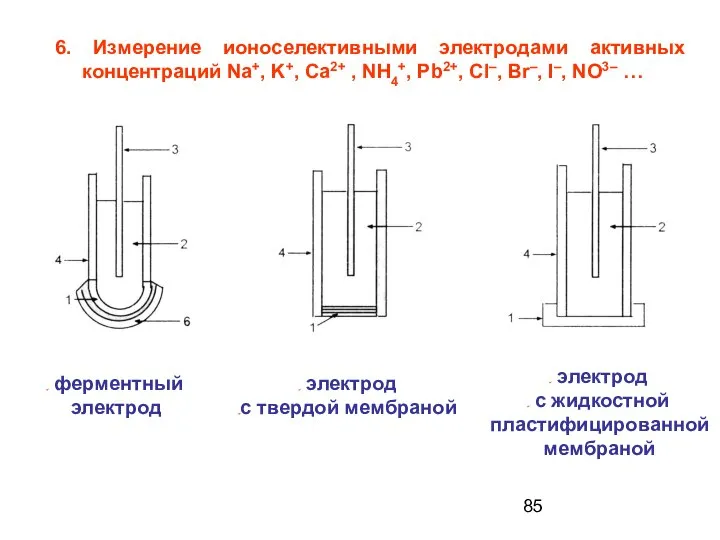
- 85. 6. Измерение ионоселективными электродами активных концентраций Na+, K+, Ca2+ , NH4+, Pb2+, Сl–, Br–, I–, NO3–
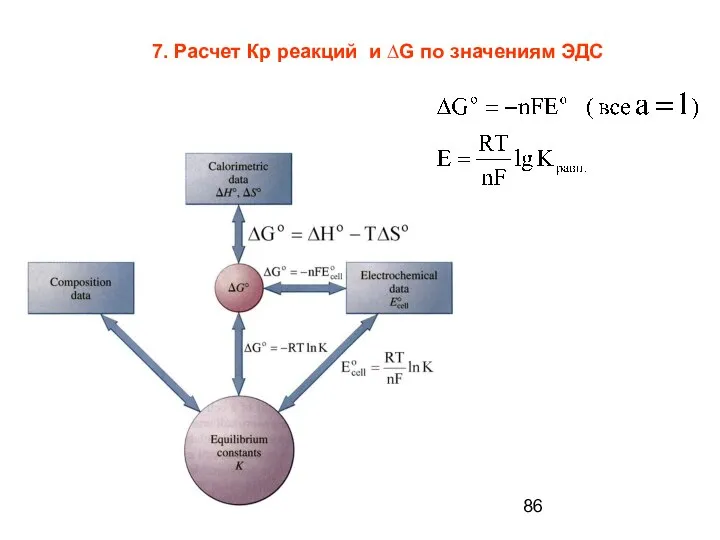
- 86. 7. Расчет Кр реакций и ∆G по значениям ЭДС
- 87. Оптимальные диапазоны рН для выращивания : Картофель - 4.8–5.7 Рожь - 5.0-6.0 Репа - 5.8-6.8 Ячмень
- 89. Скачать презентацию




































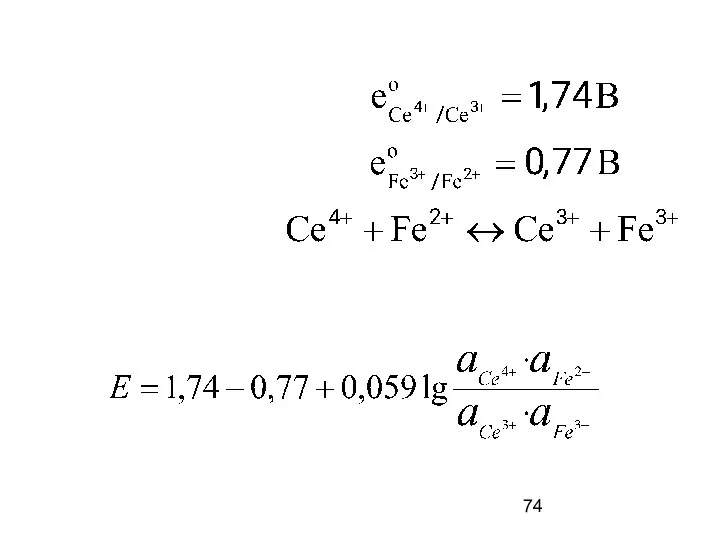










 Катализаторы. Ферменты
Катализаторы. Ферменты Амфотерні гідроксиди
Амфотерні гідроксиди Роль природы сорбционных центров при необменном поглощении триптофана ионообменниками различной природы
Роль природы сорбционных центров при необменном поглощении триптофана ионообменниками различной природы Металічні елементи
Металічні елементи 11-Step total synthesis of pallambins C and D
11-Step total synthesis of pallambins C and D Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна
Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна  Строение белков
Строение белков Серебро. Химические свойства
Серебро. Химические свойства История открытия натурального каучука
История открытия натурального каучука Пластмаса
Пластмаса  Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно
Презентация по Химии "Отруєння медикаментами" - скачать смотреть бесплатно Особенности коррозии в морской воде
Особенности коррозии в морской воде ВСЕ О САХАРНОМ ДИАБЕТЕ!
ВСЕ О САХАРНОМ ДИАБЕТЕ!  Биотехнология туралы түсінік
Биотехнология туралы түсінік № 14.
№ 14.  Презентация по Химии "Биополимеры" - скачать смотреть бесплатно
Презентация по Химии "Биополимеры" - скачать смотреть бесплатно Магний
Магний Периодический закон и периодическая система Д.И. Менделеева (Лекция 2)
Периодический закон и периодическая система Д.И. Менделеева (Лекция 2) Основні класи неорганічних сполук
Основні класи неорганічних сполук Гидролиз
Гидролиз Викторина по химии
Викторина по химии Алкогольді мастықты талдаудың физико-химиялық әдістері
Алкогольді мастықты талдаудың физико-химиялық әдістері Презентация по Химии "Классификация и применение сталей" - скачать смотреть
Презентация по Химии "Классификация и применение сталей" - скачать смотреть  Химическая связь
Химическая связь Презентация по Химии "Комплексные соединения.Свойства комплексных соединений." - скачать смотреть бесплатно
Презентация по Химии "Комплексные соединения.Свойства комплексных соединений." - скачать смотреть бесплатно Коррозия металлов
Коррозия металлов Качественные реакции. Анионы
Качественные реакции. Анионы Метаморфические горные породы
Метаморфические горные породы