Содержание
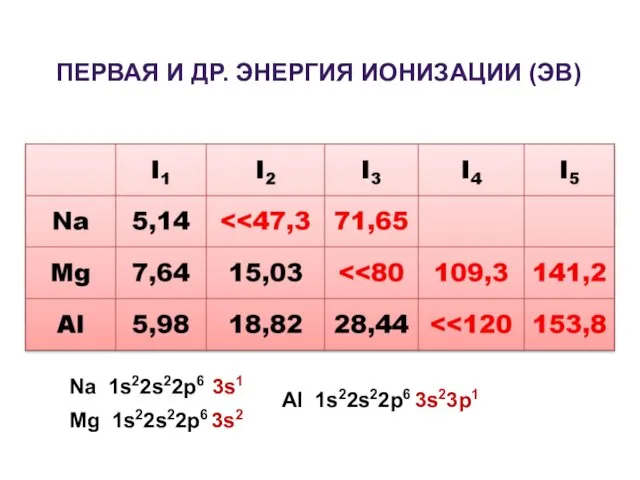
- 2. ПЕРВАЯ И ДР. ЭНЕРГИЯ ИОНИЗАЦИИ (ЭВ) Na 1s22s22p6 3s1 Mg 1s22s22p6 3s2 Al 1s22s22p6 3s23p1
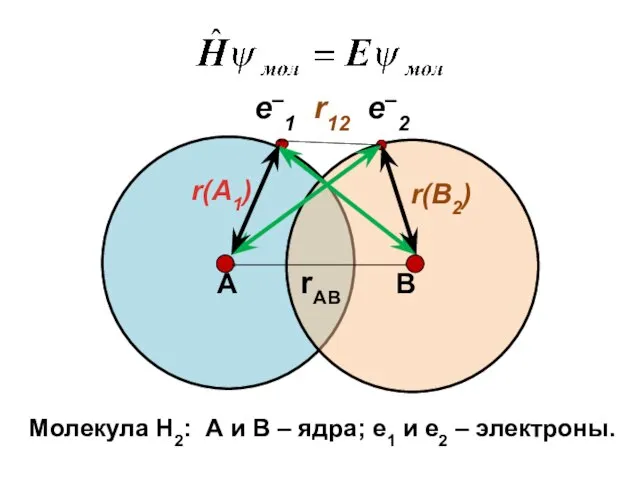
- 3. e–1 r12 e–2 А rАВ В Молекула Н2: А и В – ядра; е1 и е2
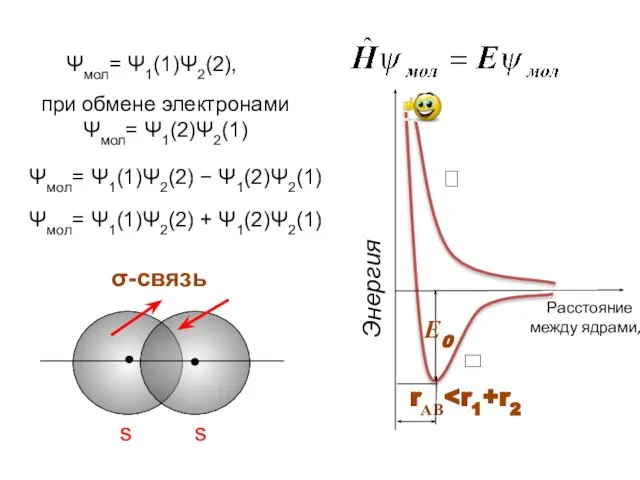
- 4. ⮀ ⮅ Ψмол= Ψ1(1)Ψ2(2), при обмене электронами Ψмол= Ψ1(2)Ψ2(1) Ψмол= Ψ1(1)Ψ2(2) − Ψ1(2)Ψ2(1) Ψмол= Ψ1(1)Ψ2(2) +
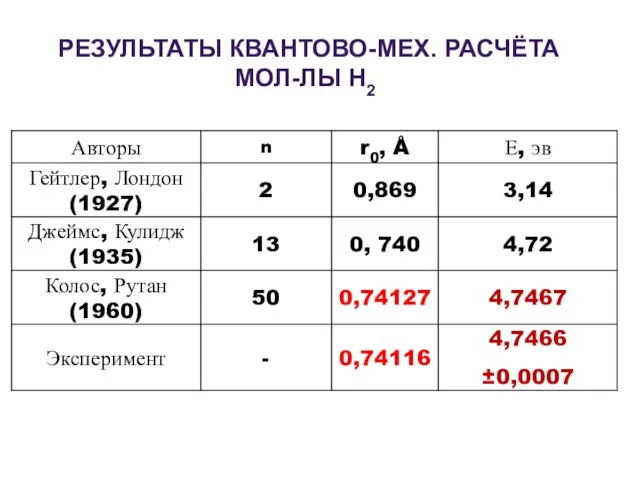
- 5. РЕЗУЛЬТАТЫ КВАНТОВО-МЕХ. РАСЧЁТА МОЛ-ЛЫ Н2
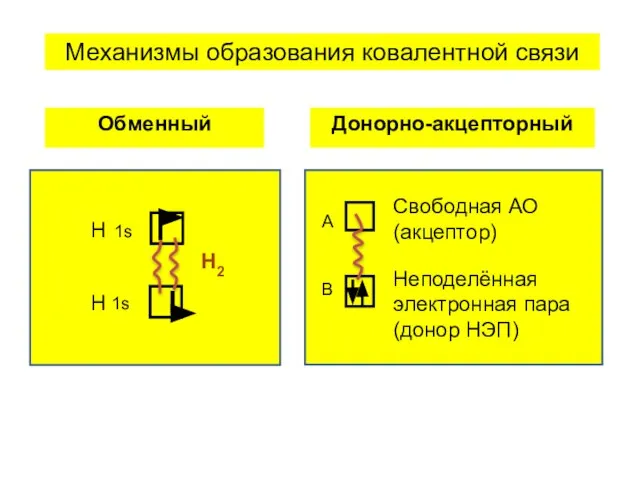
- 6. Свойства ковалентной связи а) насыщаемость б) направленность в) поляризуемость Типы ковалентной связи сигма σ пи π
- 7. Н Н Н2 1s 1s Обменный А В Свободная АО (акцептор) Неподелённая электронная пара (донор НЭП)
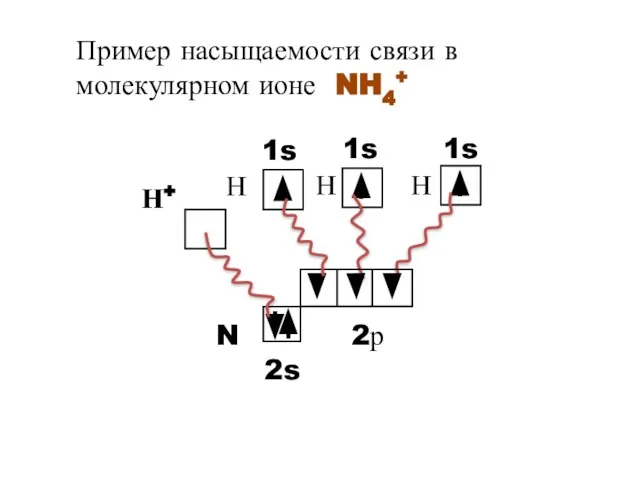
- 8. Пример насыщаемости связи в молекулярном ионе NH4+
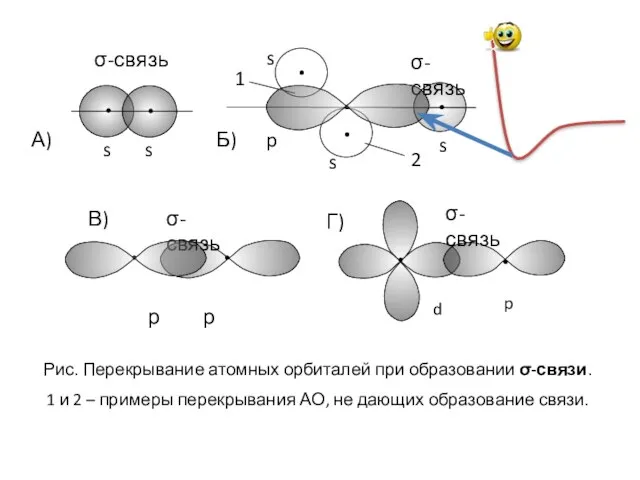
- 9. s s σ-связь s s s p σ-связь 1 2 А) Б) Рис. Перекрывание атомных орбиталей
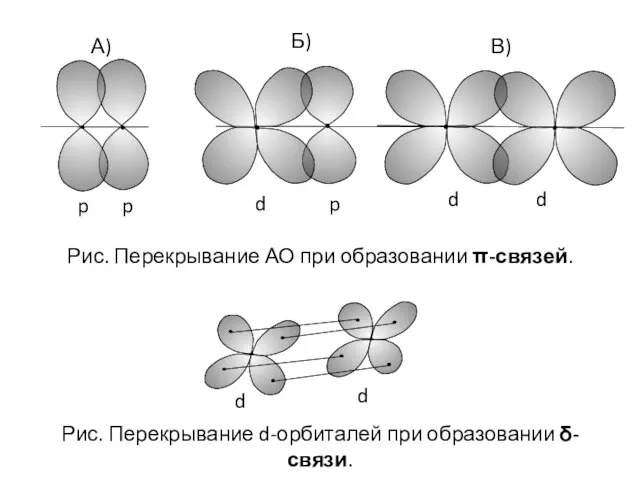
- 10. А) Б) d p p p d d В) Рис. Перекрывание АО при образовании π-связей. d
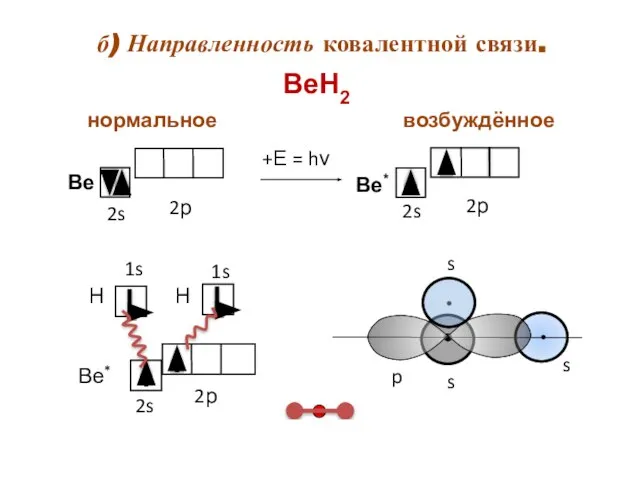
- 11. б) Направленность ковалентной связи. s ВеН2 возбуждённое нормальное
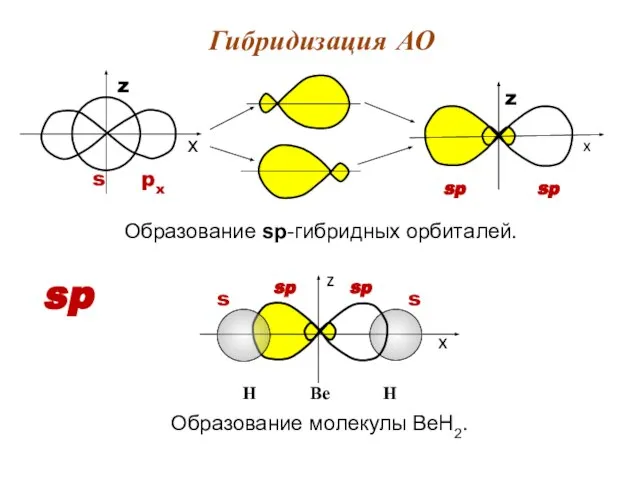
- 12. Образование sp-гибридных орбиталей. Гибридизация АО sp
- 13. Условия гибридизации АО. АО должны быть обязательно разного типа (s, p, и/или d), причём участие s-орбиталей
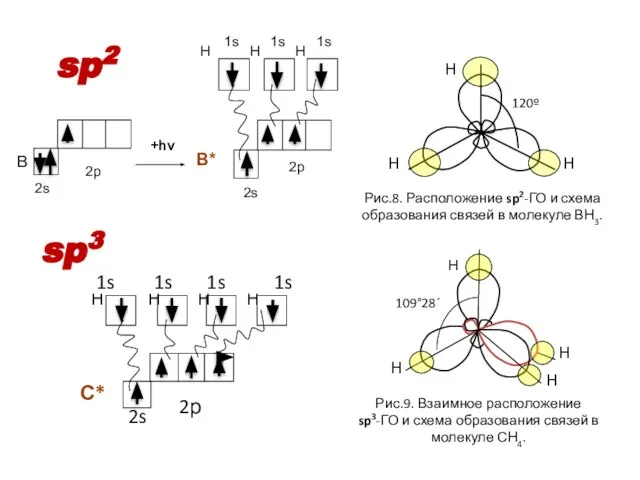
- 14. sp2 sp3
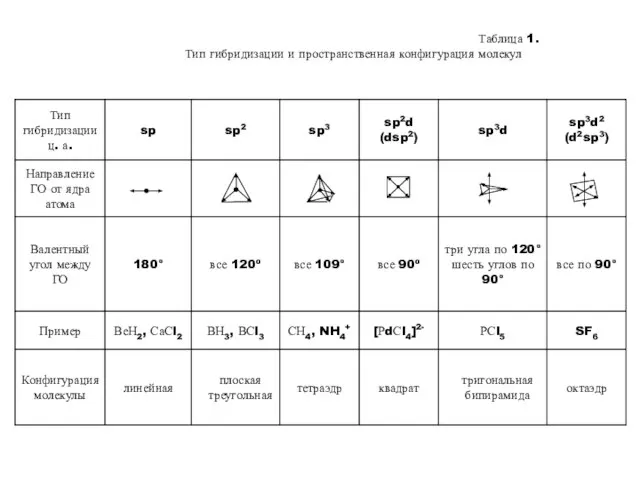
- 15. Таблица 1. Тип гибридизации и пространственная конфигурация молекул
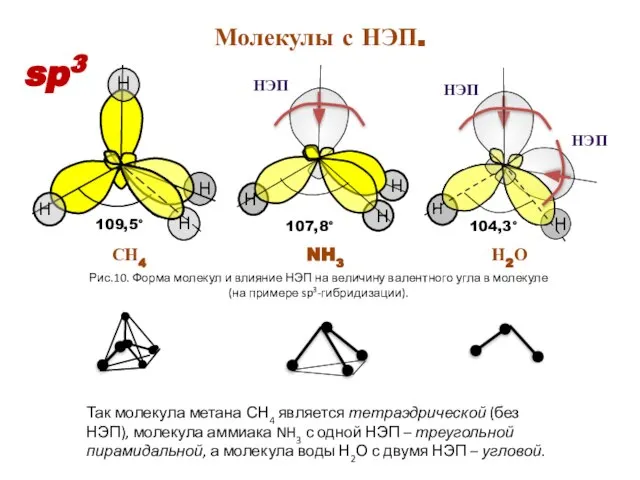
- 16. 109,5° Рис.10. Форма молекул и влияние НЭП на величину валентного угла в молекуле (на примере sp3-гибридизации).
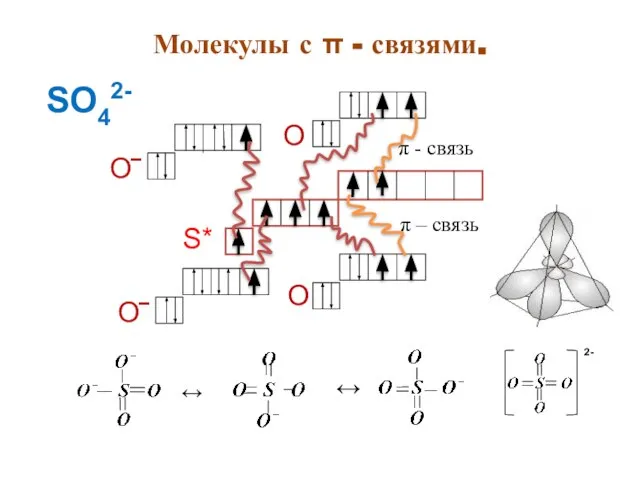
- 17. Молекулы с π - связями. π – связь π - связь О‾ О‾ О О ↔
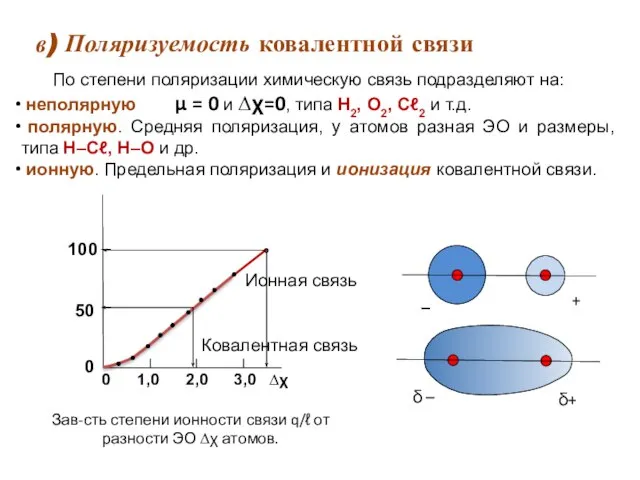
- 18. в) Поляризуемость ковалентной связи Ковалентная связь По степени поляризации химическую связь подразделяют на: неполярную μ =
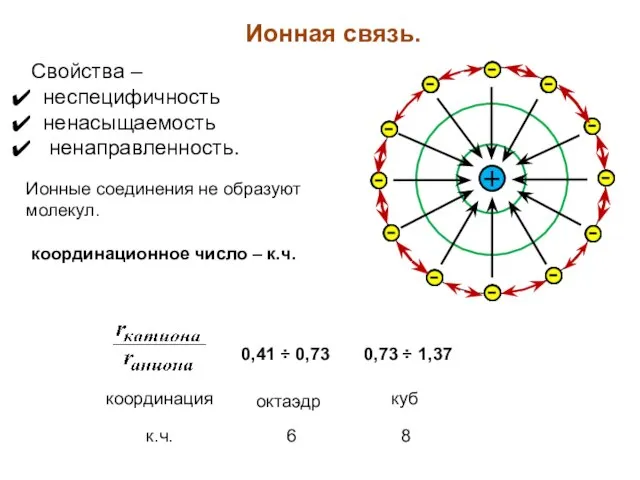
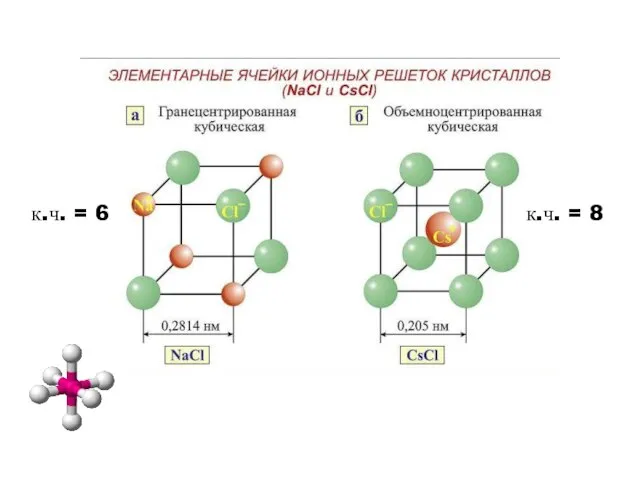
- 19. Ионная связь. Свойства – неспецифичность ненасыщаемость ненаправленность. Ионные соединения не образуют молекул. координационное число – к.ч.
- 20. к.ч. = 6 к.ч. = 8
- 21. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ММО) 1927-29 гг. Ф. Гунд, Р. Малликен, Р. Ленард-Джонс и др. Основные положения
- 22. Имеются различные варианты ММО. Наиболее широкое использование получил метод МО ЛКАО «молекулярная орбиталь – есть линейная
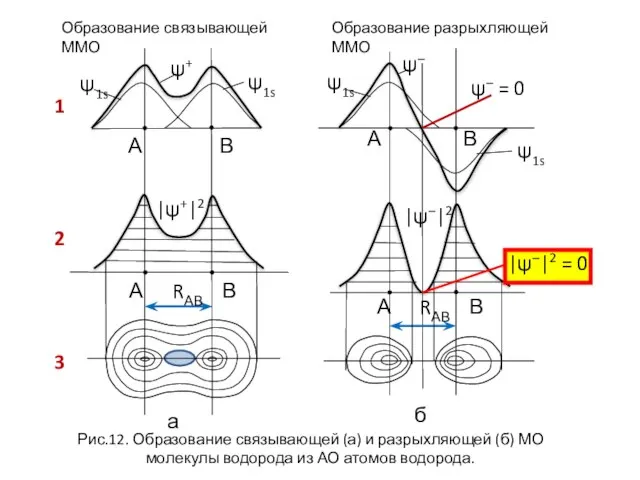
- 23. Образование связывающей ММО Образование разрыхляющей ММО
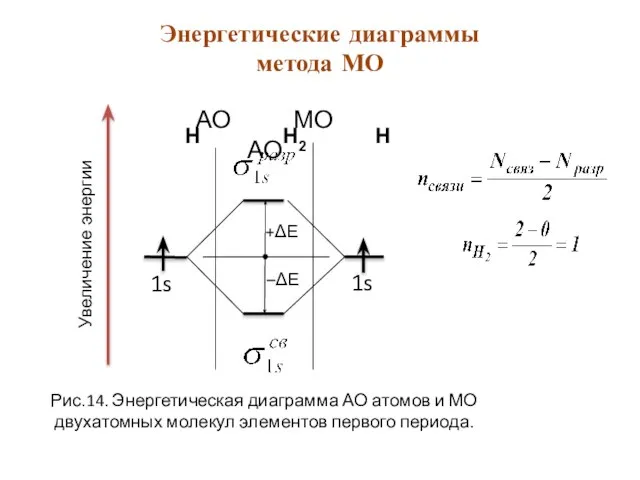
- 25. АО МО АО 1s 1s Увеличение энергии Рис.14. Энергетическая диаграмма АО атомов и МО двухатомных молекул
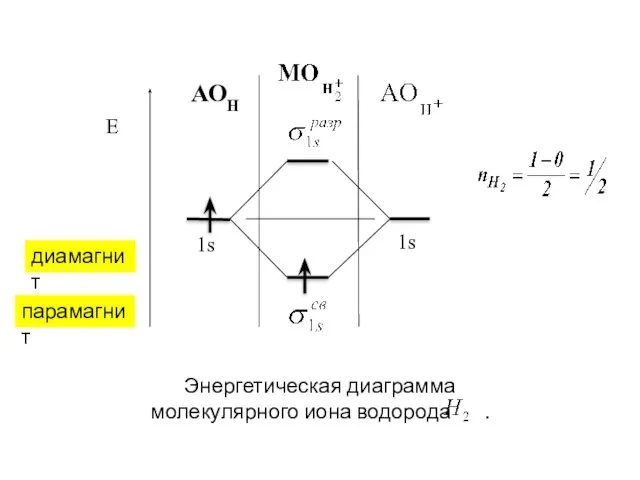
- 26. АОН диамагнит парамагнит
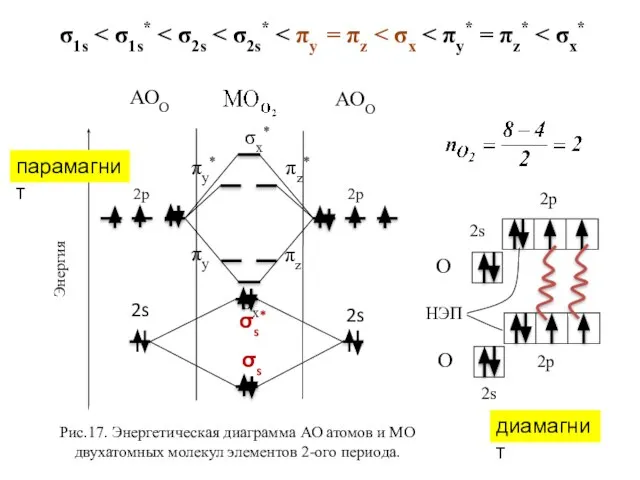
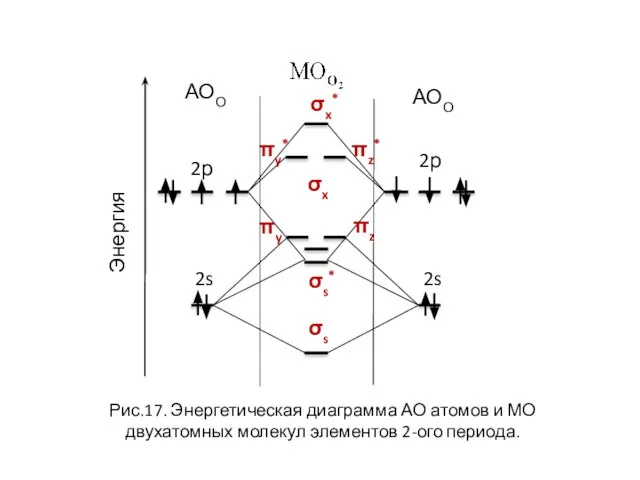
- 27. σx* σx πy πz πy* πz* Рис.17. Энергетическая диаграмма АО атомов и МО двухатомных молекул элементов
- 28. σs σs* σx* σx πy πz πy* πz* 2р 2s АОО Рис.17. Энергетическая диаграмма АО атомов
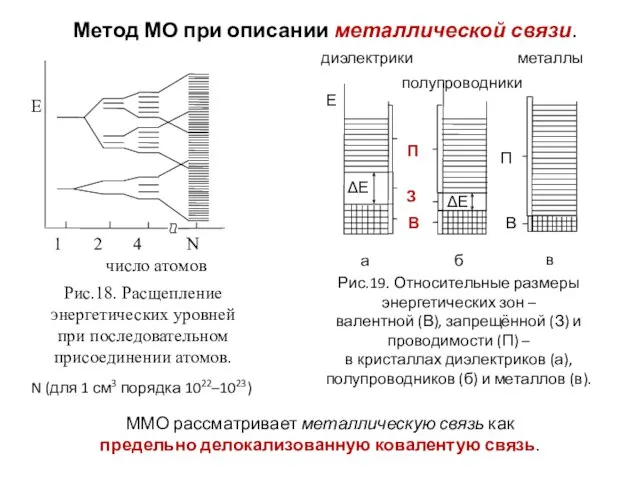
- 29. Метод МО при описании металлической связи. N (для 1 см3 порядка 1022–1023) ММО рассматривает металлическую связь
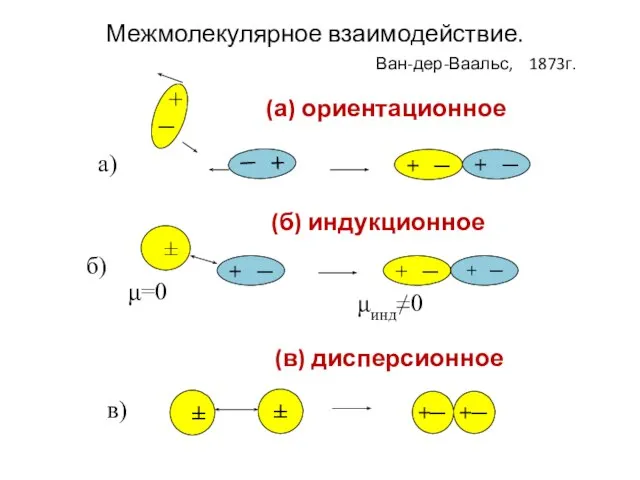
- 31. (а) ориентационное + ─ + ─ + ─ + ─ + ─ + ─ ± +
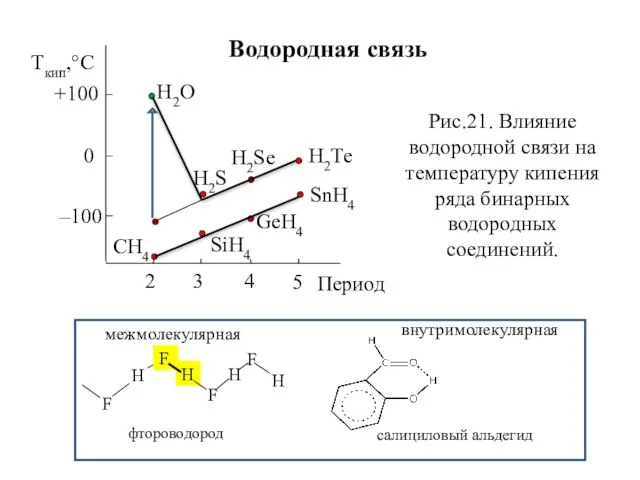
- 32. Водородная связь Н2О Н2Те Н2Sе Н2S СН4 SiН4 GеН4 SnН4 Ткип,°C +100 0 –100 2 3
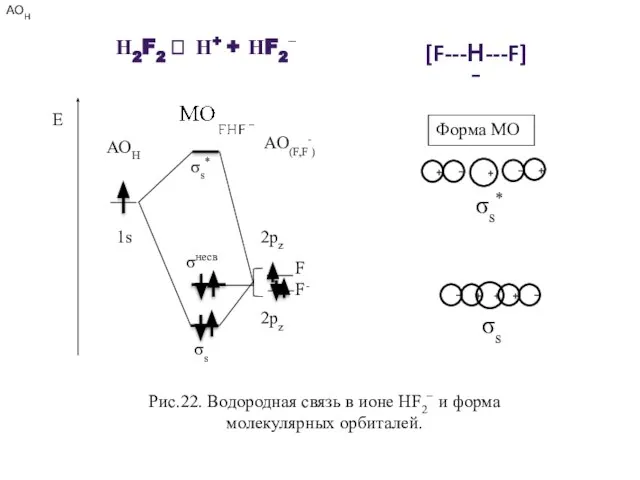
- 33. Рис.22. Водородная связь в ионе НF2− и форма молекулярных орбиталей. + − + + − σs*
- 35. Скачать презентацию






 Каучуки. Природний каучук, гума, синтетичний каучук
Каучуки. Природний каучук, гума, синтетичний каучук Сера и её соединения
Сера и её соединения Оксосоединения: альдегиды и кетоны
Оксосоединения: альдегиды и кетоны Изооктан. Получение. Октановое число и степень сжатия
Изооктан. Получение. Октановое число и степень сжатия Нефть: состав, свойства, месторождения, применение
Нефть: состав, свойства, месторождения, применение Презентация по Химии "Штучні волокна" - скачать смотреть бесплатно
Презентация по Химии "Штучні волокна" - скачать смотреть бесплатно Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Зымыран сұрақтар
Зымыран сұрақтар Свойства солей. Получение солей
Свойства солей. Получение солей «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА» Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Радиоактивность
Радиоактивность Основания. Простые и сложные ионы
Основания. Простые и сложные ионы Современные области применения изотопной продукции
Современные области применения изотопной продукции Хімічнi елементи
Хімічнi елементи Презентация по Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть
Презентация по Химии "строение спиртов, характерные типы химических реакци" - скачать смотреть  Применение эксклюзионной хроматографии в биологии
Применение эксклюзионной хроматографии в биологии Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Водородная связь
Водородная связь Подготовила воспитанница 11 «А» класса Кулишова Валерия
Подготовила воспитанница 11 «А» класса Кулишова Валерия Cложные липиды (липоиды)
Cложные липиды (липоиды) Очистка масляных фракций от смолистых веществ
Очистка масляных фракций от смолистых веществ Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно
Презентация по Химии "Атоми,молекули, йони, хімічні елементи, їхні назви й символи" - скачать смотреть бесплатно Подготовка к контрольной работе Химические реакции
Подготовка к контрольной работе Химические реакции Получение радиоактивных изотопов и их применение.
Получение радиоактивных изотопов и их применение. Амины. Азотсодержащие соединения
Амины. Азотсодержащие соединения Кислотность почвы
Кислотность почвы