Содержание
- 2. Цель: Ознакомиться с понятием гидролиз, его особенностями , методами получения и применения.
- 3. Содержание: -Определение -Особенности -Схема образования -Примеры - Приминение -Тест -Вывод -Литература
- 4. Определение: Гидролиз- один из видов химических реакций, где при взаимодействии веществ с водой происходит разложение исходного
- 5. Особенности Гидролиз органических веществ Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций при участии
- 6. Обратимый и необратимый гидролиз. Все рассмотренные процессы гидролиза органических соединений - обратимы. Но есть и необратимый
- 7. Гидролиз солей Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно,
- 8. Гидролиз солей Различают обратимый и необратимый гидролиз солей: 1. Гидролиз соли слабой кислоты и сильного основания
- 9. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону): (раствор имеет слабокислую среду, реакция протекает
- 10. Гидролиз соли слабой кислоты и слабого основания: (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью,
- 11. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
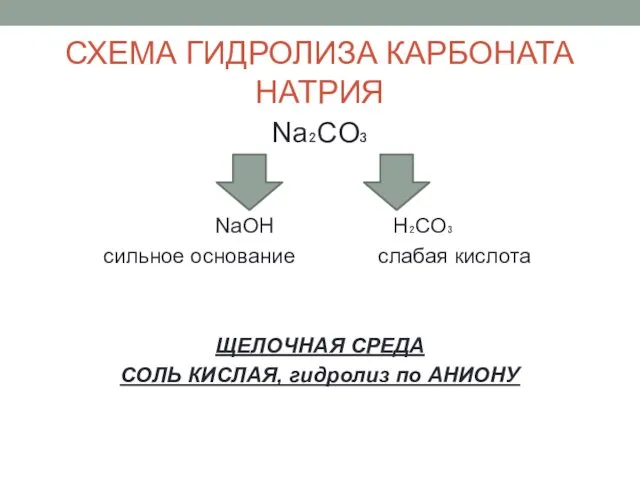
- 12. СХЕМА ГИДРОЛИЗА КАРБОНАТА НАТРИЯ Na₂CO₃ NaOH H₂CO₃ сильное основание слабая кислота ЩЕЛОЧНАЯ СРЕДА СОЛЬ КИСЛАЯ, гидролиз
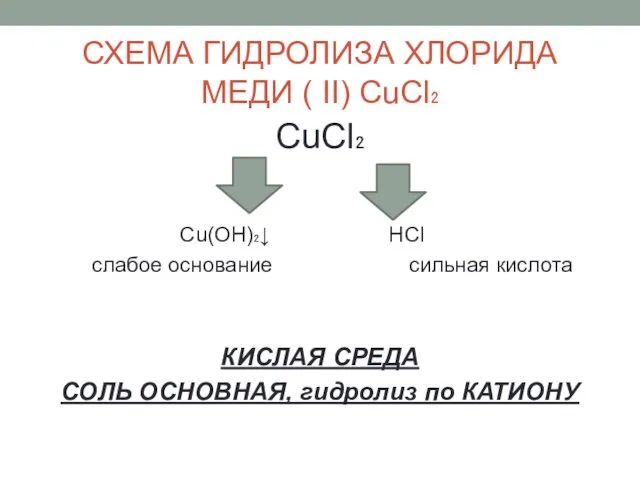
- 13. СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II) CuCl₂ CuCl₂ Cu(OH)₂↓ HCl слабое основание сильная кислота КИСЛАЯ СРЕДА
- 14. СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ Al₂S₃ Al₂S₃ Al(OH)₃↓ H ₂S↑ слабое основание слабая кислота НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ
- 15. Примеры: НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА: Гидридов: CaH2+2H2O=Ca(OH)2+2H2↑ Солей: CH3COONH4+H2 CH3COOH+NH4OH ОРГАНИЧЕСКИЕ ВЕЩЕСТВА: Сложные эфиры: CH3COOCH3+H2 CH3COOH+CH3OH Углеводов: (C6H10O5)n+nH2
- 16. Применение: Применение: 1.Основной компонент мыла – это натриевые или калиевые соли высших жирных кислот: стеараты, пальмитаты,
- 17. Практическая часть (1)Гидролиз солей-это взаимодействие с водой: а)Катионов или анионов любой( по растворимости ) соли б)Катионов
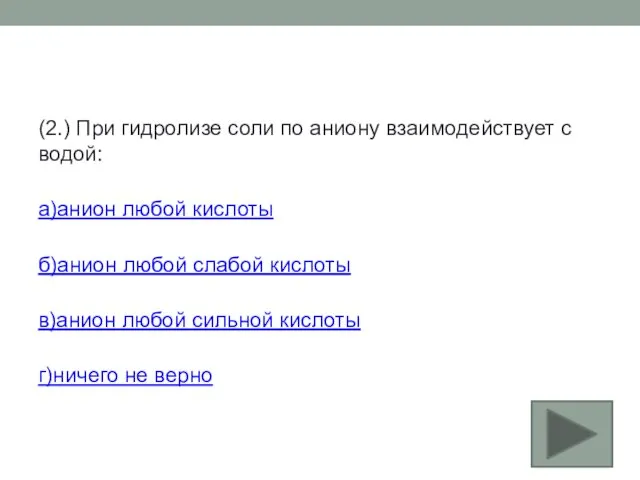
- 20. (2.) При гидролизе соли по аниону взаимодействует с водой: а)анион любой кислоты б)анион любой слабой кислоты
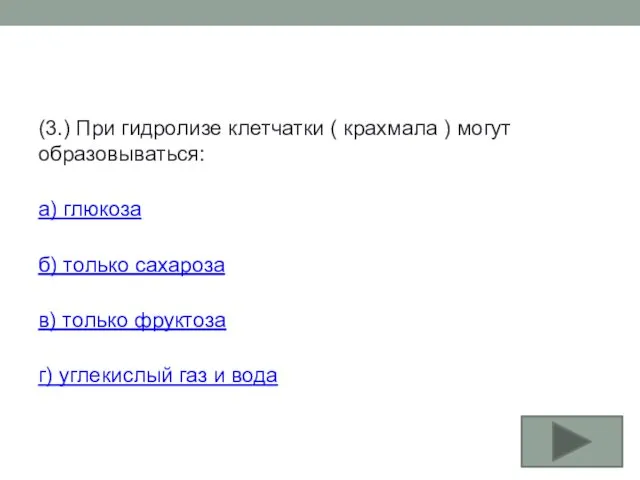
- 23. (3.) При гидролизе клетчатки ( крахмала ) могут образовываться: а) глюкоза б) только сахароза в) только
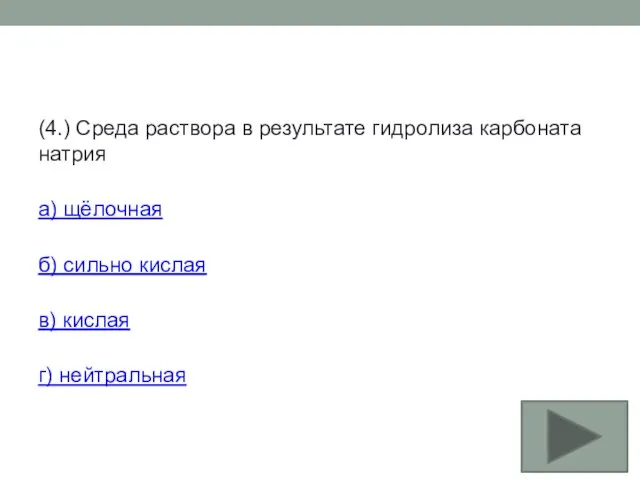
- 26. (4.) Среда раствора в результате гидролиза карбоната натрия а) щёлочная б) сильно кислая в) кислая г)
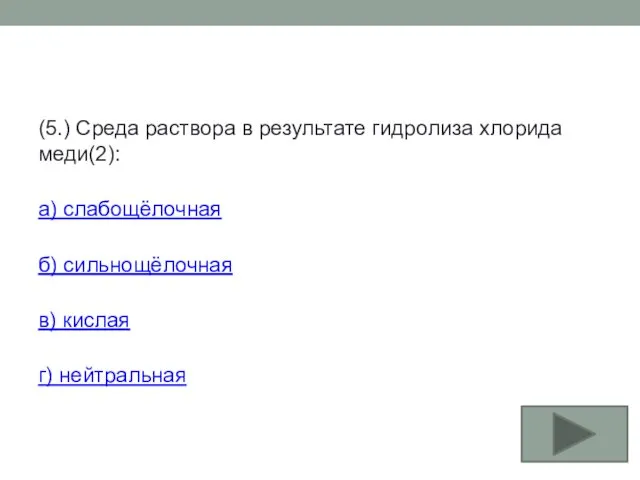
- 29. (5.) Среда раствора в результате гидролиза хлорида меди(2): а) слабощёлочная б) сильнощёлочная в) кислая г) нейтральная
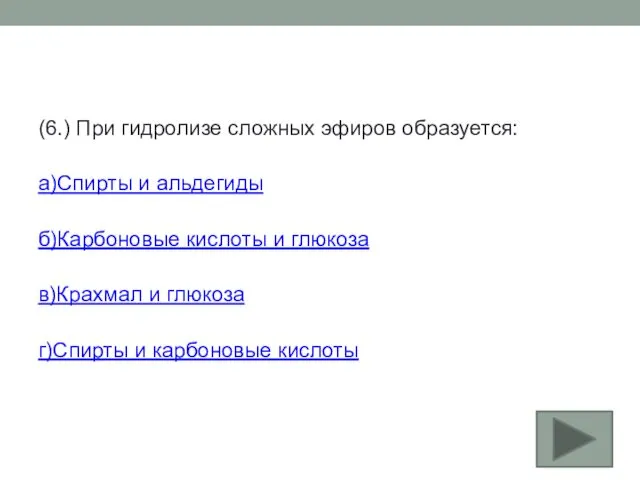
- 32. (6.) При гидролизе сложных эфиров образуется: а)Спирты и альдегиды б)Карбоновые кислоты и глюкоза в)Крахмал и глюкоза
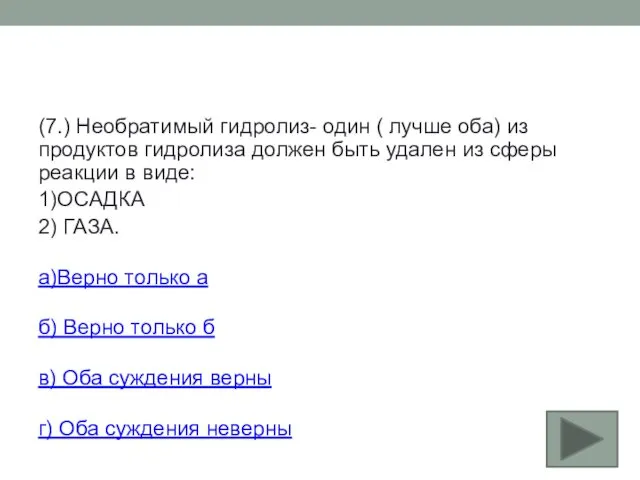
- 35. (7.) Необратимый гидролиз- один ( лучше оба) из продуктов гидролиза должен быть удален из сферы реакции
- 39. Скачать презентацию




























 Углеводы. Строение и функции
Углеводы. Строение и функции The Krebs cycle
The Krebs cycle Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде
Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде История мыловарения
История мыловарения Физические величины и единицы измерения, применяемые в химии
Физические величины и единицы измерения, применяемые в химии Пищевые добавки в продуктах питания
Пищевые добавки в продуктах питания Углеводы. Характерные получения и химические свойства углеводородов
Углеводы. Характерные получения и химические свойства углеводородов Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов
Особенности строения, реакционной способности и методы синтеза галогенпроизводных углеводородов Углерод. 9 класс
Углерод. 9 класс Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Презентация по Химии "Химическая посуда" - скачать смотреть бесплатно
Презентация по Химии "Химическая посуда" - скачать смотреть бесплатно Свойства неметаллов и их соединений. Практическая работа №4
Свойства неметаллов и их соединений. Практическая работа №4 Биохимические аспекты рационального питания
Биохимические аспекты рационального питания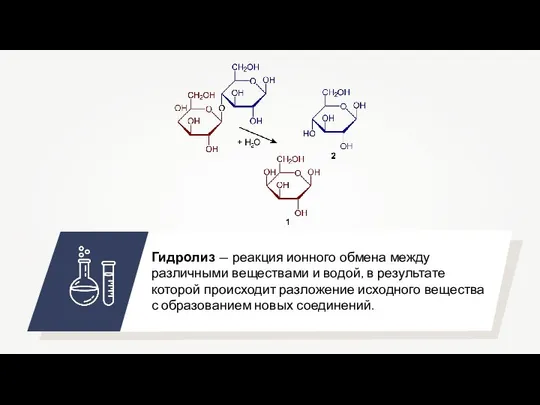 Гидролиз. Реакции гидролиза
Гидролиз. Реакции гидролиза Исследование зон коагуляции и стабилизации золей электролитами. Работа 6
Исследование зон коагуляции и стабилизации золей электролитами. Работа 6 Окислительно-восстановительные реакции. Химическое равновесие
Окислительно-восстановительные реакции. Химическое равновесие Дисперсные системы. Гели
Дисперсные системы. Гели Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Многоатомные спирты.10 класс
Многоатомные спирты.10 класс Уравнения химических реакций
Уравнения химических реакций Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь»
Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь» Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Хлор. Способы получения хлора
Хлор. Способы получения хлора Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Общая характеристика неметаллов
Общая характеристика неметаллов Значення хімії в повсякденному житті
Значення хімії в повсякденному житті  «Строение атома и периодическая система» Химический диктант в 8 классе
«Строение атома и периодическая система» Химический диктант в 8 классе