Содержание
- 2. План лекции Процессы на границе металл / вода, металл / раствор Электродный потенциал Уравнение Нернста Водородный
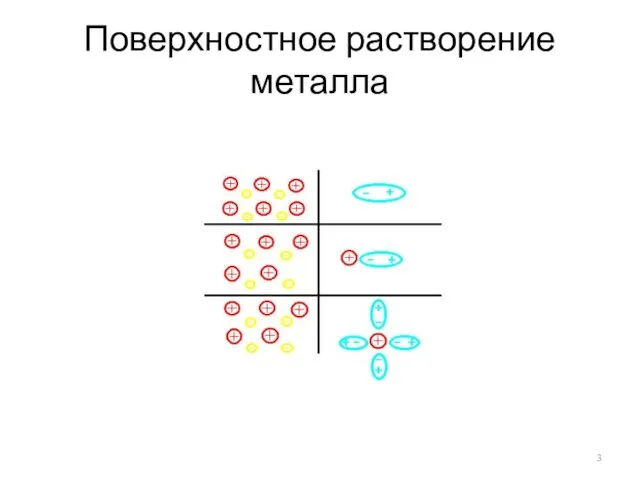
- 3. Поверхностное растворение металла
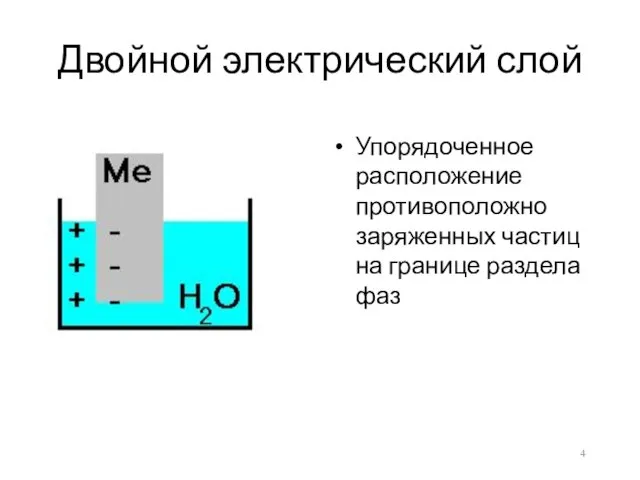
- 4. Двойной электрический слой Упорядоченное расположение противоположно заряженных частиц на границе раздела фаз
- 5. Устанавливается подвижное равновесие (скорость растворения = скорости осаждения) Образовавшаяся пограничная разность потенциалов получила название электродного потенциала
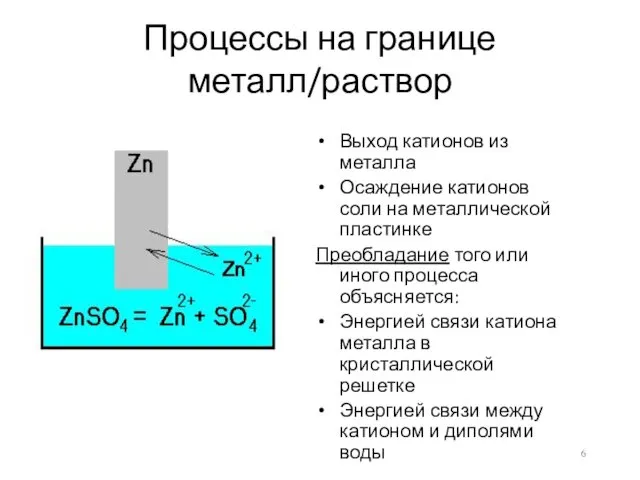
- 6. Процессы на границе металл/раствор Выход катионов из металла Осаждение катионов соли на металлической пластинке Преобладание того
- 7. Химически активные металлы (Zn, Mg, Al, Fe) характеризуются большими величинами растворимости. При любых больших концентрациях их
- 8. Уравнение Нернста 2,3RT 2,3RT E = ----------- ⋅ lgK + ---------- ⋅ lg a nF nF
- 9. Стандартный электродный потенциал (Е°) Потенциал, возникающий на границе металл / раствор при активности катионов металла в
- 10. Ряд напряжений Расположение металлов в порядке возрастания их стандартных электродных потенциалов
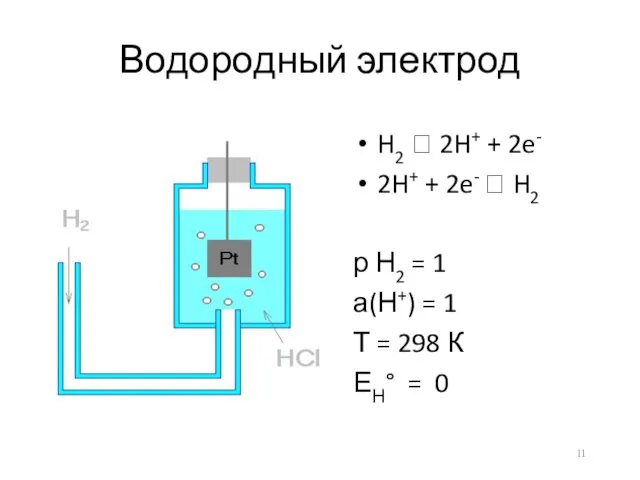
- 11. Водородный электрод H2 ⮀ 2H+ + 2e- 2H+ + 2e- ⮀ H2 р Н2 = 1
- 12. Недостатки стандартного водородного электрода Трудно изготавливать, сохранять и поддерживать в рабочем состоянии Водород должен быть химически
- 13. Названия электродов Анод – электрод, на котором протекает реакция окисления, т.е. отдача электронов; активный металл, заряд
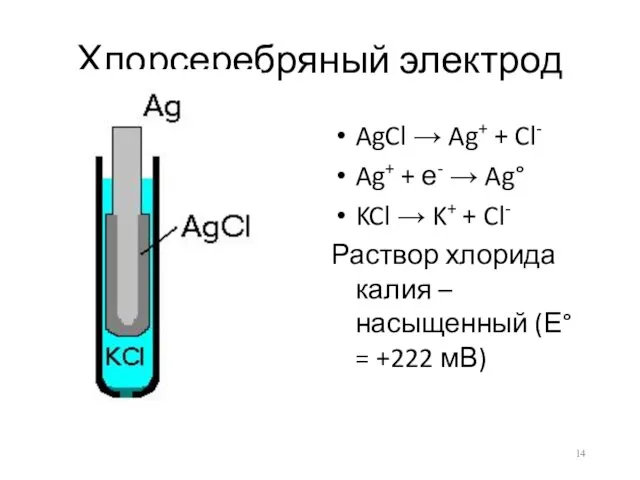
- 14. Хлорсеребряный электрод AgCl → Ag+ + Cl- Ag+ + е- → Ag° KCl → K+ +
- 15. Классификация электродов Электроды I типа Электродный потенциал создается на границе металл / раствор в результате окислительно-восстановительной
- 16. Ионометаллические электроды 1-го рода: электроды, обратимые относительно или катиона или аниона (цинковый, медный, газовые). Представляет собой
- 17. Окислительно-восстановительные электроды Электроды, в которых материал электрода в окислительно-восстановительном процессе не участвует; он является только переносчиком
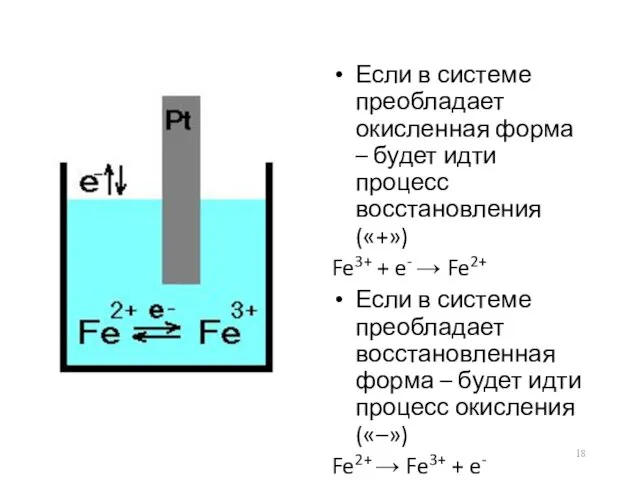
- 18. Если в системе преобладает окисленная форма – будет идти процесс восстановления («+») Fe3+ + e- →
- 19. Уравнение Нернста-Петерса 0,2Т [OX] Eо-в = Е°о-в + ---------- ⋅ lg----------- n [Red] n – количество
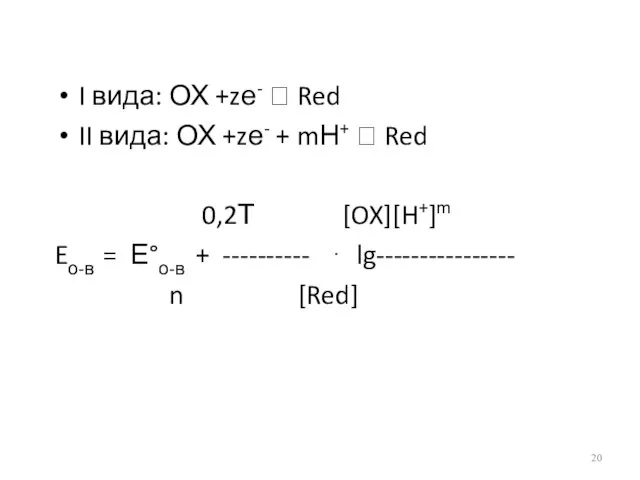
- 20. I вида: ОХ +zе- ⮀ Red II вида: ОХ +zе- + mН+ ⮀ Red 0,2Т [OX][H+]m
- 21. Электроды II типа Электродный потенциал возникает на границе раздела двух растворов, отделенных мембраной с избирательной проницаемостью
- 22. Стандартные О-В потенциалы Характеризуют способность системы функционировать в качестве окислителя или восстановителя
- 23. О-В системы в живых организмах 0,2Т [пируват][H+]2 Ео-в = Е°о-в + ----------- ⋅ lg------------------- 2 [лактат]
- 25. Скачать презентацию











![Уравнение Нернста-Петерса 0,2Т [OX] Eо-в = Е°о-в + ---------- ⋅ lg-----------](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/448872/slide-18.jpg)


![О-В системы в живых организмах 0,2Т [пируват][H+]2 Ео-в = Е°о-в +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/448872/slide-22.jpg)
 Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Обмен белков
Обмен белков Мир стекла
Мир стекла Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры ЙОД ( I ) Презентація Учениці 10-В Сухарської Ольги
ЙОД ( I ) Презентація Учениці 10-В Сухарської Ольги  Углероды. Строение и свойства атомов
Углероды. Строение и свойства атомов ОГЭ по химии. (Занятие 6)
ОГЭ по химии. (Занятие 6) Исследовательская работа «Известная и неизвестная вода» Руководители проекта: Немцева Т.А. – учитель биологии и химии. Коновале
Исследовательская работа «Известная и неизвестная вода» Руководители проекта: Немцева Т.А. – учитель биологии и химии. Коновале Застосування нафти та нафтопродуктів Презентацію підготували учениці 11-В класу Кузнецовської гімназії Турик Даша та Коновал
Застосування нафти та нафтопродуктів Презентацію підготували учениці 11-В класу Кузнецовської гімназії Турик Даша та Коновал  Химическая взрывчатка
Химическая взрывчатка Ароматические углеводороды (арены). Гомологи бензола
Ароматические углеводороды (арены). Гомологи бензола Моделирование химических процессов
Моделирование химических процессов Корбонаттар көмір қышқылынның тұздары
Корбонаттар көмір қышқылынның тұздары Количество вещества. Число Авагадро. Молярная масса
Количество вещества. Число Авагадро. Молярная масса Минералогия. Силикаты
Минералогия. Силикаты Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне
Среднее (полное) общее образование. Химия. Изучение химии на профильном уровне Алкалоиды группы хинолина и изохинолина
Алкалоиды группы хинолина и изохинолина Бензен
Бензен  Интоксикация пестицидами
Интоксикация пестицидами Минералы и горные породы
Минералы и горные породы Задачи в школьном курсе химии
Задачи в школьном курсе химии Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов
Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов Основное уравнение молекулярно-кинетической теории
Основное уравнение молекулярно-кинетической теории Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Углерод, физические и химические свойства
Углерод, физические и химические свойства