Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об эффекте сопряжения, критериях ароматичности и электронных эффектах заместителей. РАЗВИВАЮЩАЯ: расширить
- 3. Сопряжение В молекулах органических соединений возникают различные электронные эффекты, сопровождающиеся перераспределением электронной плотности ковалентных связей. Сопряжение
- 4. Сопряжение В сопряженных системах возникает делокализованная связь, молекулярная орбиталь которой охватывает более двух атомов. Сопряжённые системы
- 5. Сопряжение Различают 2 основных вида сопряжения: π-π-сопряжение и p-π-сопряжение. π-π-сопряженная система – это система с чередующимися
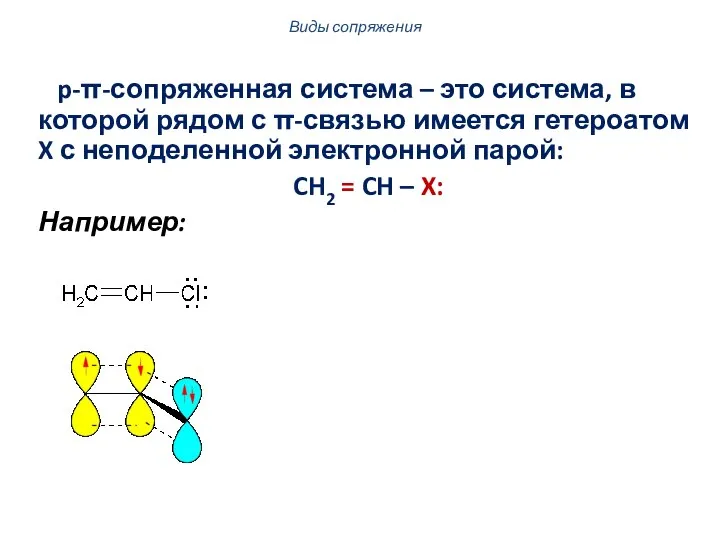
- 6. p-π-сопряженная система – это система, в которой рядом с π-связью имеется гетероатом X с неподеленной электронной
- 7. Сопряженная система бутадиен-1,3 CH2=CH-CH=CH2 В молекуле этого соединения все атомы углерода находятся в состоянии sp2-гибридизации и
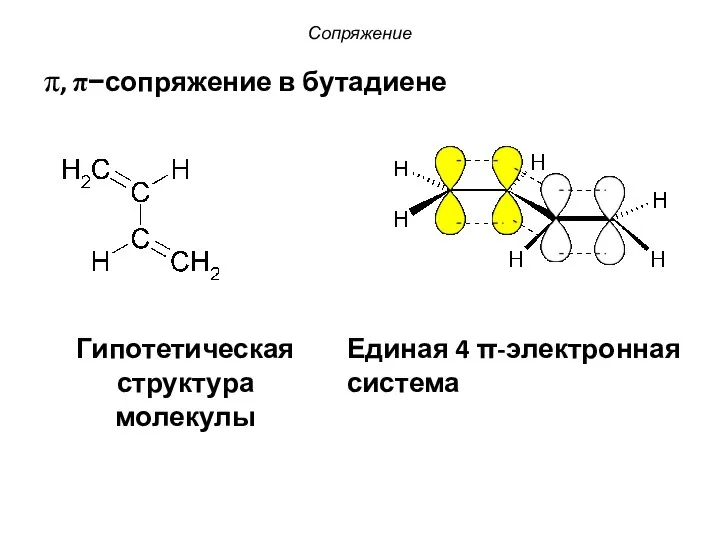
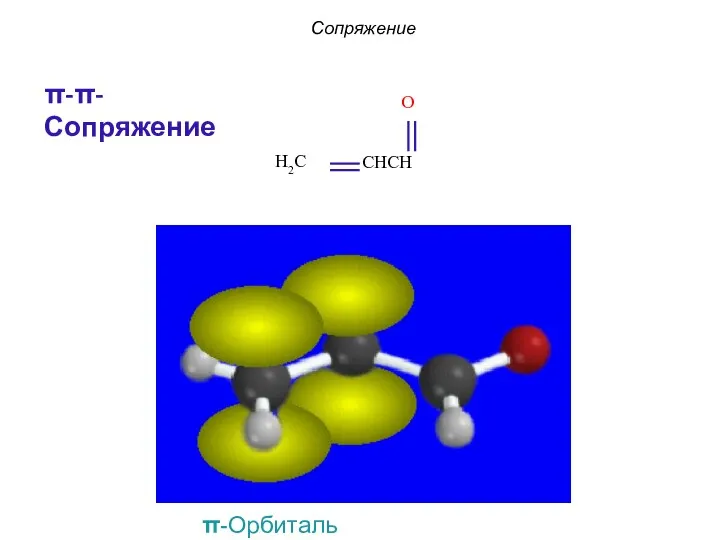
- 8. π, π−сопряжение в бутадиене Сопряжение Гипотетическая структура молекулы Единая 4 π-электронная система
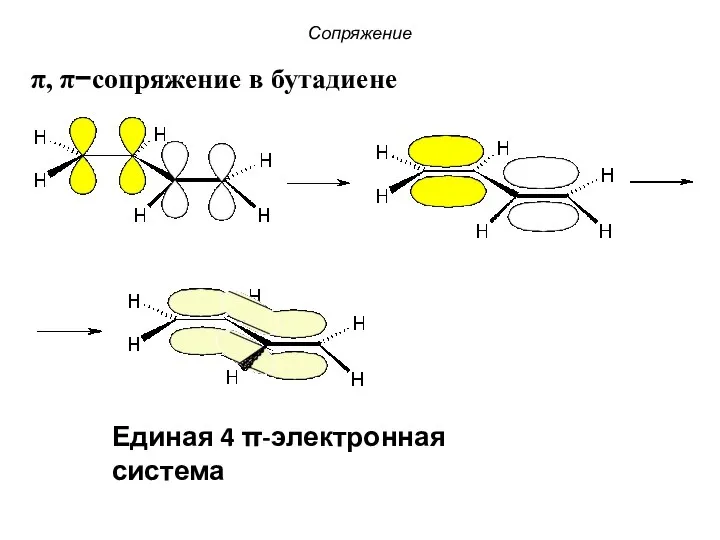
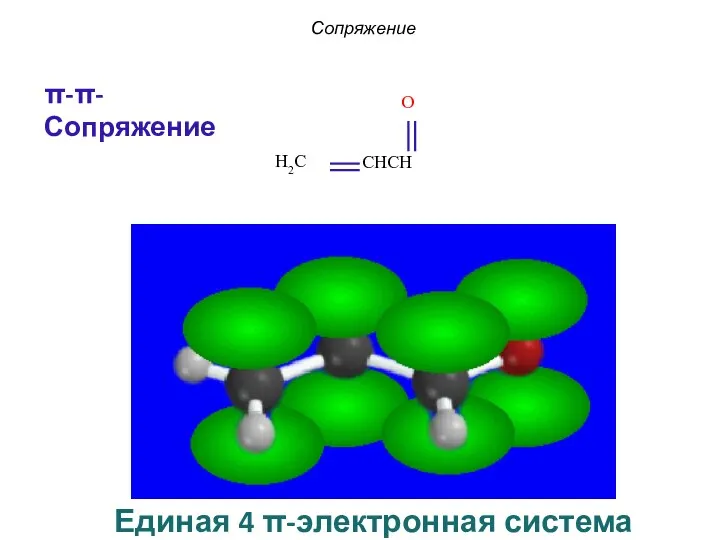
- 9. π, π−сопряжение в бутадиене Единая 4 π-электронная система Сопряжение
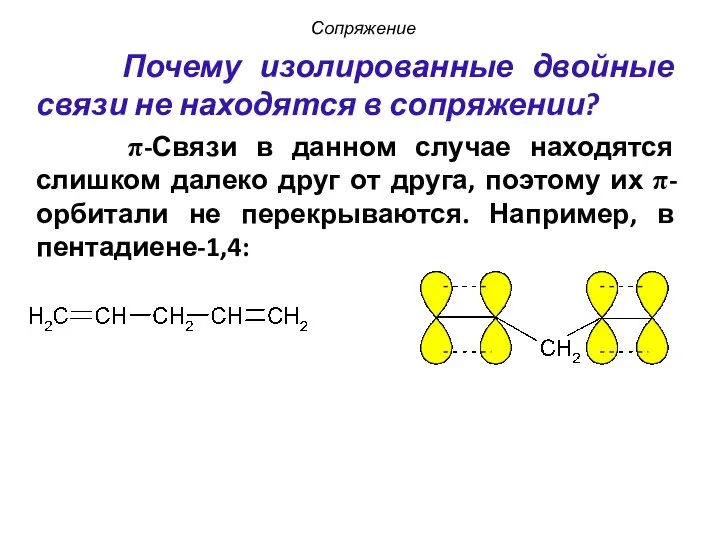
- 10. Почему изолированные двойные связи не находятся в сопряжении? π-Связи в данном случае находятся слишком далеко друг
- 11. Сопряжение Система сопряжения может включать и гетероатом (О, N, S). π-π-Сопряжение c гетероатомом в цепи осуществляется
- 12. Сопряжение π-π-Сопряжение π-Орбиталь
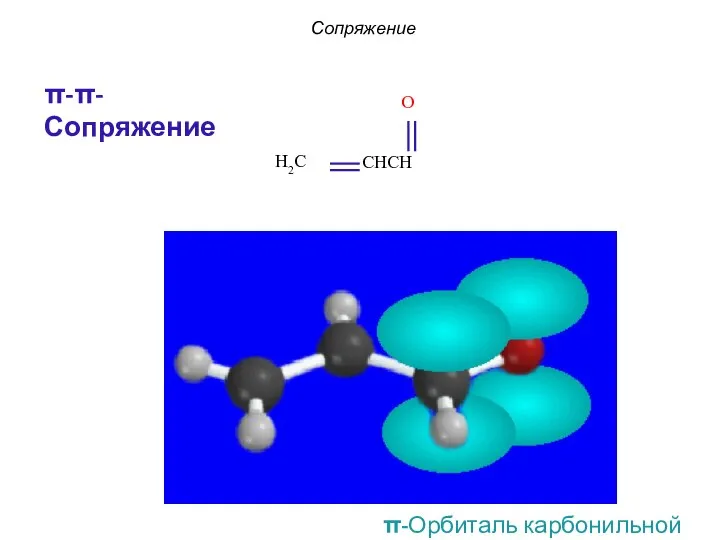
- 13. Сопряжение π-π-Сопряжение π-Орбиталь карбонильной группы
- 14. Сопряжение π-π-Сопряжение Единая 4 π-электронная система
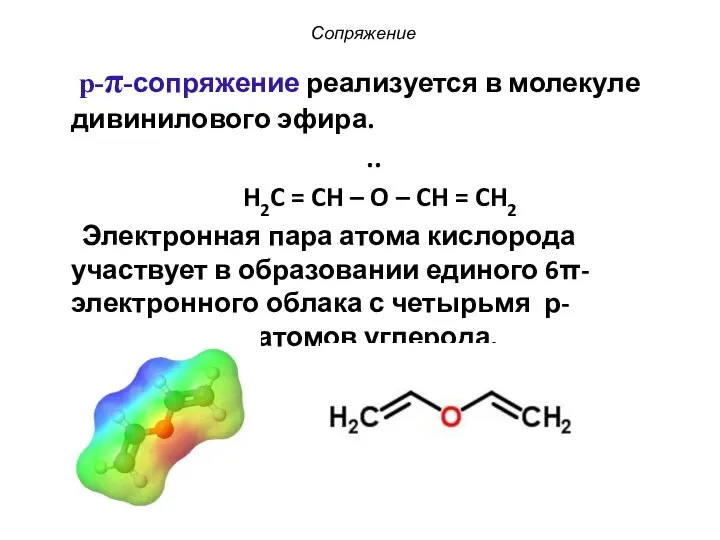
- 15. Сопряжение p-π-сопряжение реализуется в молекуле дивинилового эфира. .. H2C = CH – O – CH =
- 16. π-Орбиталь карбонильной группы Сопряжение p-π-Сопряжение в производных карбонильных соединений
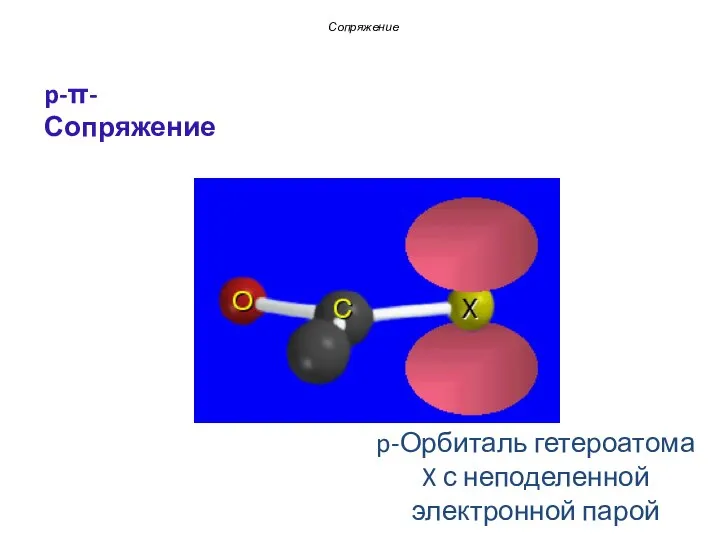
- 17. p-Орбиталь гетероатома X с неподеленной электронной парой Сопряжение p-π-Сопряжение
- 18. Единая 4π-электронная система Сопряжение p-π-Сопряжение
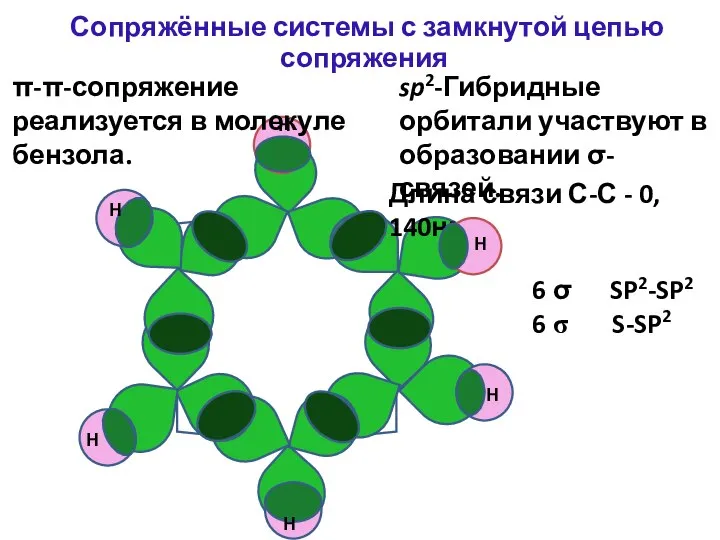
- 19. Длина связи С-С - 0, 140нм Н Н Н Н Н Н 6 σ SP2-SP2 6
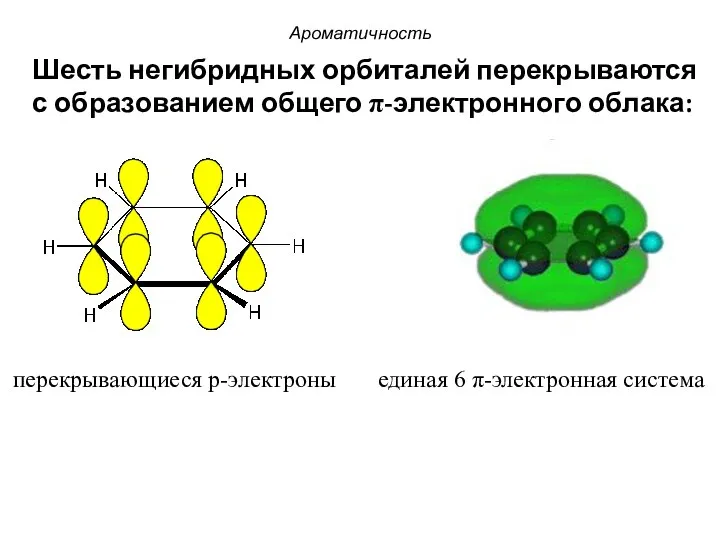
- 20. перекрывающиеся p-электроны единая 6 π-электронная система Шесть негибридных орбиталей перекрываются с образованием общего π-электронного облака: Ароматичность
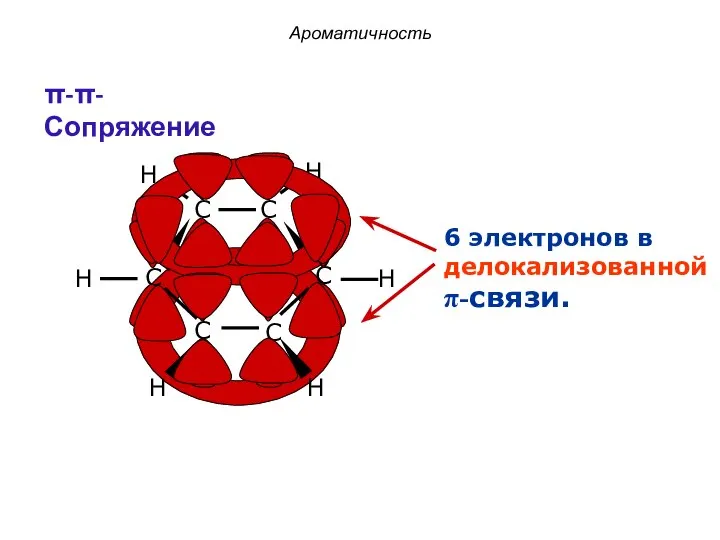
- 21. 6 электронов в делокализованной π-связи. Ароматичность π-π-Сопряжение
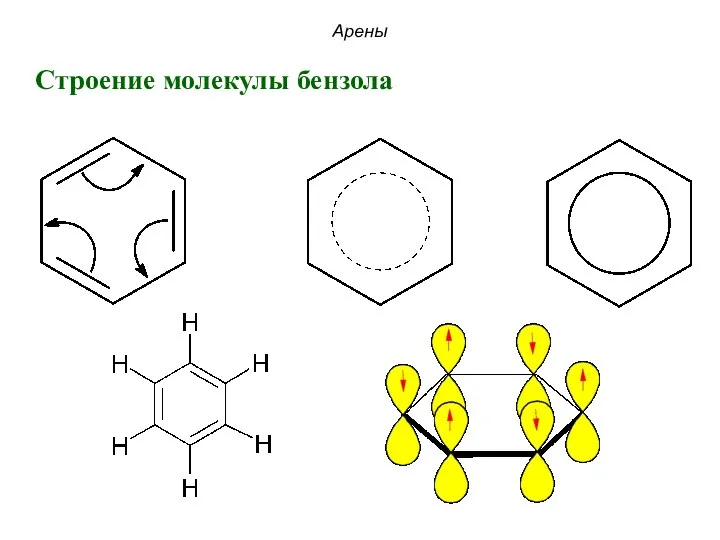
- 22. Арены Строение молекулы бензола
- 23. Арены Строение молекулы бензола
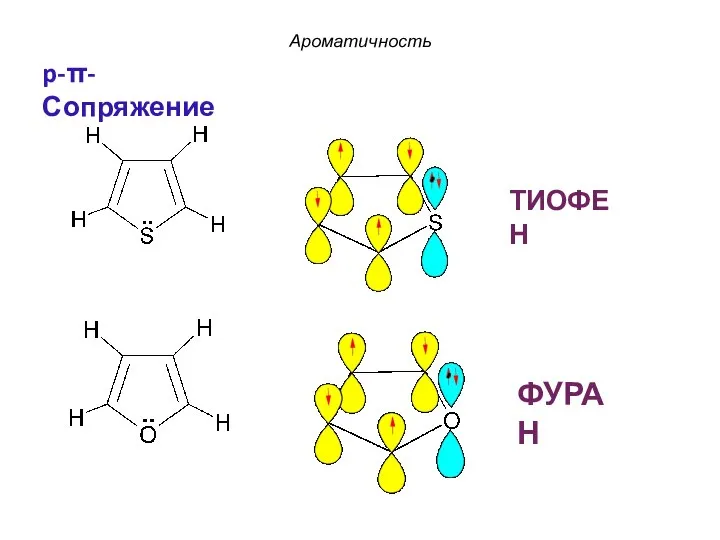
- 24. ФУРАН ТИОФЕН Ароматичность p-π-Сопряжение
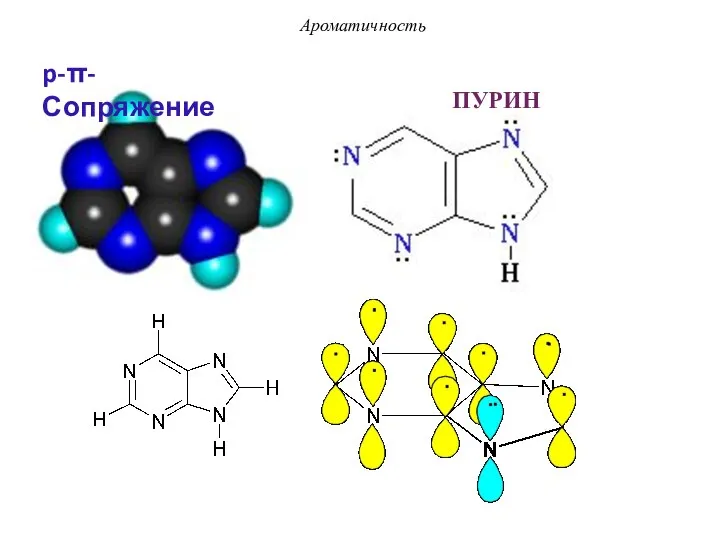
- 25. ПУРИН Ароматичность p-π-Сопряжение
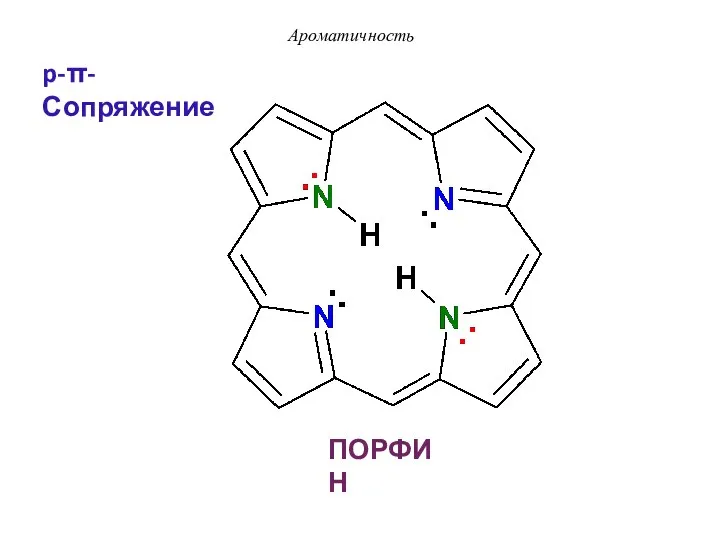
- 26. ПОРФИН Ароматичность p-π-Сопряжение
- 27. Устойчивость cопряженных систем О термодинамической устойчивости сопряженной системы можно судить по величине энергии сопряжения, которая выделяется
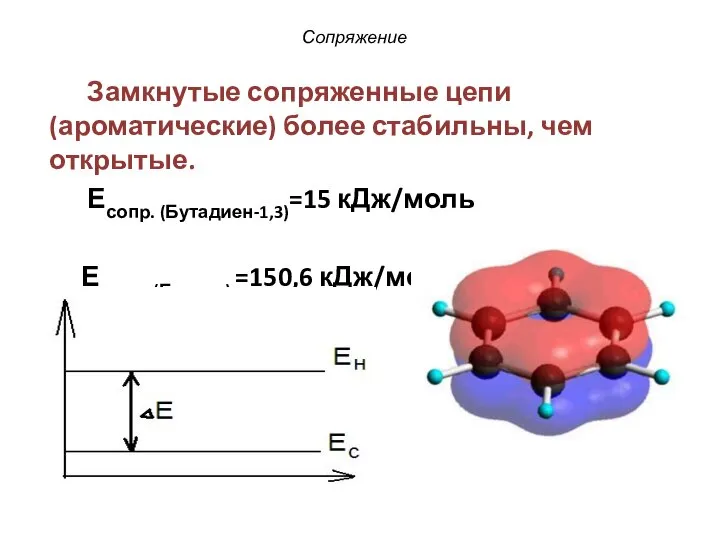
- 28. Сопряжение Замкнутые сопряженные цепи (ароматические) более стабильны, чем открытые. Есопр. (Бутадиен-1,3)=15 кДж/моль Есопр. (Бензол) =150,6 кДж/моль
- 29. Ароматичность В циклических соединениях при определенных условиях может возникнуть замкнутая сопряженная система. Примером такого соединения является
- 30. Эрих Хюккель 1896-1980 Бензол С6Н6 является ароматическим соединением, т.к. отвечает критериям ароматичности . Хюккель Ароматичность
- 31. Ароматичность Критерии ароматичности (Хюккель, 1931г.): 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в
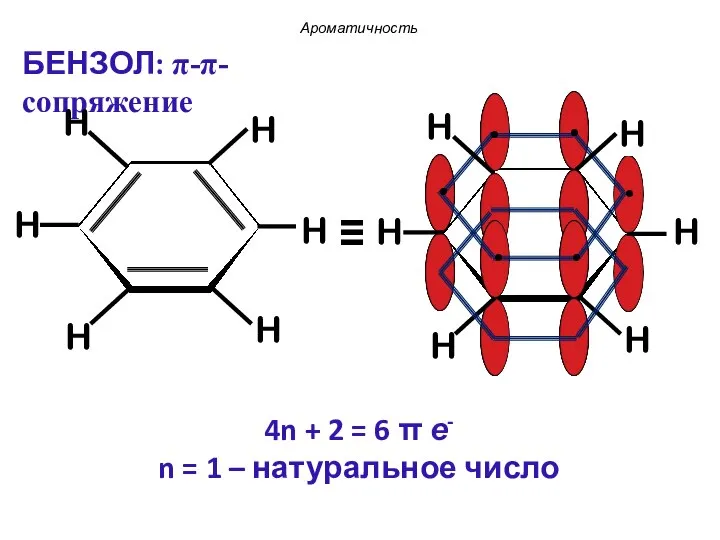
- 32. 4n + 2 = 6 π е- n = 1 – натуральное число Ароматичность БЕНЗОЛ: π-π-сопряжение
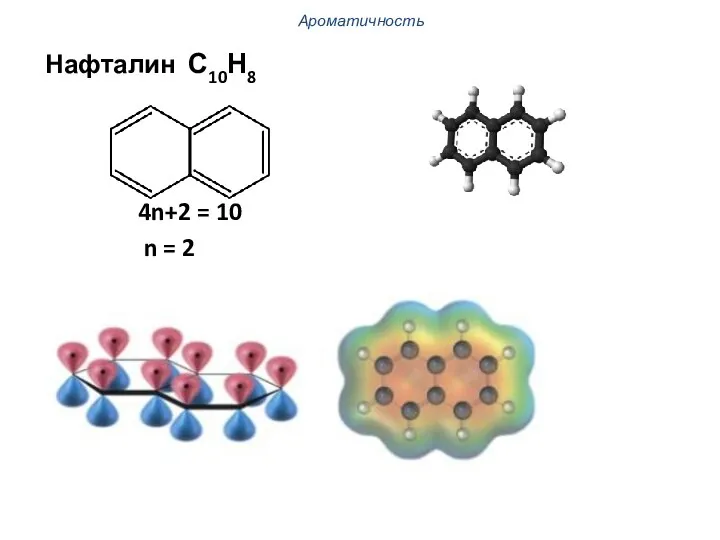
- 33. Ароматичность Нафталин С10Н8 4n+2 = 10 n = 2
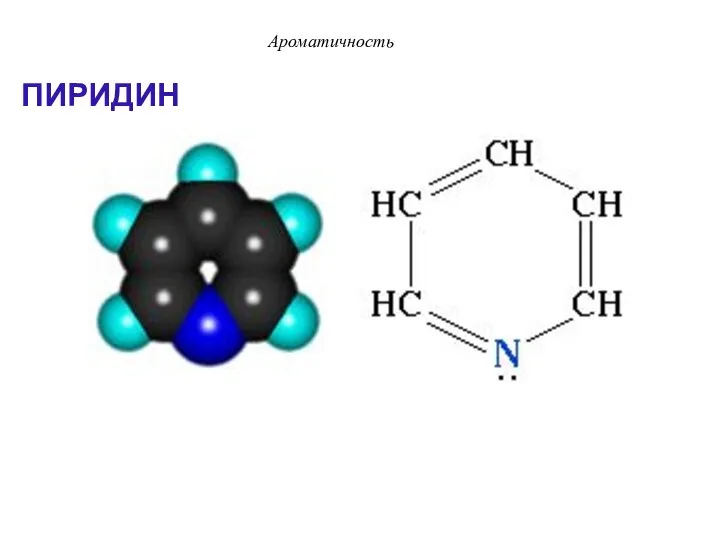
- 34. ПИРИДИН Ароматичность
- 35. Ароматичность Пиридин отвечает критериям ароматичности: 1. Молекула имеет циклическое строение. 2. Все атомы цикла находятся в
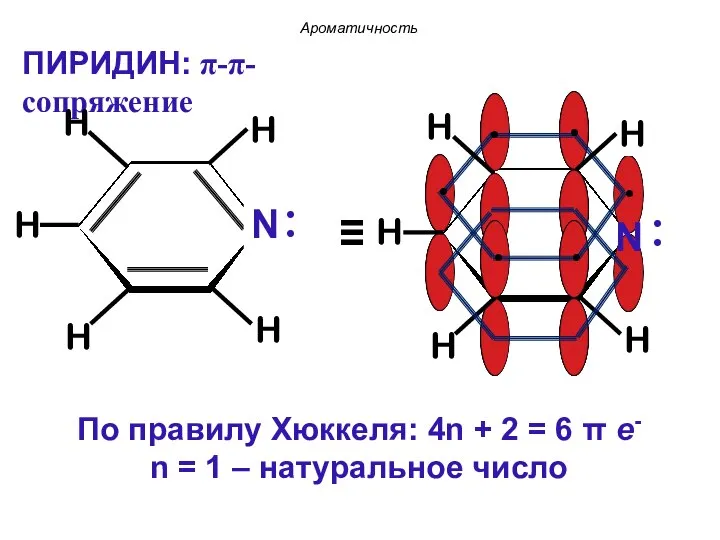
- 36. По правилу Хюккеля: 4n + 2 = 6 π е- n = 1 – натуральное число
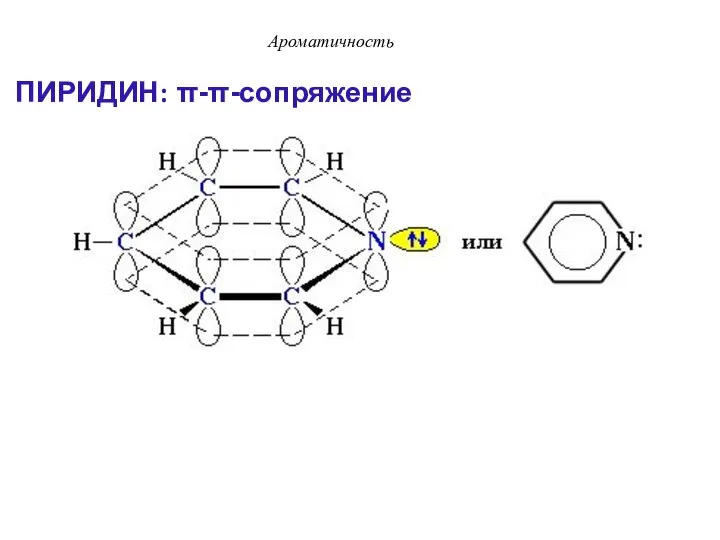
- 37. ПИРИДИН: π-π-сопряжение Ароматичность
- 38. Ароматичность Атом азота поставляет в сопряженную цепь один электрон и сохраняет пару электронов вне сопряженной цепи.
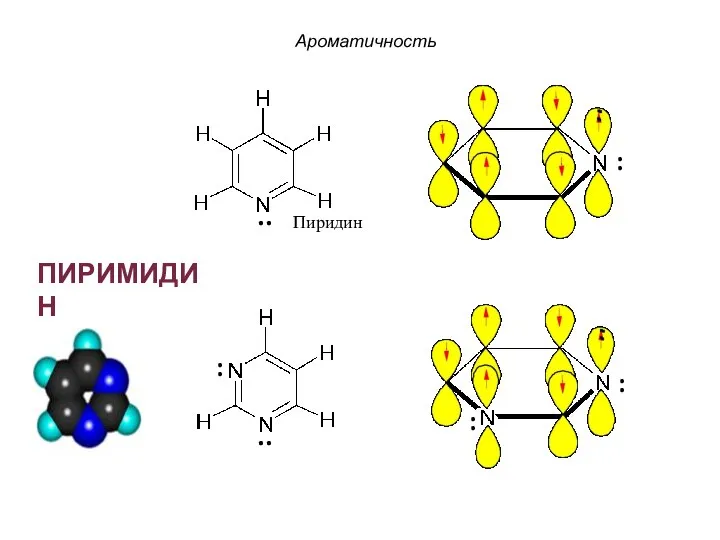
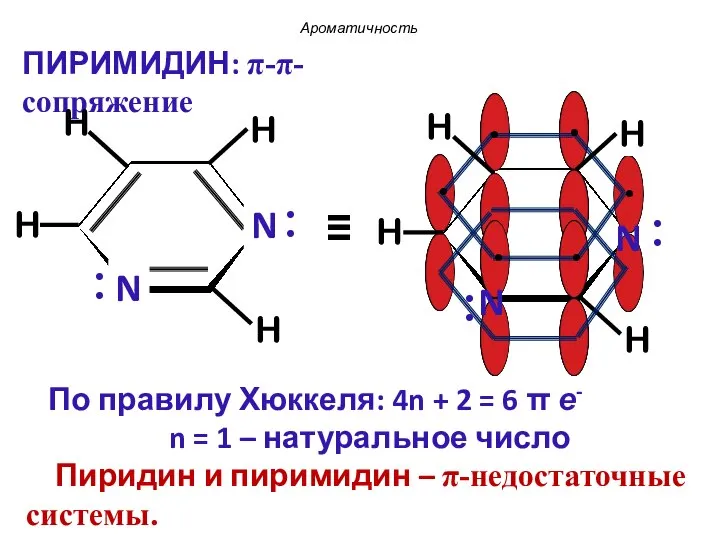
- 39. Пиридин ПИРИМИДИН Ароматичность : .. .. : : :
- 40. По правилу Хюккеля: 4n + 2 = 6 π е- n = 1 – натуральное число
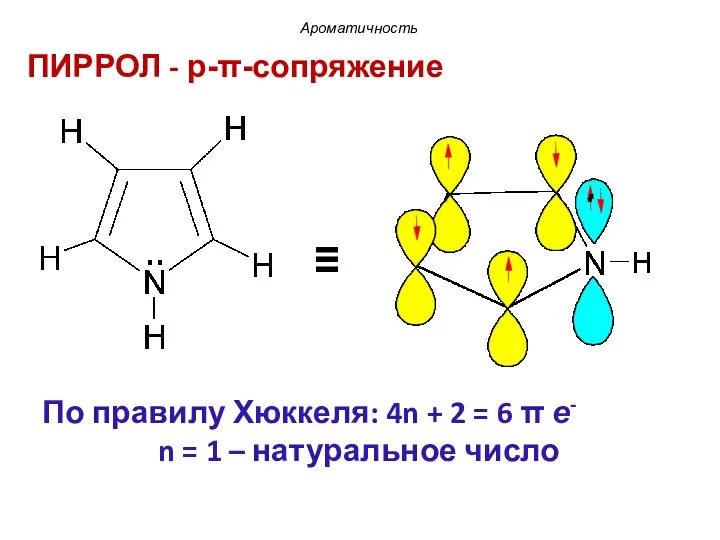
- 41. ПИРРОЛ - p-π-сопряжение Ароматичность ≡ По правилу Хюккеля: 4n + 2 = 6 π е- n
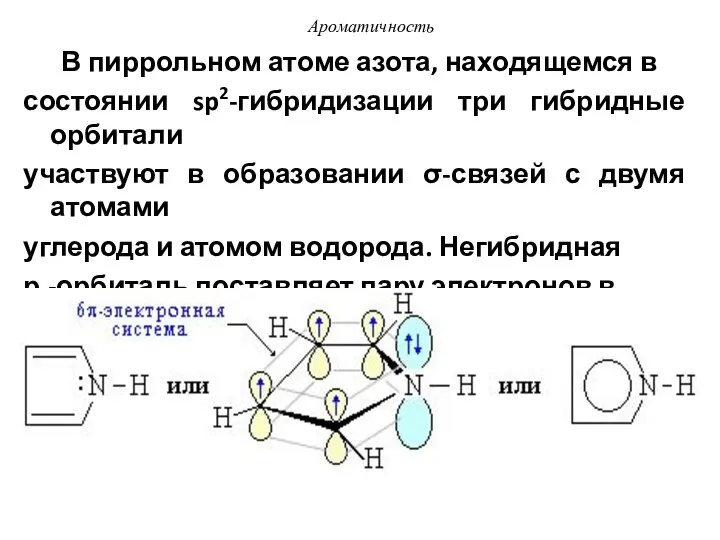
- 42. В пиррольном атоме азота, находящемся в состоянии sp2-гибридизации три гибридные орбитали участвуют в образовании σ-связей с
- 43. Ароматичность Такая система называется π-избыточной или суперароматической. В молекуле пиррола 6 π-электронное облако образуется за счет
- 44. Ароматичность Таким образом в составе ароматических гетероциклических азотсодержащих структур можно выделить два состояния атома азота: ..
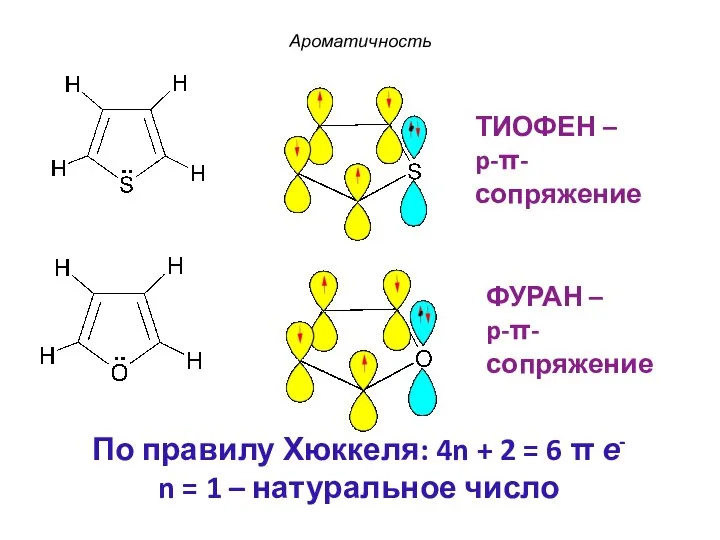
- 45. ФУРАН – p-π-сопряжение ТИОФЕН – p-π-сопряжение Ароматичность По правилу Хюккеля: 4n + 2 = 6 π
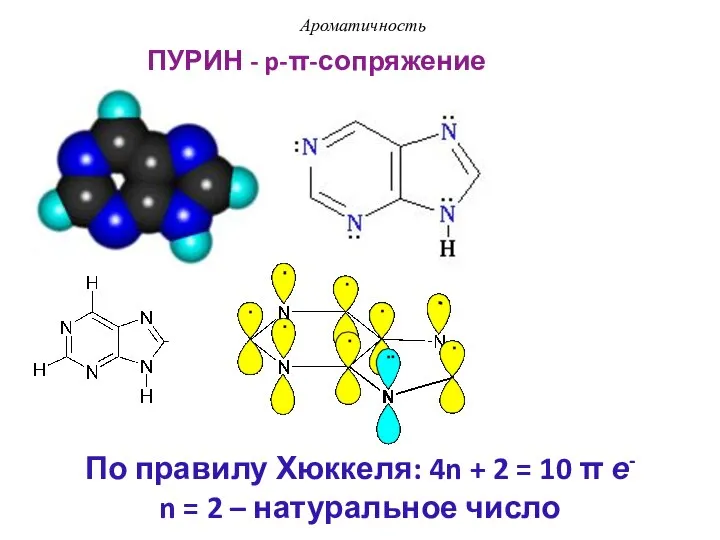
- 46. ПУРИН - p-π-сопряжение Ароматичность По правилу Хюккеля: 4n + 2 = 10 π е- n =
- 47. ПОРФИН- p-π-сопряжение Ароматичность По правилу Хюккеля: 4n + 2 = 26 π е- n = 6
- 48. Взаимное влияние атомов в молекуле может осуществляться по системе σ-связей (индуктивный эффект), по системе π-связей (мезомерный
- 49. Электронные эффекты заместителей Индуктивный эффект обозначают буквой I и графически изображают стрелкой, остриё которой направлено в
- 50. –I эффект проявляют заместители, которые содержат атомы с большей ЭО, чем у углерода: -F, -Cl, -Br,
- 51. +I эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: металлы (-Mg, -Li); насыщенные углеводородные радикалы (-CH3,
- 52. Мезомерный эффект – смещение электронной плотности по цепи сопряженных π-связей. Возникает только при наличии сопряжения связей.
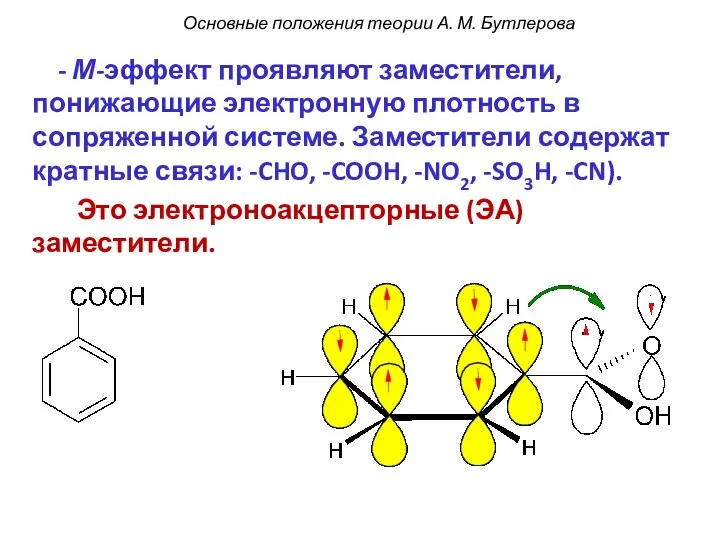
- 53. - М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители содержат кратные связи: -CHO, -COOH,
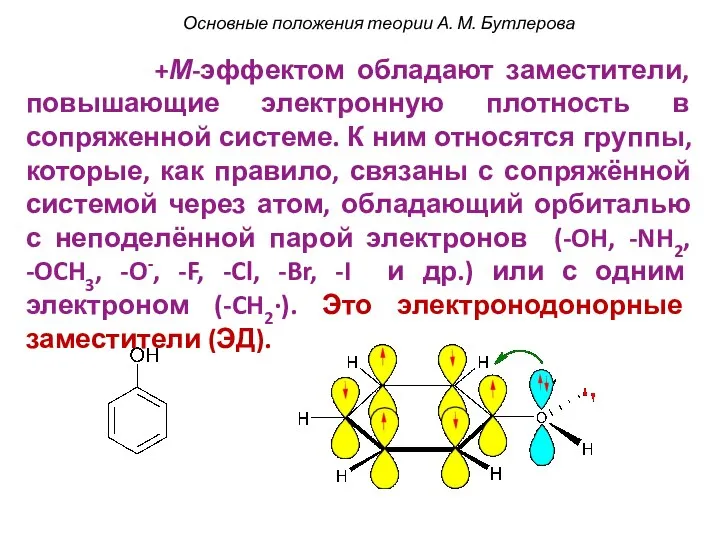
- 54. +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые, как правило,
- 55. Электронные эффекты заместителей Графически действие мезомерного эффекта изображают изогнутой стрелкой, начало которой показывает какие (π -
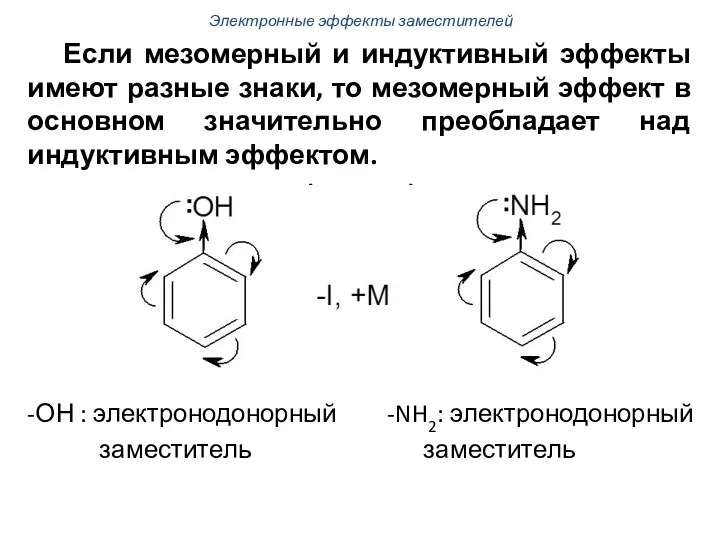
- 56. Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект в основном значительно преобладает над
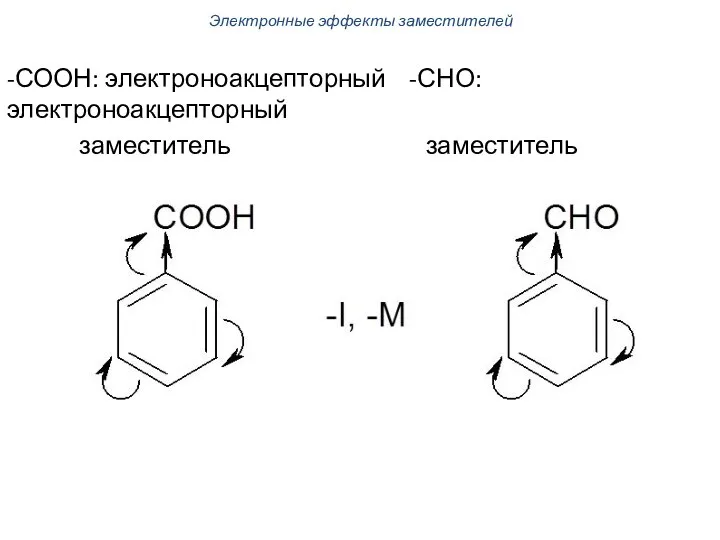
- 57. -СООН: электроноакцепторный -СНО: электроноакцепторный заместитель заместитель Электронные эффекты заместителей
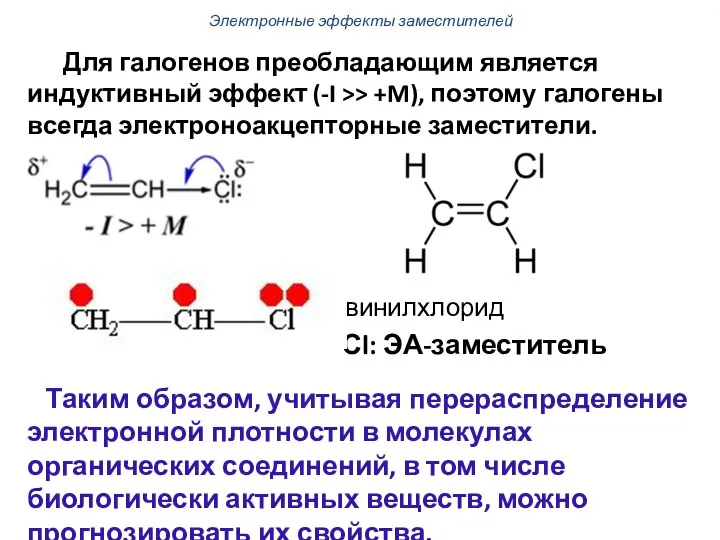
- 58. Для галогенов преобладающим является индуктивный эффект (-I >> +M), поэтому галогены всегда электроноакцепторные заместители. винилхлорид -Сl:
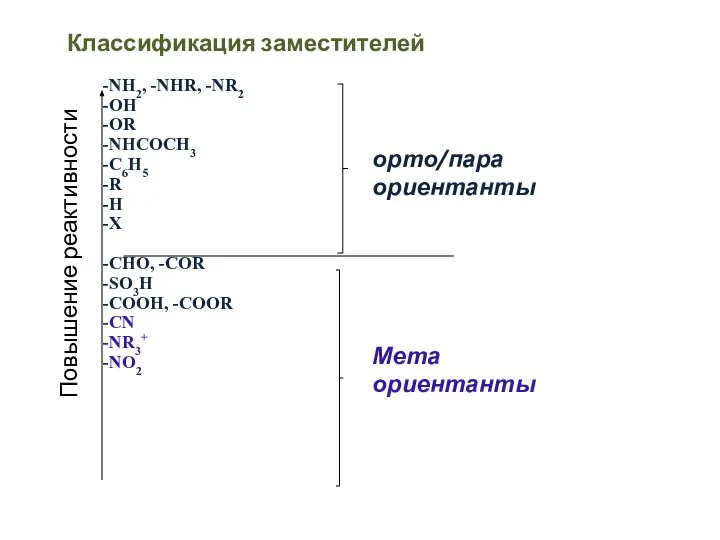
- 59. Классификация заместителей -NH2, -NHR, -NR2 -OH -OR -NHCOCH3 -C6H5 -R -H -X -CHO, -COR -SO3H -COOH,
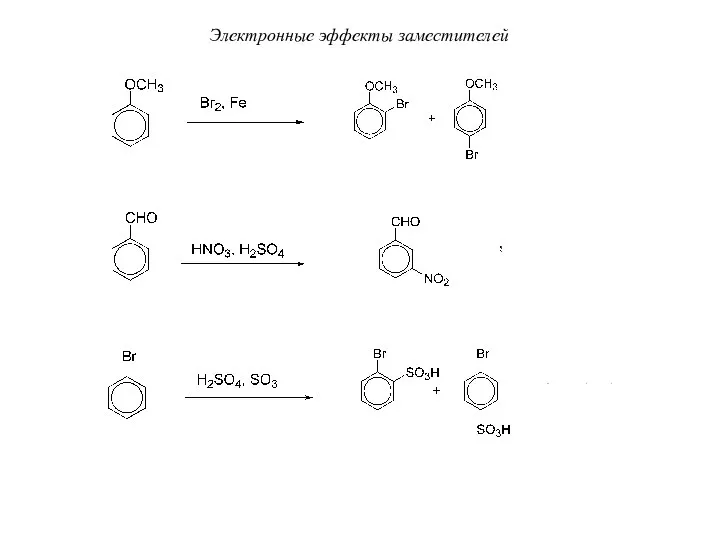
- 60. Электронные эффекты заместителей
- 62. Скачать презентацию
























 Цинк. Нахождение в природе
Цинк. Нахождение в природе Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ Общая фармакология
Общая фармакология Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Структурные превращения стали 15Х5М при различных режимах термической обработки
Структурные превращения стали 15Х5М при различных режимах термической обработки Живая химия
Живая химия Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3)
Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3) Оксиды углерода
Оксиды углерода Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Липатова Яна
Липатова Яна Фотохимический смог
Фотохимический смог Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП
Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП Амиды кислот. Азо- и диазосоединения
Амиды кислот. Азо- и диазосоединения «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Мои первые химические опыты
Мои первые химические опыты Яковлева Татьяна Алексеевна Ярославль, 2009 г.
Яковлева Татьяна Алексеевна Ярославль, 2009 г.  Ионообменная хроматография
Ионообменная хроматография Металлы Общая характеристика
Металлы Общая характеристика Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов
Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов Презентация по Химии "щелочные метал" - скачать смотреть бесплатно
Презентация по Химии "щелочные метал" - скачать смотреть бесплатно Chemical bonds
Chemical bonds Коллигативные свойства растворов
Коллигативные свойства растворов Аспірин Даниленко, Реутенко 11-А
Аспірин Даниленко, Реутенко 11-А  Химические свойства алкинов
Химические свойства алкинов Девиз урока: «Зажечь, увлечь и подвести»
Девиз урока: «Зажечь, увлечь и подвести»  Презентация по Химии "Галогены и их соединения" - скачать смотреть
Презентация по Химии "Галогены и их соединения" - скачать смотреть  Цемент. (9 класс)
Цемент. (9 класс)