Электродные потенциалы. Окислительно-восстановительные потенциалы. Потенциометрия в медицинской практике
Содержание
- 2. Электродные потенциалы. Окислительно–восстановительные потенциалы. Потенциометрия в медицинской практике. Цель Задачи обучения: Студент должен знать: Студент должен
- 3. Цель: Изучить причину возникновения электродных потенциалов. Особенности окислительно-восстановительных потенциалов, применение потенциометрии в медицинской практике. .
- 4. Студент должен знать: Причину возникновения электродных потенциалов. Особенности окислительно-восстановительных потенциалов, применение потенциометрии в медицинской практике. .
- 5. Студент должен уметь: рассчитывать значение электродных потенциалов и ЭДС элемента; определять потенциометрически рН растворов и концентрацию
- 6. Владеть навыками: определять потенциометрически рН растворов и концентрацию хлороводородной кислоты методом потенциометрического титрования.
- 7. Основные вопросы темы : 1. Электродные потенциалы. Механизм возникновения электродного потенциала. Формула Нернста. 2. КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ:
- 8. Методы обучения и преподавания: Определение входного уровня знаний, беседа по теме занятия, выполнение лабораторной работы и
- 9. Контроль: №1. Вычислить потенциал медного электрода при 180С, погруженного в раствор своей соли с концентрацией 0,1
- 10. Практические навыки: Тема: Потенциометрическое измерение рН исследуемых растворов. Приборы и реактивы: рНметр, стаканы, исследуемые растворы: NaOH,
- 12. Скачать презентацию









 Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Строение атома
Строение атома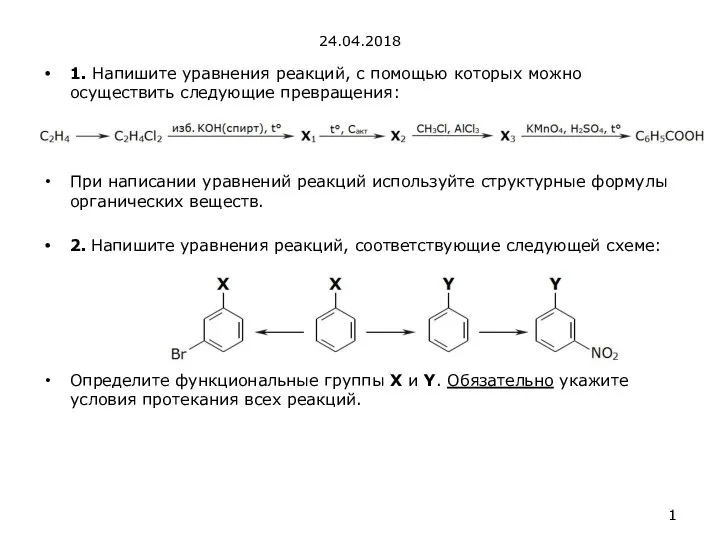 Срез знаний по химии
Срез знаний по химии Алкины
Алкины Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Использование технологии критического мышления на уроках химии
Использование технологии критического мышления на уроках химии Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар
Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Введение в биохимию. Значение биохимии для врача. Химия белка
Введение в биохимию. Значение биохимии для врача. Химия белка Важнейшие минералы
Важнейшие минералы Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Получение фосфорной кислоты
Получение фосфорной кислоты Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть
Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть  Азотные удобрения
Азотные удобрения Атом. Будова атома
Атом. Будова атома Химическая кинетика и катализ
Химическая кинетика и катализ Альдегиды
Альдегиды зубные пасты сравнительная характеристика
зубные пасты сравнительная характеристика Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В.
Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В. Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Radiation dosimetry
Radiation dosimetry VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии
VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Ионы. Проверочная работа
Ионы. Проверочная работа