Содержание
- 2. Законы Фарадея
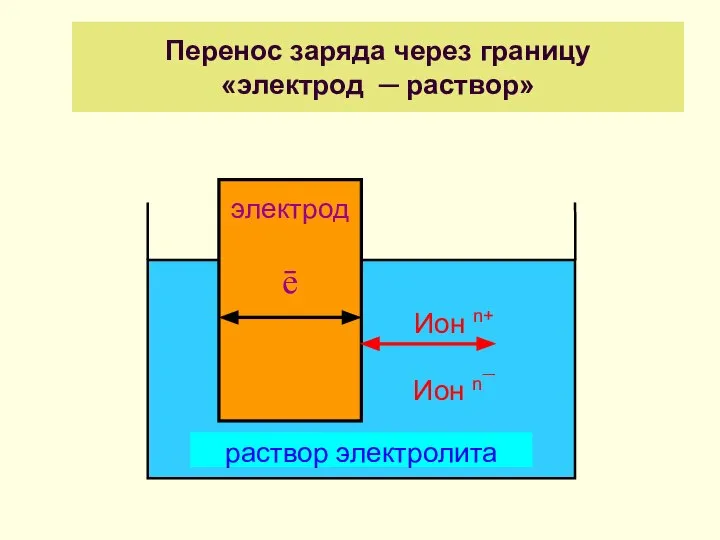
- 4. Перенос заряда через границу «электрод ─ раствор»
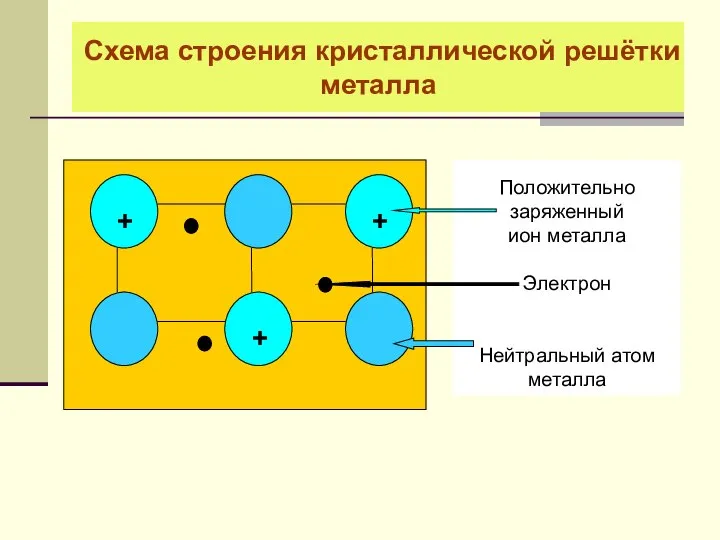
- 5. Схема строения кристаллической решётки металла
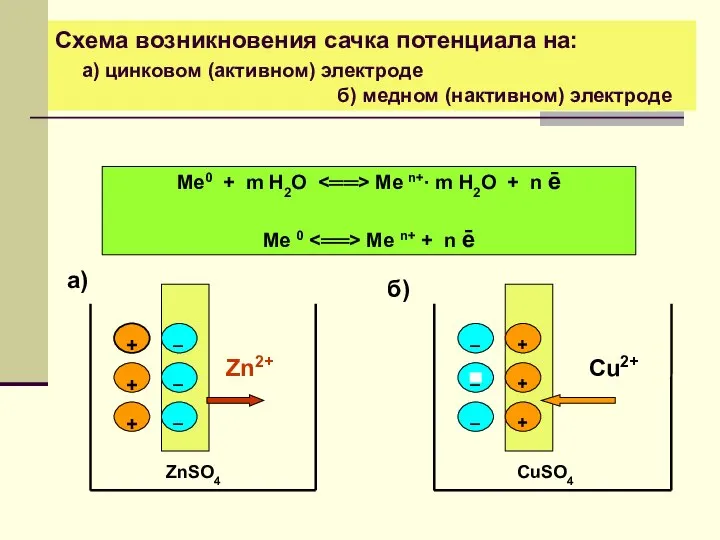
- 6. Cхема возникновения сачка потенциала на: а) цинковом (активном) электроде б) медном (нактивном) электроде
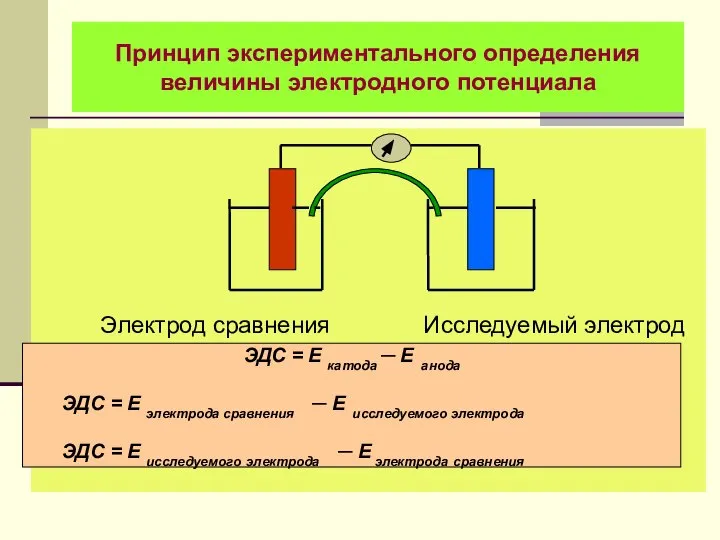
- 7. Принцип экспериментального определения величины электродного потенциала
- 8. Уравнение Нернста – стандартный электродный потенциал, возникающий на границе раздела «металл – раствор» при концентрации ионов
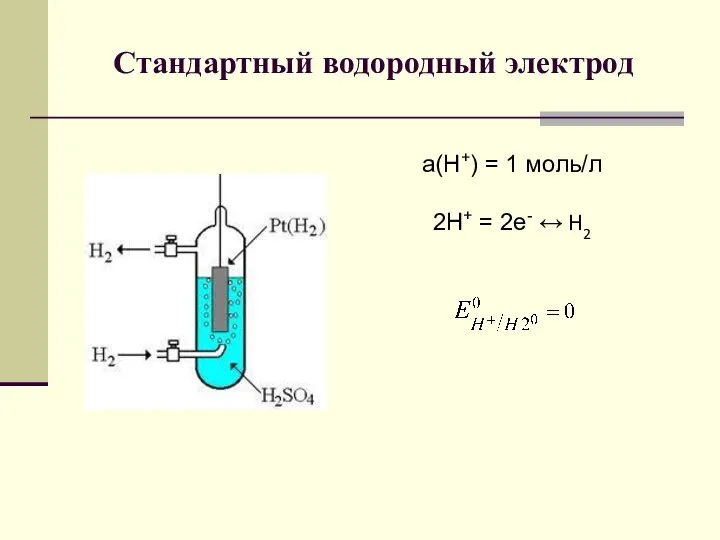
- 9. Стандартный водородный электрод a(H+) = 1 моль/л 2H+ = 2e- ↔ H2
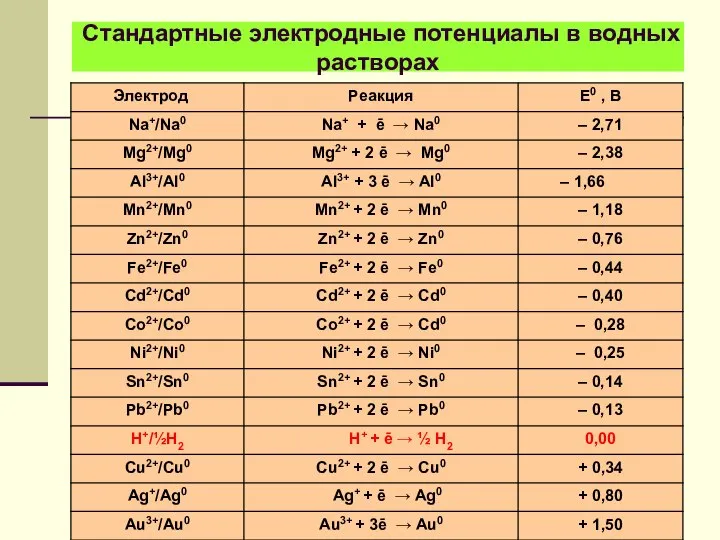
- 10. Стандартные электродные потенциалы в водных растворах
- 11. Ряд активности металлов и вычисление значения электродного потенциала Li,K,Ca,Na,Mg,Al,Mn,Cr,Zn,Fe,Cd,Co,Ni,Sn,Pb,H,Cu,Ag,Hg,Au
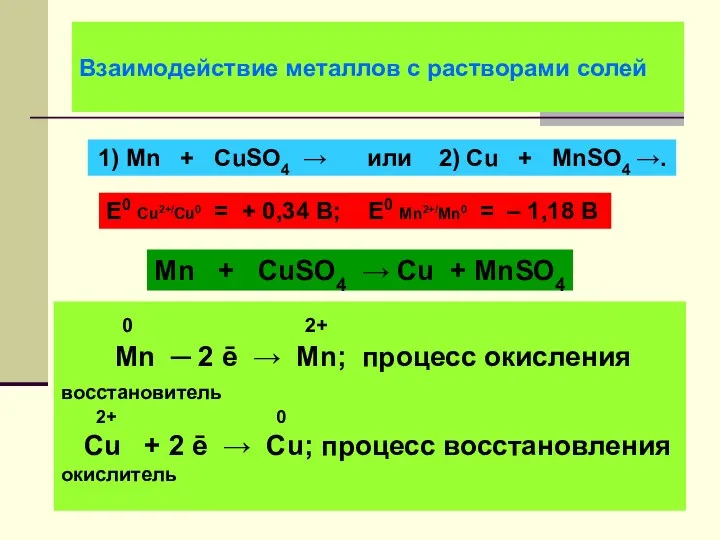
- 12. Взаимодействие металлов с растворами солей 1) Мn + CuSO4 → или 2) Cu + MnSO4 →.
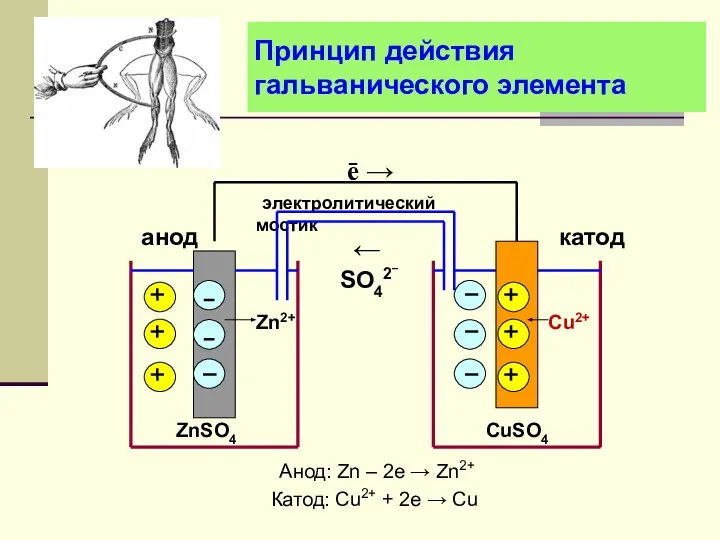
- 13. Принцип действия гальванического элемента Анод: Zn – 2e → Zn2+ Катод: Сu2+ + 2e → Cu
- 14. Схема гальванического элемента и процессы на его электродах [анод] (–) Zn │ ZnSO4 ║ CuSO4 │
- 15. Железосеребряный гальванический элемент Железный электрод в 1,0 М Fe(NO3)2 Серебряный электрод в 0,01 М AgNO3 Е
- 16. Работа гальванического элемента Пока ЭДС не станет равным 0, т.е. выравняются ЭП электродов; Пока не растворится
- 17. Электролиз Литература: Коровин Н.В. Общая химия. ─ М.: Высш. шк., 2000. ─ 558 с. §§ 10.1
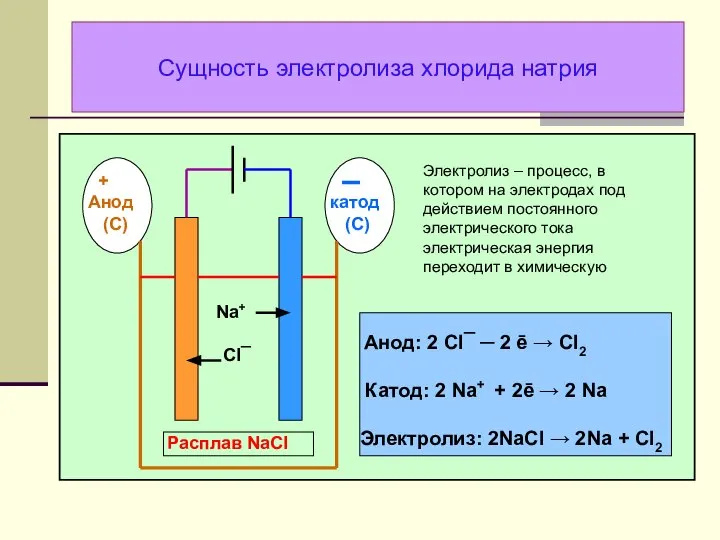
- 18. Сущность электролиза хлорида натрия Электролиз – процесс, в котором на электродах под действием постоянного электрического тока
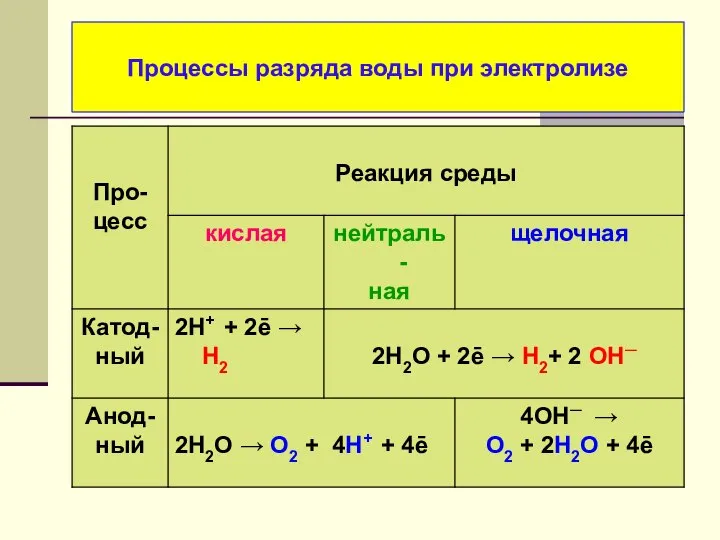
- 19. Процессы разряда воды при электролизе
- 20. Схема электролиза раствора хлорида меди (II)
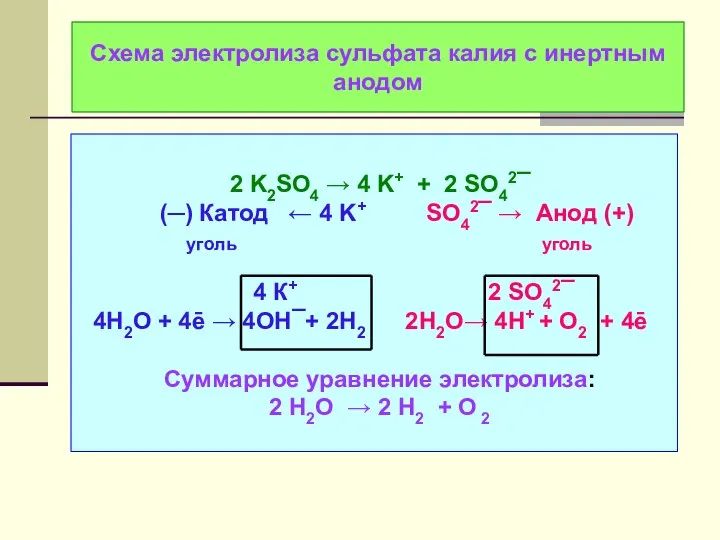
- 21. Схема электролиза сульфата калия с инертным анодом
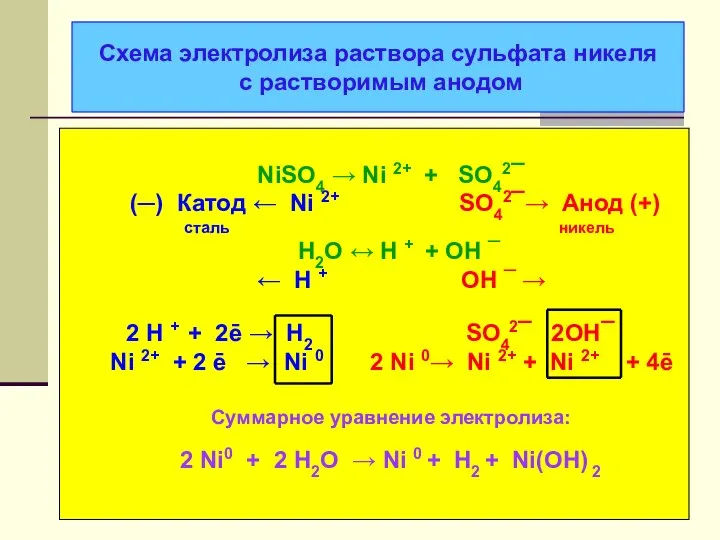
- 22. Cхема электролиза раствора сульфата никеля с растворимым анодом
- 23. Законы Фарадея
- 26. Скачать презентацию



![Схема гальванического элемента и процессы на его электродах [анод] (–) Zn](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/704136/slide-13.jpg)






 Коллоидные растворы
Коллоидные растворы Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Виды присадок к моторным топливам
Виды присадок к моторным топливам Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Биогенные элементы
Биогенные элементы Электролизные установки
Электролизные установки Золото. 79-й элемент таблицы
Золото. 79-й элемент таблицы Геохимия редкоземельных элементов
Геохимия редкоземельных элементов Кислоты. Состав. Классификация
Кислоты. Состав. Классификация Глицерин
Глицерин Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Лекция 7. Электрохимические процессы
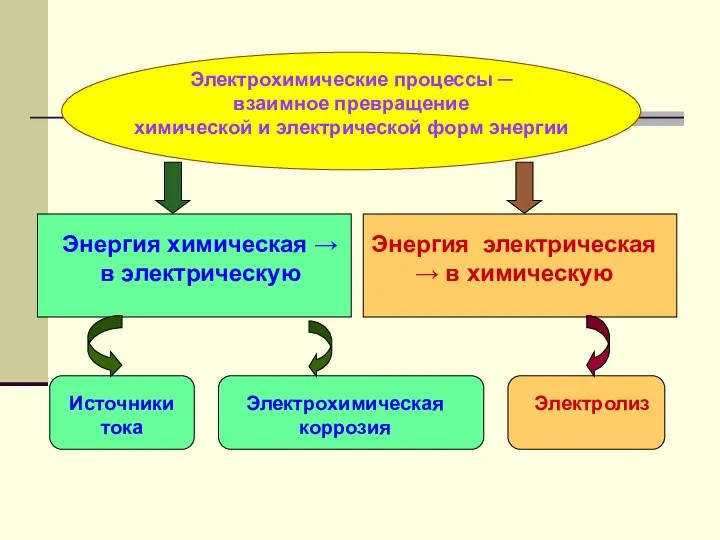
Лекция 7. Электрохимические процессы Поливинилхлорид (ПВХ, PVC)
Поливинилхлорид (ПВХ, PVC) Обмен веществ и энергии в клетке
Обмен веществ и энергии в клетке Циклоалканы
Циклоалканы Гетероциклические соединения
Гетероциклические соединения Применение этанола
Применение этанола вогнегасники Принцип дії вогнегасника
вогнегасники Принцип дії вогнегасника  Алюминий. Сплавы алюминия. Учитель: Белозерова Татьяна Анатольевна Учени
Алюминий. Сплавы алюминия. Учитель: Белозерова Татьяна Анатольевна Учени Подготовка к ЕГЭ
Подготовка к ЕГЭ Лабораторное оборудование, посуда и средства защиты. Химическая лаборатория
Лабораторное оборудование, посуда и средства защиты. Химическая лаборатория Органический синтез на основе углеродсодержащего сырья
Органический синтез на основе углеродсодержащего сырья Презентация по Химии "«Классификация реакций в неорганической химии»" - скачать смотреть
Презентация по Химии "«Классификация реакций в неорганической химии»" - скачать смотреть  Периодическая система химических элементов Д.И. Менделеева. История развития химии
Периодическая система химических элементов Д.И. Менделеева. История развития химии Химические свойства металлов
Химические свойства металлов  Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Соли
Соли Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений