Содержание
- 2. КОЛЛОИДНЫЕ РАСТВОРЫ Образование : диспергирование или измельчение до 1-100 нм конденсация, т.е. укрупнение, соединение отдельных «молекул»
- 3. 1. Суспезоиды Строение коллоидных частиц. Например. mAgNO3 + mKI = mAgI↓ + mKNO3 где m –
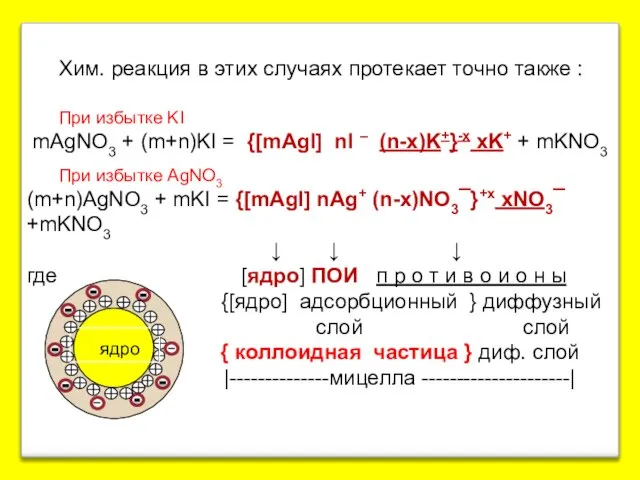
- 4. Хим. реакция в этих случаях протекает точно также : При избытке KI mAgNO3 + (m+n)KI =
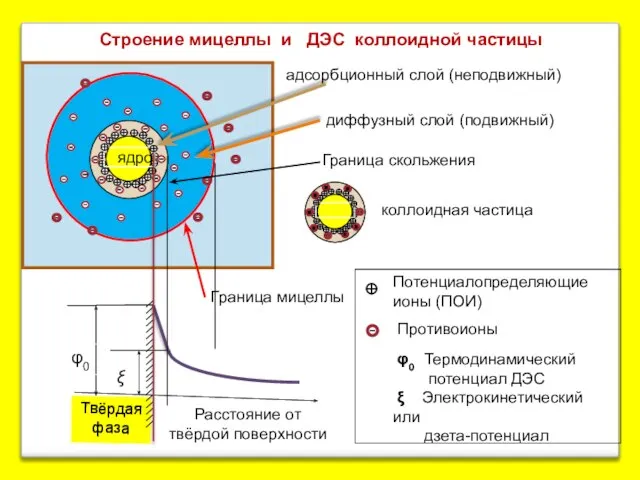
- 5. Роль ПОИ могут играть также и другие ионы, что отражает правило Фаянса. На поверхности ядра лиофобной
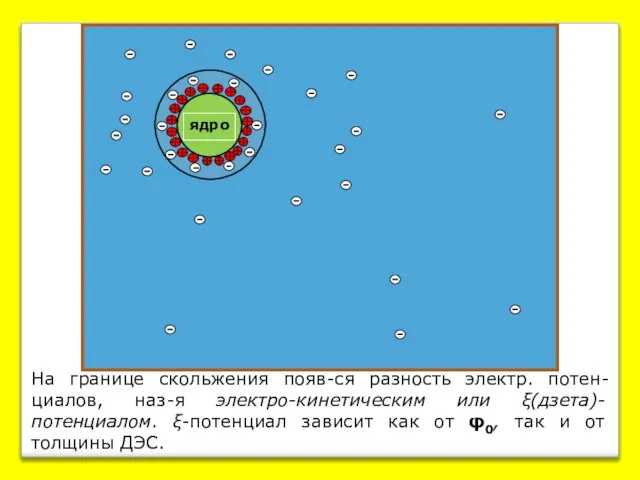
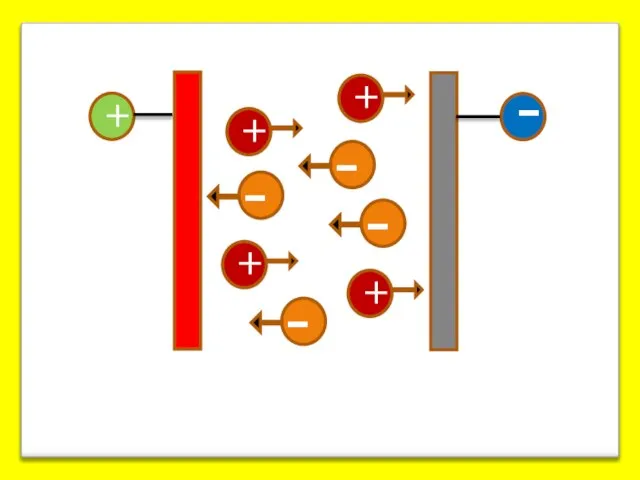
- 6. На границе скольжения появ-ся разность электр. потен-циалов, наз-я электро-кинетическим или ξ(дзета)- потенциалом. ξ-потенциал зависит как от
- 7. Твёрдая фаза Расстояние от твёрдой поверхности Граница скольжения Потенциалопределяющие ионы (ПОИ) Противоионы φ0 Термодинамический потенциал ДЭС
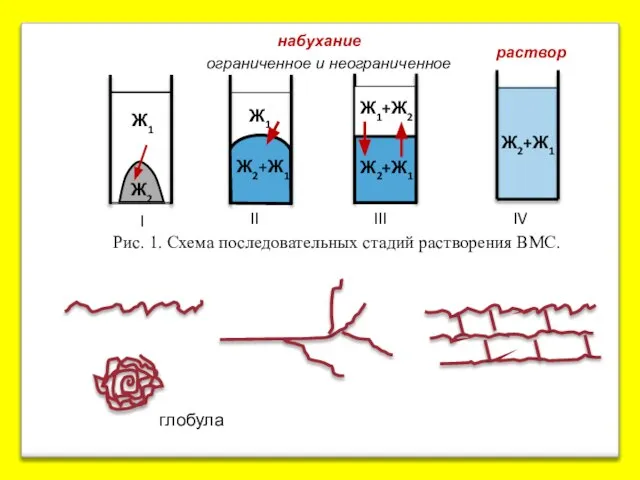
- 11. 2. Молекулярные коллоиды (обратимые и лиофильные) Их образуют природные и синт. ВМС с м.м. от 10-15
- 12. Рис. 1. Схема последовательных стадий растворения ВМС. набухание ограниченное и неограниченное глобула
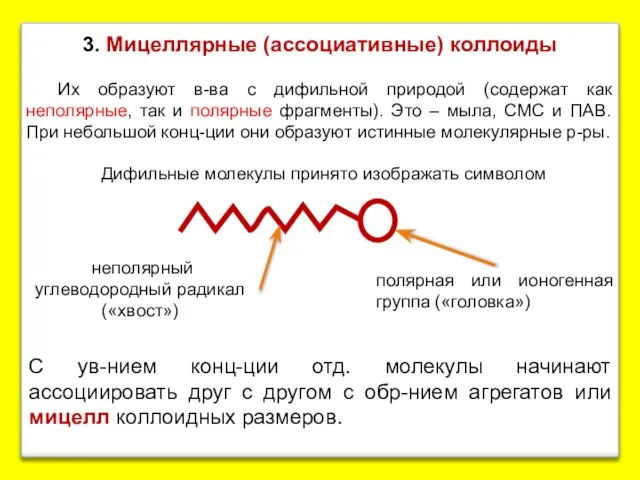
- 13. 3. Мицеллярные (ассоциативные) коллоиды Их образуют в-ва с дифильной природой (содержат как неполярные, так и полярные
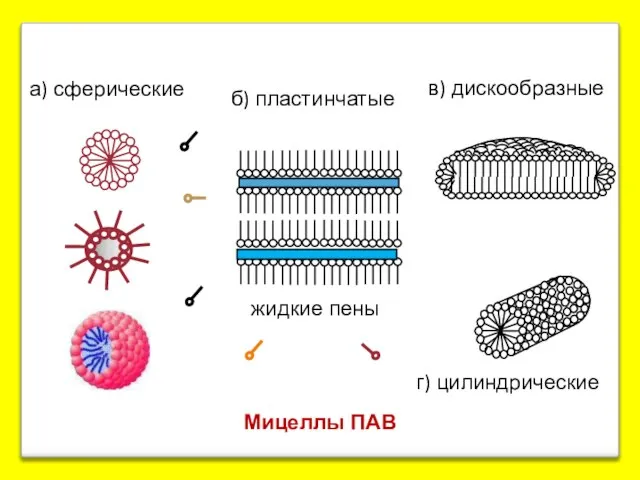
- 14. Мицеллы ПАВ а) сферические б) пластинчатые в) дискообразные г) цилиндрические жидкие пены
- 15. СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ оптические электрические молекулярно-кинетические реологические поверхностные явления
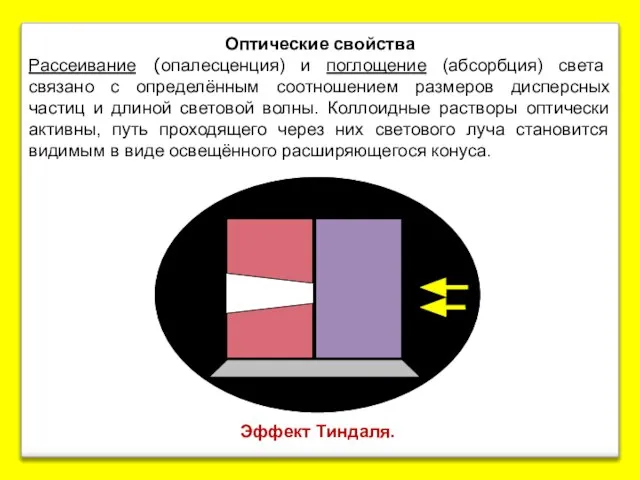
- 16. Эффект Тиндаля. Оптические свойства Рассеивание (опалесценция) и поглощение (абсорбция) света связано с определённым соотношением размеров дисперсных
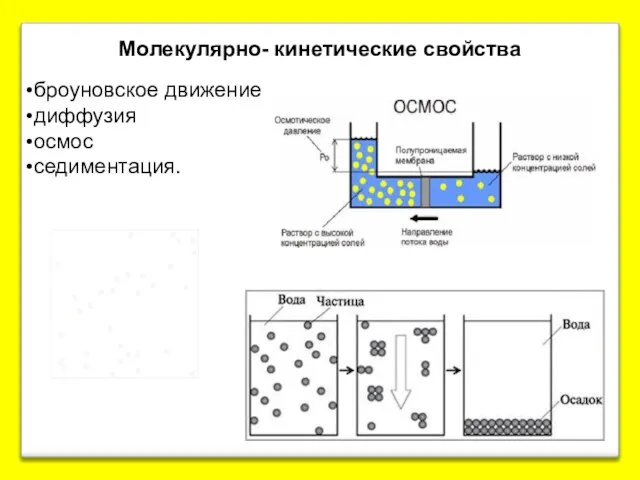
- 20. Молекулярно- кинетические свойства броуновское движение диффузия осмос седиментация.
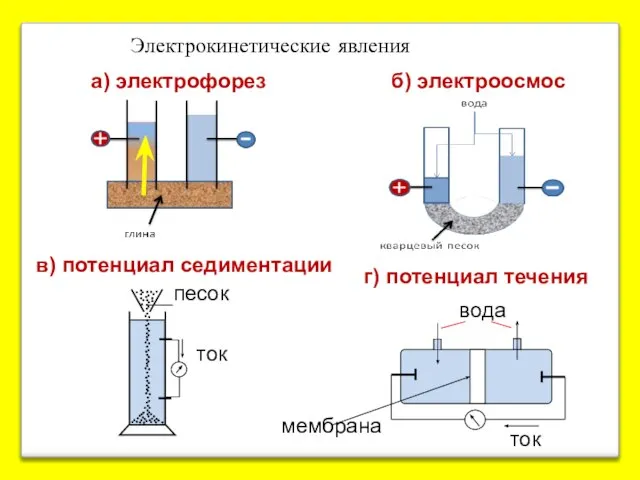
- 21. а) электрофорез б) электроосмос в) потенциал седиментации мембрана вода Электрокинетические явления
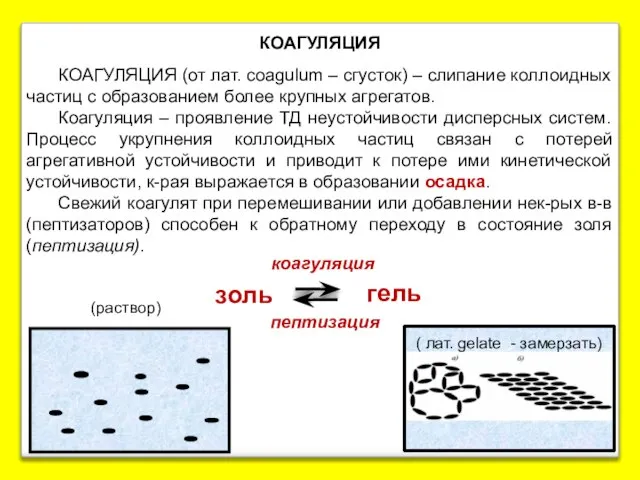
- 23. КОАГУЛЯЦИЯ КОАГУЛЯЦИЯ (от лат. coagulum – сгусток) – слипание коллоидных частиц с образованием более крупных агрегатов.
- 25. Коагуляцию вызывают: коагулянты (электролиты и неэл-ты), длительный диализ, электрофорез, повышение т-ры, действие света и др. ВЧ
- 27. Скачать презентацию













 Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно
Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно Едкость Coca-Cola
Едкость Coca-Cola Новые наноматериалы. Получение, свойства и применение
Новые наноматериалы. Получение, свойства и применение Кружок «Алхимия»
Кружок «Алхимия» Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук Натуральный и синтетический каучуки. Резина.
Натуральный и синтетический каучуки. Резина.  Роль химических элементов в жизнедеятельности организма
Роль химических элементов в жизнедеятельности организма Сплавы серебра
Сплавы серебра Почвоведение. Введение
Почвоведение. Введение Электроды 1 рода
Электроды 1 рода Вакуумное фильтрование
Вакуумное фильтрование Радиоматериалы и радиокомпоненты. Зонная теория
Радиоматериалы и радиокомпоненты. Зонная теория Аминокислоты ароматического ряда и их производные
Аминокислоты ароматического ряда и их производные Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии
Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии Моделирование (7 класс)
Моделирование (7 класс) Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Типы химических реакций. Реакция соединения
Типы химических реакций. Реакция соединения Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно
Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно Общие свойства живых организмов
Общие свойства живых организмов Биохимия. Ферменты (Лекция№2)
Биохимия. Ферменты (Лекция№2) Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно
Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно Acids and alkalis
Acids and alkalis Тақырып. Ароматик көмірсутектер
Тақырып. Ароматик көмірсутектер Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар
Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Вакуумная перегонка мазута
Вакуумная перегонка мазута Названия алканов
Названия алканов "Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.
"Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.