Содержание
- 2. Химическое равновесие - состояние системы, при котором прямая и обратная реакции протекают с одинаковыми скоростями, и
- 3. В момент равенства скоростей прямой и обратной реакций суммарная скорость процесса в целом близка к нулю,
- 8. Уравнение изотермы химической реакции
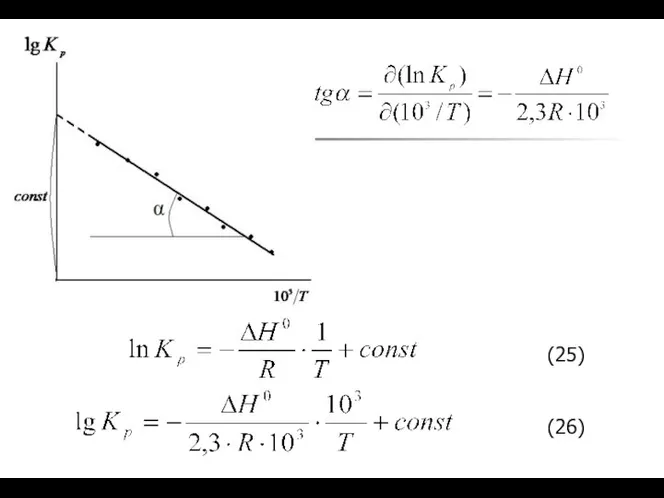
- 11. Зависимость константы равновесия от температуры. Уравнения изобары и изохоры химической реакции.
- 13. Интегрирование уравнения изобары (изохоры)
- 14. Интегрирование уравнения изобары
- 16. Уравнения изобары и изохоры как количественная интерпретация принципа Ле Шателье – Брауна.
- 17. РАСЧЕТ СОСТАВА РАВНОВЕСНОЙ РЕАКЦИОННОЙ СМЕСИ И РАВНОВЕСНОГО ВЫХОДА ПРОДУКТА
- 18. Расчет состава равновесной смеси для гомогенной реакции, протекающей в газовой фазе (∆n = 0).
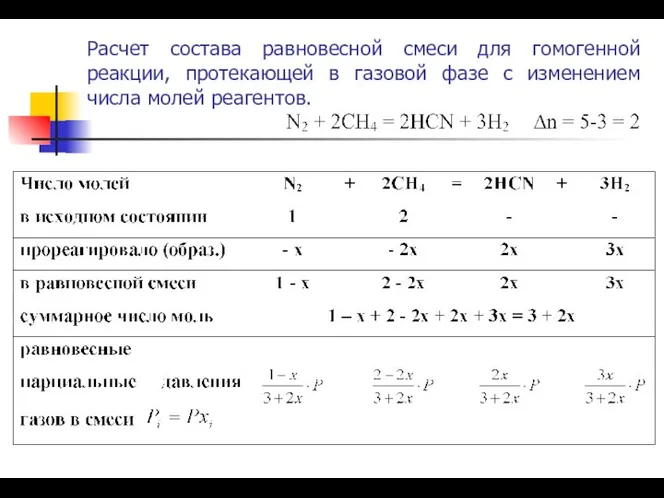
- 20. Расчет состава равновесной смеси для гомогенной реакции, протекающей в газовой фазе с изменением числа молей реагентов.
- 23. Скачать презентацию


















 Сложные реакции
Сложные реакции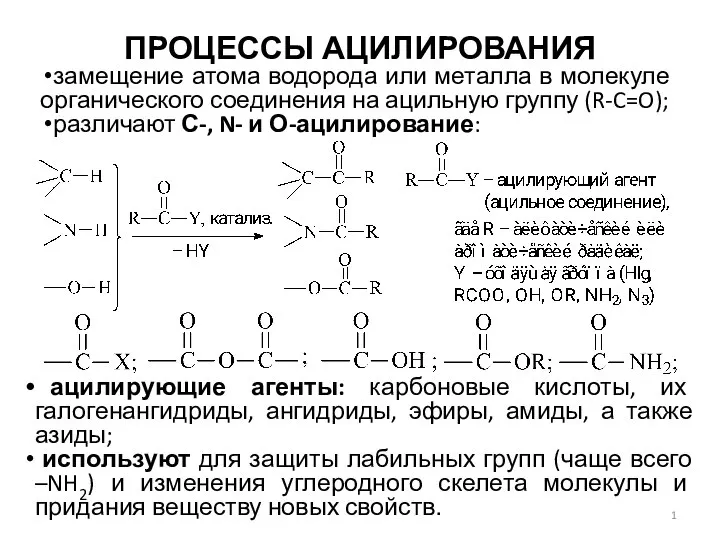 Процессы ацилирования
Процессы ацилирования Микробиологическая лаборатория и ее задачи. Микроскоп и работа с ним. Морфология шаровидных бактерий
Микробиологическая лаборатория и ее задачи. Микроскоп и работа с ним. Морфология шаровидных бактерий Требование к оформлению отчета лабораторной работы
Требование к оформлению отчета лабораторной работы Амиды кислот. Азо- и диазосоединения
Амиды кислот. Азо- и диазосоединения Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Природные источники углеводородов
Природные источники углеводородов Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Исследовательская работа на тему: Удивительные свойства воды
Исследовательская работа на тему: Удивительные свойства воды Подготовлено ученицей 9 "А" класса Михневской СОШ Темновой Яной.
Подготовлено ученицей 9 "А" класса Михневской СОШ Темновой Яной. Оксиды. Оксиды металлов и оксиды неметаллов
Оксиды. Оксиды металлов и оксиды неметаллов Базовое нефтехимическое сырье. Технология каткрекинга
Базовое нефтехимическое сырье. Технология каткрекинга Эксперимент «Осадки и растворы», 8 класс
Эксперимент «Осадки и растворы», 8 класс Будівельні матеріали: скло, цемент, бетон, їх використання Виконала Учениця 10-А класу ЗОШ 1-3 ст. №1 Кулібаба Яна
Будівельні матеріали: скло, цемент, бетон, їх використання Виконала Учениця 10-А класу ЗОШ 1-3 ст. №1 Кулібаба Яна  Автоматизированное управление химико-технологическими процессами
Автоматизированное управление химико-технологическими процессами Жидкостная хроматография
Жидкостная хроматография Генетические ряды М и НеМ
Генетические ряды М и НеМ Путешествие в страну Металлию Обобщающий урок в 9 классе по теме «Металлы» Составила Будаева Л.Н.
Путешествие в страну Металлию Обобщающий урок в 9 классе по теме «Металлы» Составила Будаева Л.Н. Нефть и способы её переработки
Нефть и способы её переработки Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Харчові добавки. Е-числа
Харчові добавки. Е-числа  Полимеры. Химический состав
Полимеры. Химический состав Синтез и химические модификации индиго
Синтез и химические модификации индиго Система подготовки учащихся к ЕГЭ по химии
Система подготовки учащихся к ЕГЭ по химии Кислоты
Кислоты Презентация по Химии "Застосування скла" - скачать смотреть бесплатно
Презентация по Химии "Застосування скла" - скачать смотреть бесплатно Физические свойства минералов
Физические свойства минералов Номенклатура органических соединений. Строение атома углерода. Изомерия
Номенклатура органических соединений. Строение атома углерода. Изомерия