Содержание
- 2. Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И
- 3. Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику
- 4. Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током. Цель урока: изучить сущность и применение
- 5. Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав
- 6. Электролиз План Электролиз расплава. Электролиз раствора. Сущность электролиза. Применение. Выводы.
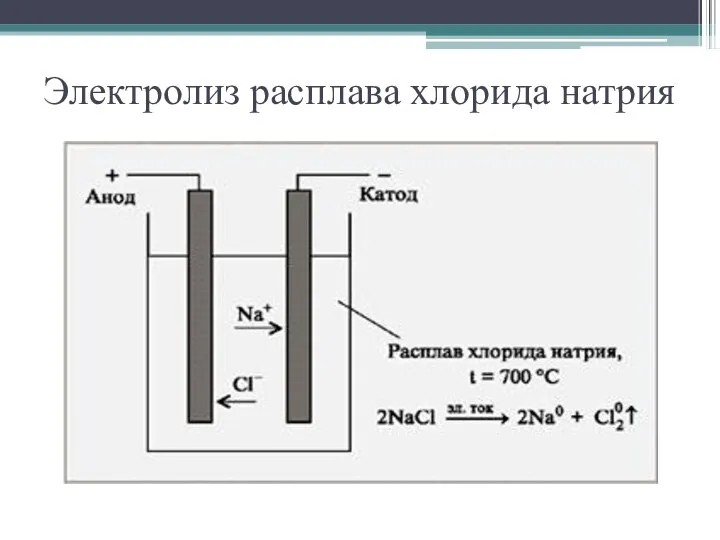
- 7. Электролиз расплава хлорида натрия
- 8. Электролиз является окислительно – - восстановительным процессом: на катоде всегда идёт процесс восстановления, на аноде всегда
- 9. Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала
- 10. Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный
- 11. Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H2О Расплав NaCl Катод(-) Анод(+) Na+ +
- 12. Работа с учебником (стр. 109-110) Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный
- 13. Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может
- 14. Внимательно наблюдайте за результатами электролиза сульфата меди. 1. Запишите катодный и анодный процессы, суммарное уравнение процесса.
- 15. Проверь себя! CuSO4 → Cu2+ + SO42- H2O Катод (-) Cu2+ SO42- Анод (+) Cu2+ +
- 16. Посмотрев видеофрагмент процесса электролиза иодида калия, ответьте на вопросы: 1. Какие продукты образовались на катоде и
- 17. Электролиз раствора иодида калия
- 18. Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение
- 19. Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
- 20. Применение электролиза Процесс очищения предметов электролизом Результат процесса
- 21. Установите правильную последовательность. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах
- 22. Ответьте на вопросы. 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы
- 23. Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если нет, то минус. 1. Я узнал
- 24. Домашнее задание Записи в тетради. Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр.
- 26. Скачать презентацию





















 Алкалоїди. Поняття «алкалоїди» і їх функції
Алкалоїди. Поняття «алкалоїди» і їх функції Презентация Простые вещества Металлы
Презентация Простые вещества Металлы  Водород. Генри Кавендиш
Водород. Генри Кавендиш Кислоты, их состав и названия
Кислоты, их состав и названия Комплексные соединения
Комплексные соединения Химическая связь
Химическая связь Ртуть
Ртуть ЕГО ВЕЛИЧЕСТВО ЖЕЛЕЗО
ЕГО ВЕЛИЧЕСТВО ЖЕЛЕЗО Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия"
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия" Фазовые диаграммы с протеканием 3-фазных реакций
Фазовые диаграммы с протеканием 3-фазных реакций Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Теория Опарина
Теория Опарина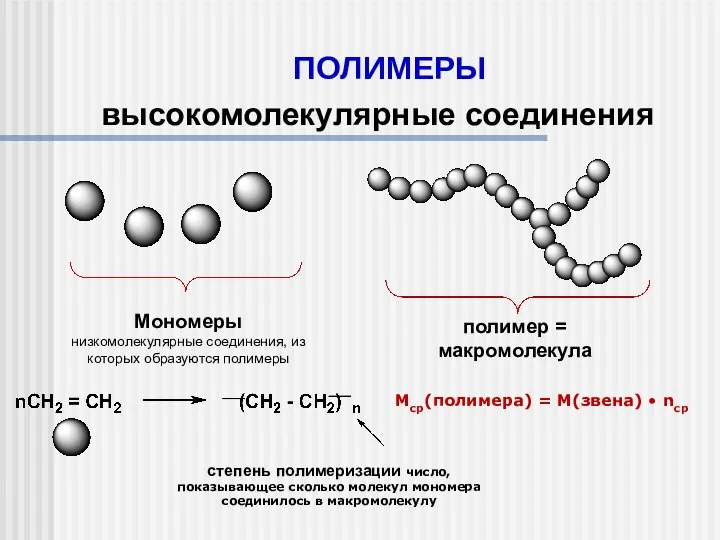 Полимеры. Высокомолекулярные соединения
Полимеры. Высокомолекулярные соединения Практическая работа № 3. Получение, собирание и распознавание газов
Практическая работа № 3. Получение, собирание и распознавание газов Мысты электролитті тазалау
Мысты электролитті тазалау Ресурсы и энергоснабжение
Ресурсы и энергоснабжение Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Химические явления. Уравнения химических реакций
Химические явления. Уравнения химических реакций Химия в профессиях
Химия в профессиях Общие сведения о металлах и сплавах
Общие сведения о металлах и сплавах урок
урок Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Уксусная кислота (эта́новая кислота)
Уксусная кислота (эта́новая кислота) Хімічна дія світла Підготував учень 7-Б класу, Лагода Віталій
Хімічна дія світла Підготував учень 7-Б класу, Лагода Віталій 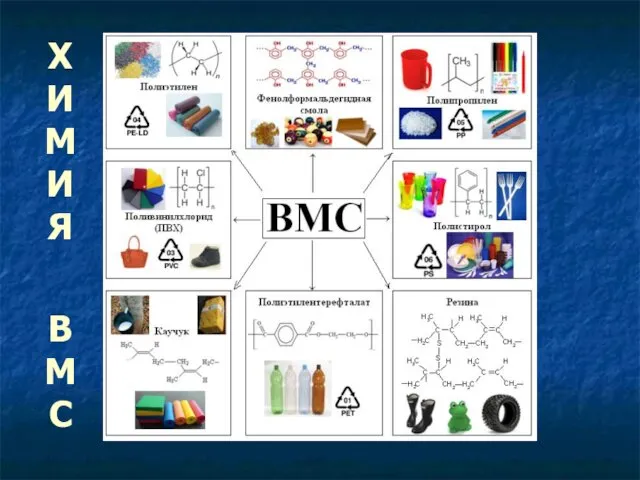 Химия высокомолекулярных соединений (ВМС)
Химия высокомолекулярных соединений (ВМС) ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ
ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ  Состав вещества
Состав вещества Горение топлива
Горение топлива