Содержание
- 2. Под электрорадиоматериалами понимают применяемые в радиоэлектронике материалы, у которых первостепенное значение имеют их свойства и характеристики
- 3. По поведению в электрическом поле эти материалы подразделяют на - проводниковые, - полупроводниковые и диэлектрические, по
- 4. ОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ ВЕЩЕСТВА 1.1. ВИДЫ СВЯЗИ
- 5. Атом представляет собой систему, состоящую из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны.
- 6. Электроны притягиваются к ядру и отталкиваются друг от друга. Расположенные ближе к ядру электроны подвержены большему
- 7. Внешние электроны могут отрываться от одного атома и присоединяться к другому атому, изменяя число его внешних
- 8. У разных веществ атомы содержат разное число валентных электронов. Атом, потерявший один или несколько электронов, становится
- 9. Образовавшиеся таким образом положительные и отрицательные частицы называются ионами. Из атомов строятся молекулы. Связи, благодаря которым
- 10. Способность атомов вступать в соединения с атомами других веществ и образовывать молекулы определяет химические свойства вещества.
- 11. Ковалентные связи возникают между атомами за счет образования устойчивых пар валентных электронов разных атомов (рис. 1.1).
- 12. Эти пары являются общими для атомов, которые входят в молекулу. Если двухатомная молекула состоит из атомов
- 13. В неполярных молекулах центры положительных и отрицательных зарядов совпадают. Если двухатомная молекула состоит из атомов различных
- 14. В этом случае ковалентную связь называют полярной, а молекулы с полярной связью, у которых центры положительных
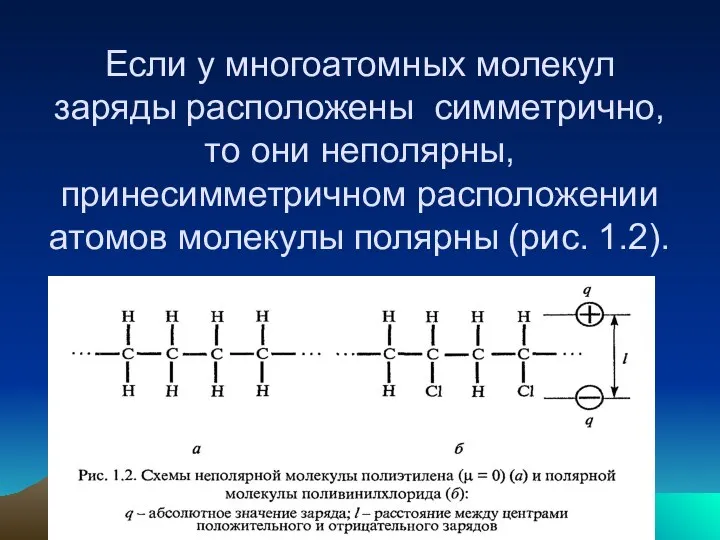
- 15. Если у многоатомных молекул заряды расположены симметрично, то они неполярны, принесимметричном расположении атомов молекулы полярны (рис.
- 16. Разновидностью ковалентной связи является донорно-акцепторная связь, которая возникает между атомом, способным отдать электрон (донор), и атомом,
- 17. Ионные связи обусловлены силами электростатического притяжения между положительными и отрицательными ионами. Молекулы вещества с полярной связью
- 18. Соединения с ионной связью обладают разными свойствами, которые характерны для типичных металлов и неметаллов. Такие связи
- 19. Ионные связи менее прочны, чем ковалентные, поэтому соединения, образованные ионной связью, уступают веществам с ковалентной связью
- 20. Металлические связи образуются в металлах и обусловлены особенностями поведения внешних (валентных) электронов. Атомы металлов обладают способностью
- 21. Внешние электроны, которые покидают атомы, становясь свободными, называются коллективизированными. В результате металл представляет собой систему, состоящую
- 22. В этой системе одновременно имеют место притяжение между ионами и свободными электронами и ковалентная связь между
- 23. Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью. Металлическая связь в отличие от ковалентной
- 24. Молекулярные связи образуются между отдельными молекулами в результате электростатического притяжения между зарядами противоположных знаков, которые имеются
- 25. Особым видом молекулярной связи является водородная связь, которая образуется через ион водорода (протон), расположенный между двумя
- 26. В твердых веществах атомы и молекулы располагаются в строгом порядке и хаотично. Вещества с закономерным упорядоченным
- 27. 1.2. КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА К кристаллическим веществам относятся все металлы и металлические сплавы. Кристалл состоит из множества
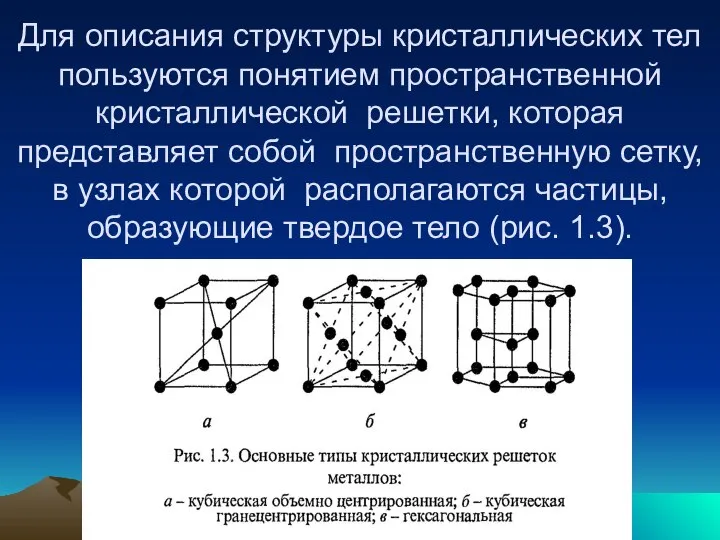
- 28. Для описания структуры кристаллических тел пользуются понятием пространственной кристаллической решетки, которая представляет собой пространственную сетку, в
- 29. В узлах ковалентных (атомных) решеток находятся нейтральные атомы, которые связаны друг с другом ковалентной связью. В
- 30. В узлах металлических решеток расположены положительные ионы, в промежутках между которыми находятся свободные электроны. Они образуют
- 31. Простейшим типом элементарной кристаллической ячейки является простая кубическая решетка. Размеры кристаллической решетки характеризуются ее параметрами. Под
- 32. Эти расстояния очень малы и их измеряют в нанометрах или ангстремах AА = 10~10 м). Параметр
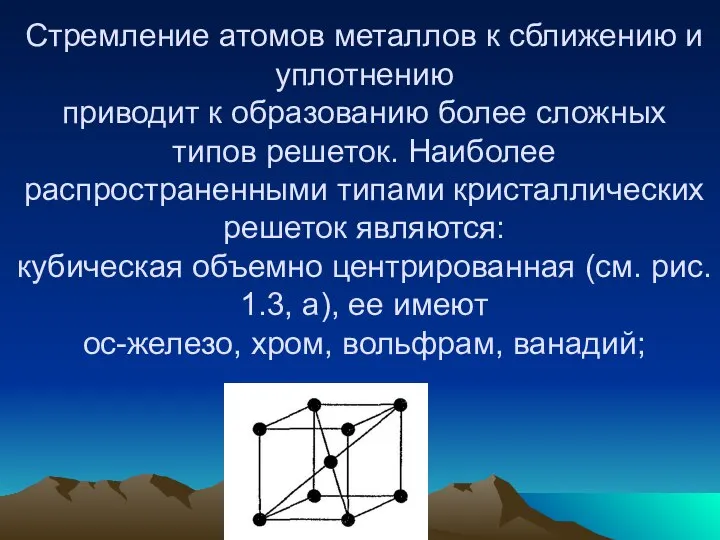
- 33. Стремление атомов металлов к сближению и уплотнению приводит к образованию более сложных типов решеток. Наиболее распространенными
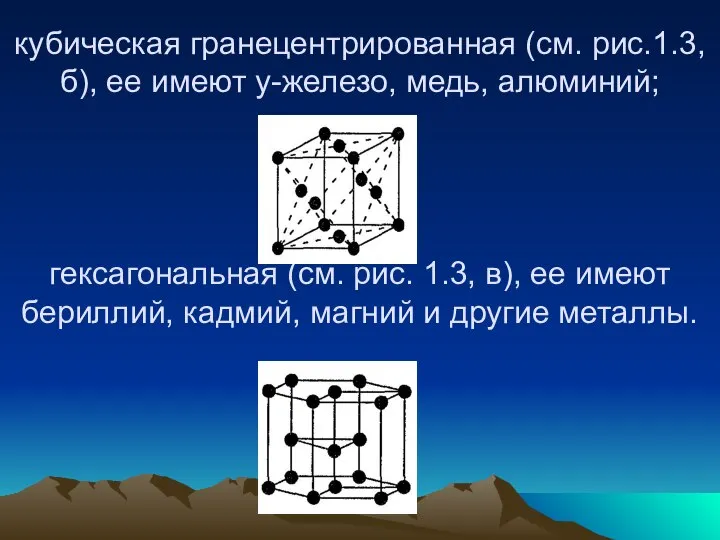
- 34. кубическая гранецентрированная (см. рис.1.3, б), ее имеют у-железо, медь, алюминий; гексагональная (см. рис. 1.3, в), ее
- 35. Наиболее плотно и компактно размещены атомы гексагональной и кубической гранецентрированной решеток. Упорядоченное расположение атомов в кристаллах
- 36. Изменение свойств кристаллов (металлов) в зависимости от направления называют анизотропией. Степень анизотропности свойств металлов может быть
- 37. Учитывая анизотропию свойств кристаллов в разных направлениях, применяют количественную индексацию плоскостей и направлений в кристаллических решетках
- 38. Плоскость I (рис. 1.5, а) отсекает от оси X отрезок, равный длине n ребра куба, и
- 40. Все кристаллические вещества при нагревании сохраняют твердое состояние до определенной температуры. Атомы, находящиеся в узлах кристаллической
- 41. При достижении определенной температуры амплитуда колебаний атомов настолько увеличивается, что происходит разрушение кристаллической решетки. Атомы переходят
- 42. Обратный переход кристаллических веществ из жидкого состояния в твердое называется кристаллизацией. Температура, при которой происходит фазовое
- 43. Строение металлов, когда атомы образуют геометрически правильную кристаллическую структуру, может быть только в идеальном случае. В
- 44. Основными дефектами кристаллических решеток являются точечные, линейные, поверхностные и объемные (трехмерные) несовершенства.
- 45. Точечные несовершенства появляются в результате образования вакансий (атомных дырок) или внедрения атомов в междуузлие (рис. 1.6).
- 46. Большинство атомов в данной кристаллической решетке обладает одинаковой средней энергией, поэтому амплитуда их колебаний при данной
- 47. Такие атомы могут перемещаться из одного места в другое и выходить из узла в междуузлие. Атомы,
- 48. Причинами точечных несовершенств являются условия кристаллизации, наличие примесей в металлах и сплавах, неравномерное распределение энергии между
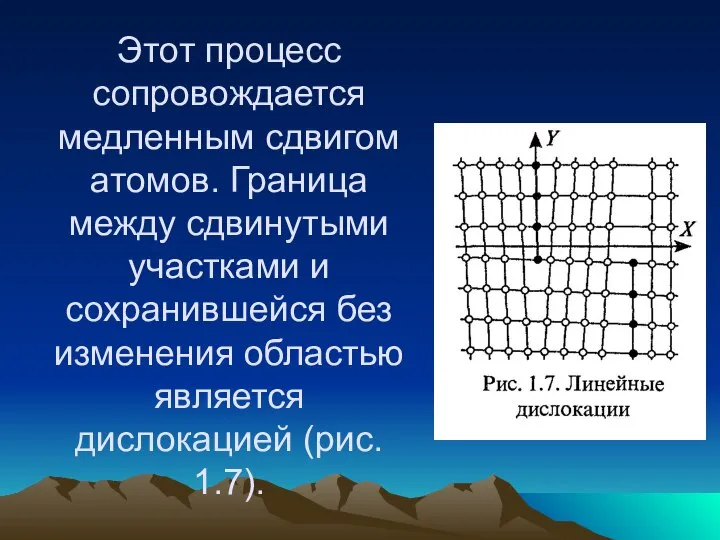
- 49. Линейные несовершенства представляют собой изменения структуры, протяженность которых в одном измерении гораздо больше, чем в двух
- 50. Этот процесс сопровождается медленным сдвигом атомов. Граница между сдвинутыми участками и сохранившейся без изменения областью является
- 51. Дислокации бывают краевыми, винтовыми и смешанными. Поверхностные несовершенства характеризуются значительными изменениями в двух измерениях. Примером поверхностного
- 52. Кристалл состоит из блоков, которые по-разному ориентируются в пределах этого кристалла, образуя мозаичную структуру. На границах
- 53. Объемные несовершенства кристалла имеют существенные размеры во всех трех измерениях. К объемным дефектам относятся пустоты, включения
- 54. По структуре кристаллические материалы бывают монокристаллическими и поликристаллическими. Монокристаллические материалы - это однородные анизотропные тела, у
- 55. Поликристаллические материалы состоят из большого числа сросшихся между собой мелких кристаллических зерен (кристаллитов), которые хаотически ориентированы
- 57. Скачать презентацию

















































 Презентация по Химии "Путешествие по стране карбонатов" - скачать смотреть
Презентация по Химии "Путешествие по стране карбонатов" - скачать смотреть  Каталитический крекинг
Каталитический крекинг Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Аміни
Аміни Витамины. Классификация витаминов
Витамины. Классификация витаминов Узинская ООШ исслед.работа Лобановой Елизаветы
Узинская ООШ исслед.работа Лобановой Елизаветы Адренергические средства
Адренергические средства Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии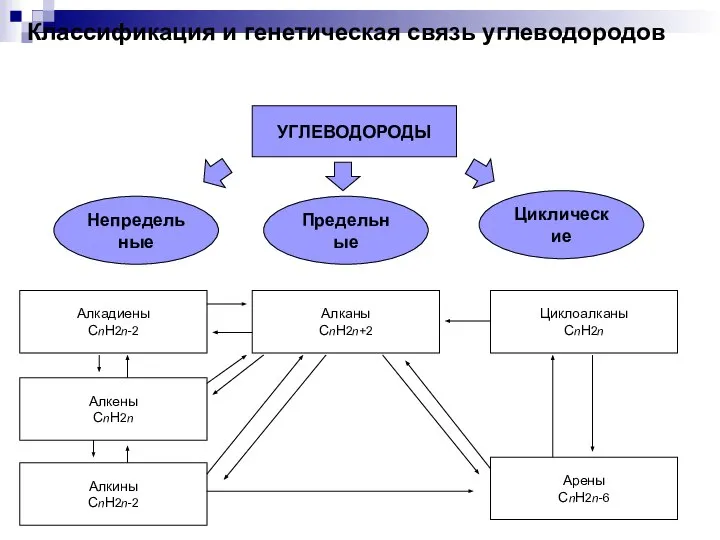 Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Презентация Стекло, история открытия
Презентация Стекло, история открытия Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж
Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж Радиоуглеродный метод
Радиоуглеродный метод Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно
Презентация по Химии "Синтетичні мийні засоби" - скачать смотреть бесплатно Хімія в побуті. Загальні правила поводження з побутовими хімікатами
Хімія в побуті. Загальні правила поводження з побутовими хімікатами Жиры и мыло
Жиры и мыло Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Состав и свойства помидоров
Состав и свойства помидоров Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ НЕМЕТАЛЛЫ АЗОТ
НЕМЕТАЛЛЫ АЗОТ 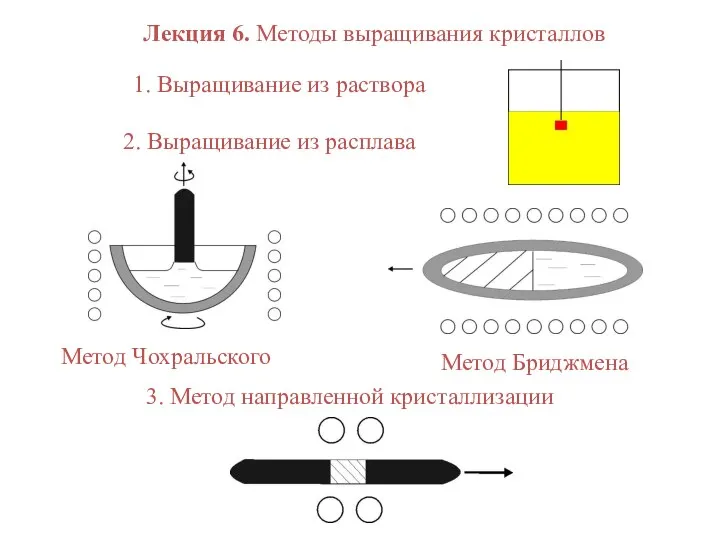 Методы выращивания кристаллов
Методы выращивания кристаллов History of radioactivity
History of radioactivity Предмет химии. Вещества
Предмет химии. Вещества Основні класи неорганічних сполук
Основні класи неорганічних сполук Разноцветные кристаллы
Разноцветные кристаллы Аттестационная работа. Задачи на смеси и сплавы
Аттестационная работа. Задачи на смеси и сплавы Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у
Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у Качественный химический анализ воды на определение металлов
Качественный химический анализ воды на определение металлов