Содержание
- 2. Кроссворд 4 А Й Ы Л С И К Е Л Г У 1 5 З
- 3. Маршрутный лист ИНФОРМАЦИОННАЯ ЭКСПЕРИМЕНТАЛЬНАЯ БИОЛОГО - ГЕОГРАФИЧЕСКАЯ ПРАКТИЧЕСКАЯ КОНЕЧНАЯ
- 4. СТАНЦИЯ ИНФОРМАЦИОННАЯ
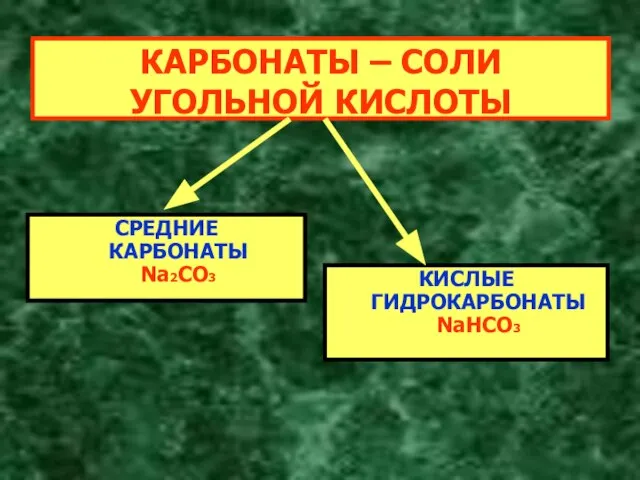
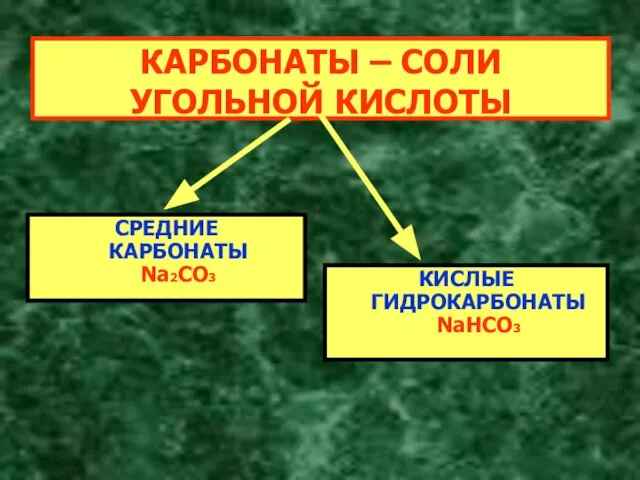
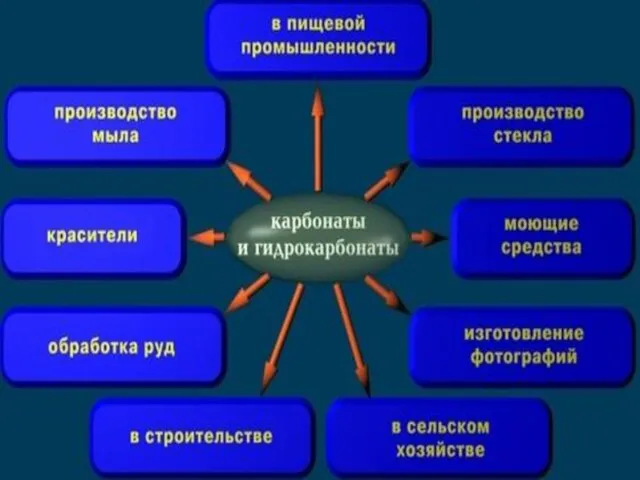
- 5. КАРБОНАТЫ – СОЛИ УГОЛЬНОЙ КИСЛОТЫ СРЕДНИЕ КАРБОНАТЫ Na2CO3 КИСЛЫЕ ГИДРОКАРБОНАТЫ NaHCO3
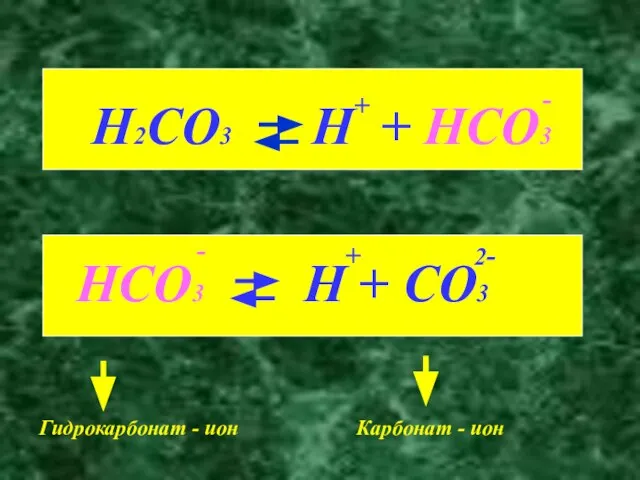
- 6. Гидрокарбонат - ион Карбонат - ион
- 7. КАРБОНАТЫ – СОЛИ УГОЛЬНОЙ КИСЛОТЫ СРЕДНИЕ КАРБОНАТЫ Na2CO3 КИСЛЫЕ ГИДРОКАРБОНАТЫ NaHCO3
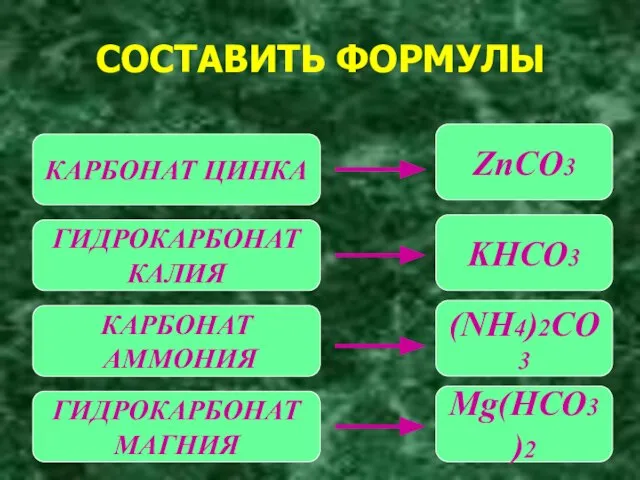
- 8. СОСТАВИТЬ ФОРМУЛЫ КАРБОНАТ ЦИНКА ГИДРОКАРБОНАТ КАЛИЯ КАРБОНАТ АММОНИЯ ГИДРОКАРБОНАТ МАГНИЯ ZnCO3 KHCO3 (NH4)2CO3 Mg(HCO3)2
- 9. СТАНЦИЯ ЭКСПЕРИМЕНТАЛЬНАЯ
- 10. Взаимодействие с сильными кислотами CaCO3+2HCl = CaCl2 +H2O+CO2 Качественные реакции
- 11. Ca(OH)2+CO2 CaCO3 +H2O CaCO3+CO2+H2O Ca(HCO3)2
- 12. Превращение гидрокарбонатов в карбонаты а) при нагревании 2NaHCO3 Na2CO3 + H2O+CO2 б) при действии щёлочи NaHCO3
- 13. Na2 CO3+BaCl2 BaCO3 +2NaCl Взаимодействие с растворами солей Разложение карбонатов MgCO3 MgO + CO2
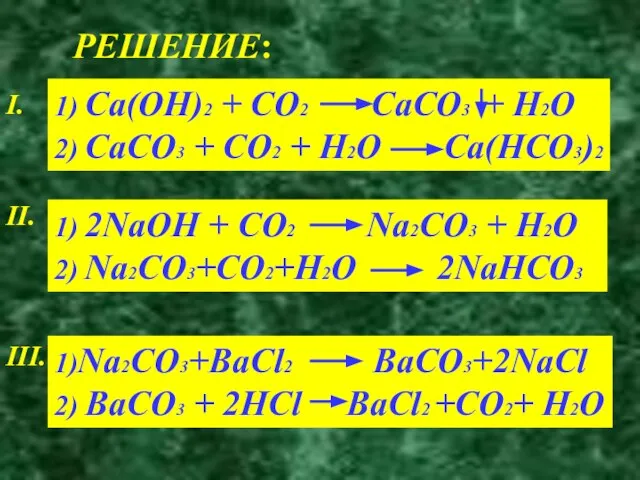
- 14. ОСУЩЕСТВИТЕ ПРЕВРАЩЕНИЕ I. Ca(OH)2 CaCO3 Ca(HCO3)2 II. NaOH Na2CO3 NaHCO3 III. Na2CO3 BaCO3 CO2
- 15. РЕШЕНИЕ: I. 1) Ca(OH)2 + CO2 CaCO3 + H2O 2) CaCO3 + CO2 + H2O Ca(HCO3)2
- 16. СТАНЦИЯ БИОЛОГО - ГЕОГРАФИЧЕСКАЯ 1,7% земной коры – карбонатные породы
- 17. КОРАЛЛОВЫЕ ПОЛИПЫ – CaCO3
- 18. CaCO3+CO2+H2O Ca(HCO3)2 Ca(HCO3)2 CaCO3 + H2O +CO2
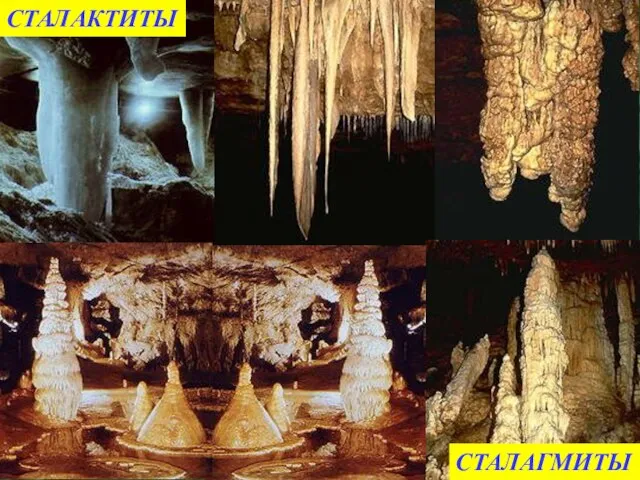
- 19. СТАЛАКТИТЫ СТАЛАГМИТЫ
- 20. СТАНЦИЯ ПРАКТИЧЕСКАЯ
- 21. ИЗВЕСТНЯК – CaCO3
- 22. МРАМОР – CaCO3
- 23. МРАМОРНЫЙ ДВОРЕЦ
- 24. Na HCO3 – ПИТЬЕВАЯ СОДА NaHCO3 + HCl = NaCl + CO2 + H2O
- 26. СТАНЦИЯ КОНЕЧНАЯ
- 27. 1)Какие три брата из семейства карбонатов живут на Земле? Мрамор, известняк, мел. 2) Зачем хозяйки добавляют
- 28. 3) Что такое сталактиты? Каменные сосульки в пещерах состоящие из карбоната кальция. 4) Как химическим путем
- 29. 5) Как еще называют гидрокарбонат натрия (NaHCO3)? Питьевая сода. 6) Как вы посоветуете геологам в полевых
- 31. Скачать презентацию


















 Метанол: получение и применение
Метанол: получение и применение Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Тема урока: Природный каучук.
Тема урока: Природный каучук. Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Явище ізомерії. Структурна ізомерія. Близнюки органічного світу
Явище ізомерії. Структурна ізомерія. Близнюки органічного світу Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Бирюза. Характеристики минерала
Бирюза. Характеристики минерала Щелочные металлы
Щелочные металлы Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян
Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Основы кристаллического строения металлов
Основы кристаллического строения металлов Катаболизм пищевых и тканевых липидов. (Лекция 7)
Катаболизм пищевых и тканевых липидов. (Лекция 7) Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот Железо как химический элемент
Железо как химический элемент Галогены. Хлороводород, соляная кислота и хлориды. Биологическая роль йода в жизнедеятельности человека
Галогены. Хлороводород, соляная кислота и хлориды. Биологическая роль йода в жизнедеятельности человека Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Минерал турмалин
Минерал турмалин 1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум
1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум Колообіг нітрогену в природі
Колообіг нітрогену в природі Химические свойства кислорода. Применение кислорода
Химические свойства кислорода. Применение кислорода Олигонуклеотидный синтез
Олигонуклеотидный синтез Тұндыру әдістері
Тұндыру әдістері Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Минеральные вещества
Минеральные вещества Презентация по Химии "Химические тайны запаха" - скачать смотреть
Презентация по Химии "Химические тайны запаха" - скачать смотреть