Содержание
- 2. Классификация реакций Все химические реакции можно разделить на 2 группы, в одних реакциях степень окисления атомов
- 3. Процесс отдачи электронов - окисление, сопровождается увеличением положительной степени окисления или уменьшением отрицательной. Процесс принятия электронов
- 4. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями.
- 5. Окислители это: простые вещества, атомы которых обладают большой величиной электроотрицательности. Это элементы VII, VI, V групп
- 6. Восстановители- это: Элементы I, II, III групп главных подгрупп. Например: Na, Zn, H2, Al. Сложные вещества,
- 7. Три типа окислительно-восстановительных реакций. - межмолекулярные, - внутримолекулярные, - диспропорционирования - В межмолекулярных ОВР элементы окислитель
- 8. происходят с изменением степени окисления разных атомов в одной и той же молекуле. Например: 2 КClO3
- 9. Реакции диспропорционирования протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента.
- 10. Влияние среды на характер протекания ОВР - ОВР могут протекать в различных средах: в кислой (избыток
- 11. Рассмотрим несколько примеров. 1. KMnO4 (перманганат калия) является сильным окислителем, в сильнокислой среде восстанавливается до ионов
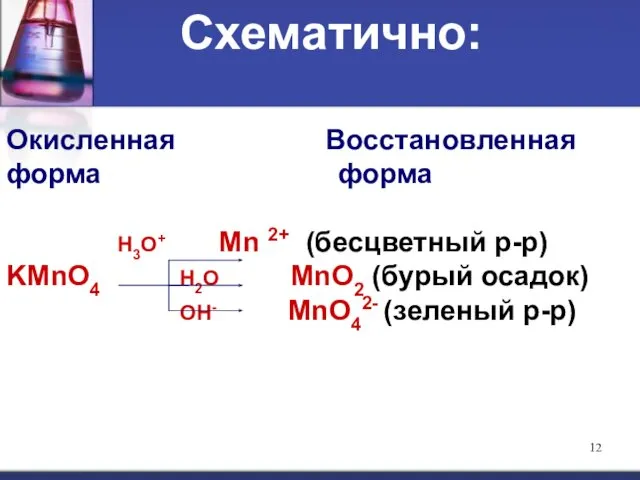
- 12. Окисленная Восстановленная форма форма Н3О+ Мn 2+ (бесцветный р-р) KMnO4 Н2О MnO2 (бурый осадок) ОН- МnО42-
- 13. Окислительно- восстановительная двойственность пероксида водорода Пероксид водорода как окислитель. Н – О Н + 2Н2О Н2О2
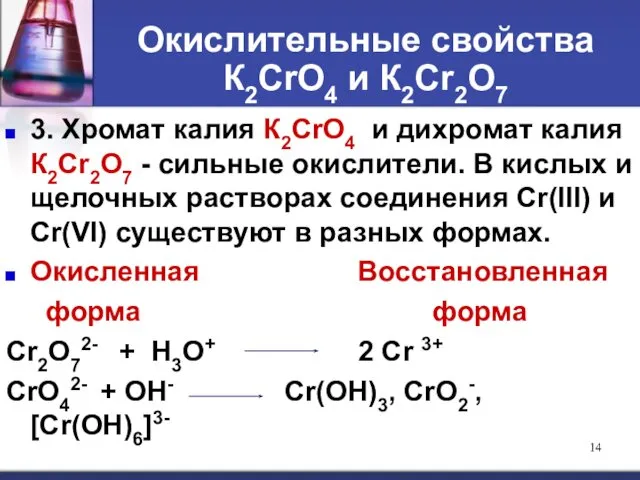
- 14. Окислительные свойства К2СrО4 и К2Сr2О7 3. Хромат калия К2СrО4 и дихромат калия К2Сr2О7 - сильные окислители.
- 15. К2Сr2О7
- 16. Метод электронно-ионного баланса (метод полуреакций). Реакции, протекающие в кислой среде. Правило: если реакция протекает в кислой
- 17. Пример 1. КМnO4 + Na2SO3 + H2SO4 = MnSO4 + K2SO4 + … ок вос среда
- 18. Пример 2. Na2Cr2O7 + KBr + H2SO4 = Cr2(SO4)3 + Br2 + … ок. вос. среда
- 19. Реакции, протекающие в щелочной среде. Правило: если реакция протекает в щелочной среде, то можно оперировать ионами
- 20. Пример 1. Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2 + … вос. ок. среда
- 21. Пример 2. КMnО4 +Na2SO3 + KOH = K2MnO4 + Na2SO4 + … ок. вос. среда Решение.
- 22. Реакции, протекающие в нейтральной среде. Правило: если реакция протекает в нейтральной среде, следует оперировать только молекулами
- 23. Пример 1. KMnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + … ок. вос. Решение.
- 24. Пример 2. MnSO4 + KMnO4 + H2O = MnO2 + K2SO4 + … вос. ок. среда
- 25. Теория возникновения равновесных электродных и окислительно-восстановительных потенциалов Определение направления окислительно-восстановительного процесса
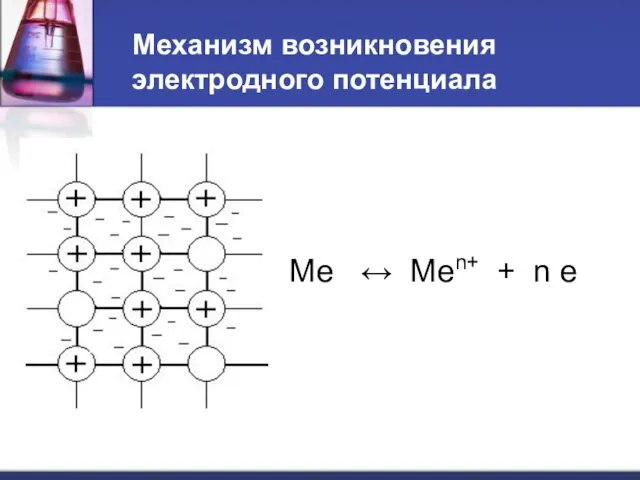
- 26. Механизм возникновения электродного потенциала Ме ↔ Меn+ + n e
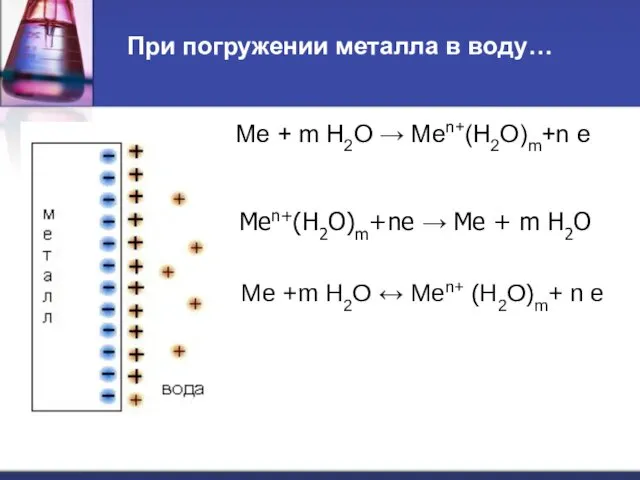
- 27. При погружении металла в воду… Ме + m Н2О → Меn+(Н2О)m+n e Ме +m Н2О ↔
- 28. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
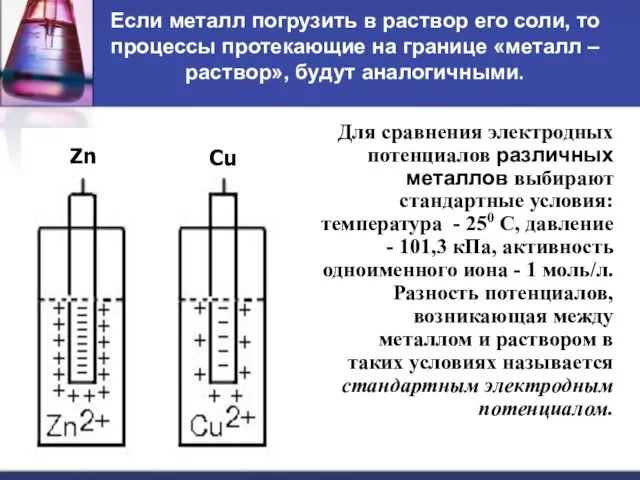
- 29. Если металл погрузить в раствор его соли, то процессы протекающие на границе «металл – раствор», будут
- 30. Стандартный электродный потенциал
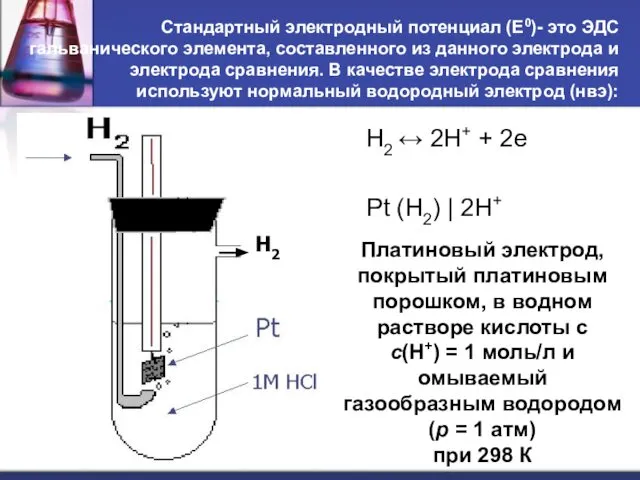
- 31. Стандартный электродный потенциал (Е0)- это ЭДС гальванического элемента, составленного из данного электрода и электрода сравнения. В
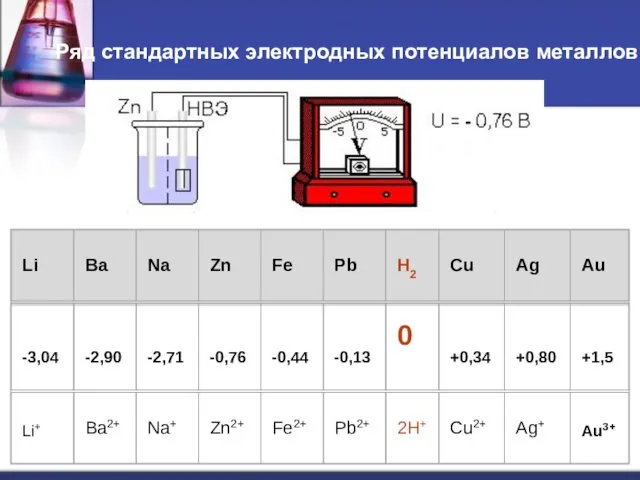
- 32. Ряд стандартных электродных потенциалов металлов
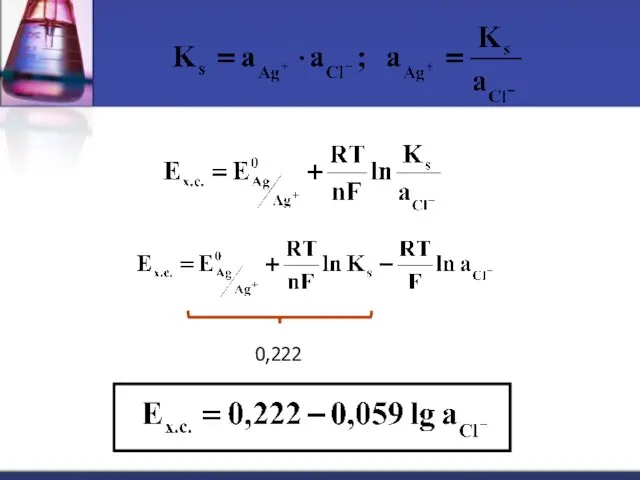
- 33. Величина потенциала в реальных условиях рассчитывается по уравнению Нернста:
- 35. Если известен потенциал водородного электрода, можно рассчитать рН раствора:
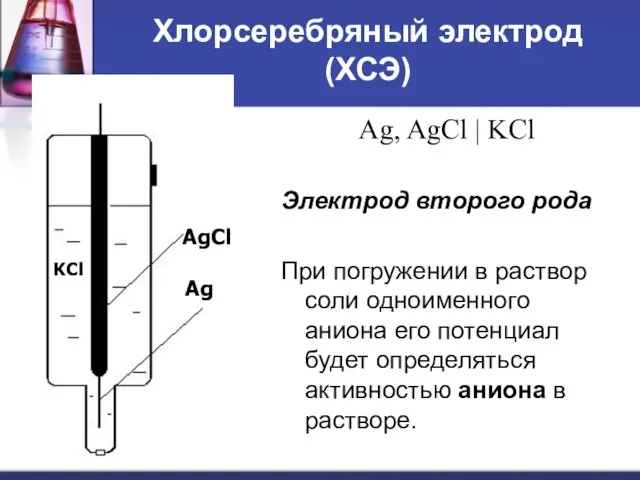
- 36. Хлорсеребряный электрод (ХСЭ) Ag, AgCl | KCl Электрод второго рода При погружении в раствор соли одноименного
- 37. Ag ↔ Ag+ + e (1) AgCl ↔ Ag+ + Cl- (2) KCl → K+ +
- 38. 0,222
- 39. ↑[Cl-] → ↓[Ag+] → ↓E х.с. Значение потенциала хлорсеребряного электрода при разных концентрациях водного раствора KCl
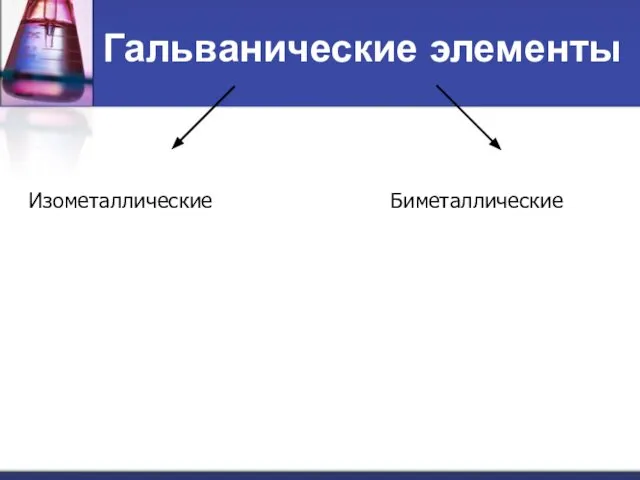
- 40. Гальванические элементы Изометаллические Биметаллические
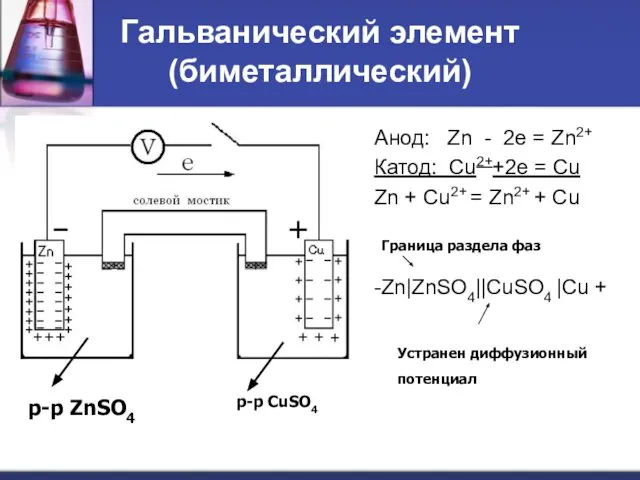
- 41. Гальванический элемент (биметаллический) Анод: Zn - 2e = Zn2+ Катод: Cu2++2e = Cu Zn + Cu2+
- 42. Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
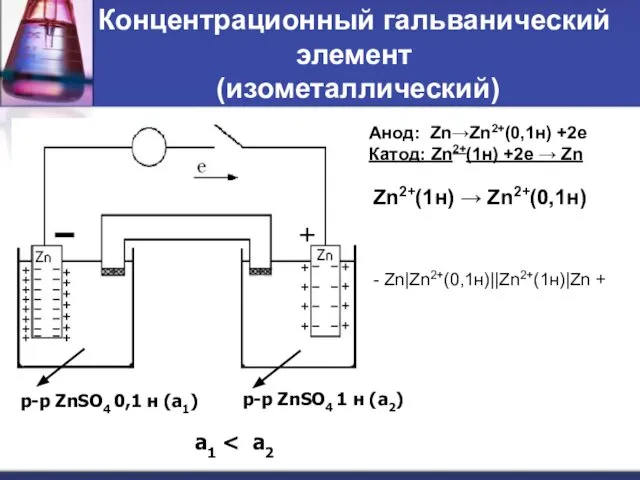
- 43. Концентрационный гальванический элемент (изометаллический) Анод: Zn→Zn2+(0,1н) +2e Катод: Zn2+(1н) +2e → Zn Zn2+(1н) → Zn2+(0,1н) -
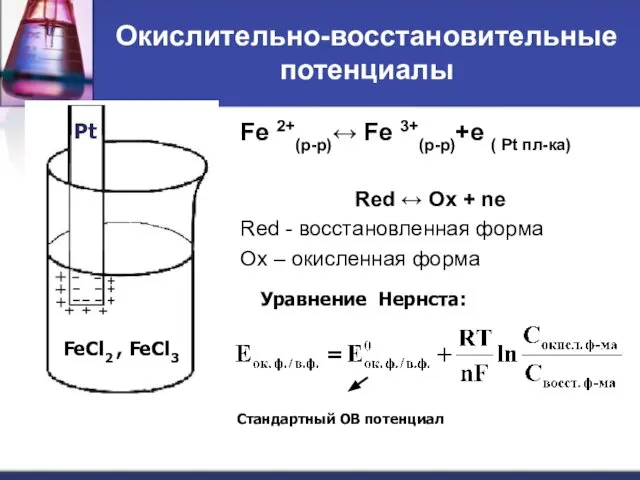
- 45. Окислительно-восстановительные потенциалы Fe 2+(р-р)↔ Fe 3+(р-р)+е ( Pt пл-ка) Red ↔ Ox + ne Red -
- 46. Вальтер Фридрих Герман Нернст (1864-1941)
- 47. ОВ потенциал зависит от: температуры природы окислителя и восстановителя концентрации окисленной и восстановленной форм рН среды
- 48. Стандартный ОВ потенциал ЭДС ГЭ, составленного из окислительно-восстановительной системы, содержащей окисленную и восстановленную формы в концентрациях
- 49. Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+, то стандартный ОВ потенциал = +1,51 В. MnO4- +
- 50. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению Нернста:
- 51. Чем больше стандартный ОВ потенциал системы, тем в большей степени выражены ее окислительные свойства в стандартных
- 52. Критерии самопроизвольного протекания ОВ реакций
- 53. Пример:
- 54. Глубина протекания ОВ реакций
- 55. Окислительно-восстановительные ГЭ
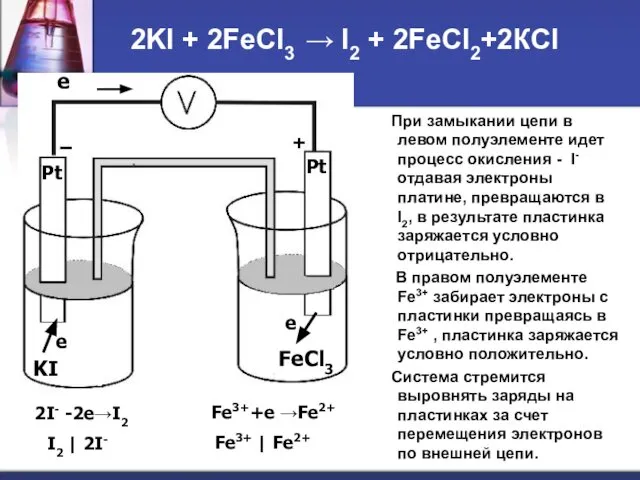
- 56. 2KI + 2FeCl3 → I2 + 2FeCl2+2КCl При замыкании цепи в левом полуэлементе идет процесс окисления
- 57. Ионоселективные электроды
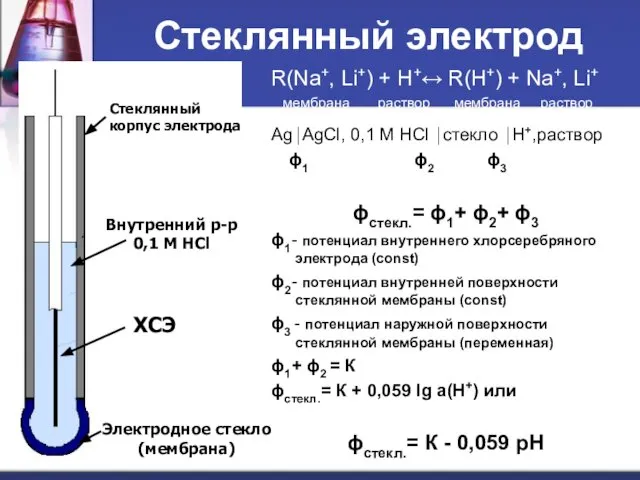
- 58. Стеклянный электрод R(Na+, Li+) + H+↔ R(H+) + Na+, Li+ мембрана раствор мембрана раствор Ag⏐AgCl, 0,1
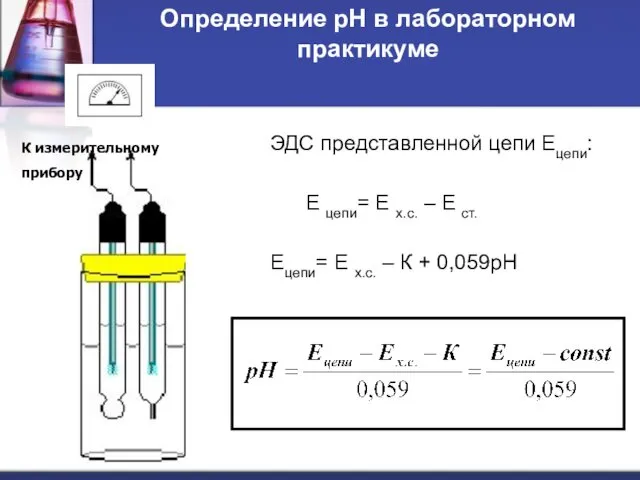
- 59. Определение рН в лабораторном практикуме ЭДС представленной цепи Ецепи: Е цепи= Е х.с. – Е ст.
- 61. Скачать презентацию




























![↑[Cl-] → ↓[Ag+] → ↓E х.с. Значение потенциала хлорсеребряного электрода при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/487913/slide-38.jpg)













 Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості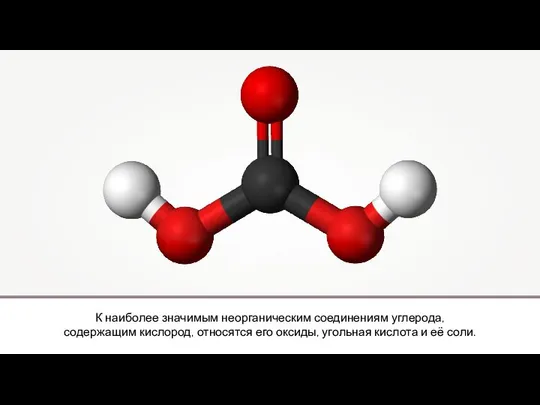 Кислородные соединения углерода
Кислородные соединения углерода Нефть. Состав нефти
Нефть. Состав нефти Особенности познания в химии
Особенности познания в химии Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу
Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Презентация по Химии "Соли в медицине" - скачать смотреть
Презентация по Химии "Соли в медицине" - скачать смотреть  Дисахариды и полисахариды
Дисахариды и полисахариды Презентация по Химии "Всё о соли" - скачать смотреть
Презентация по Химии "Всё о соли" - скачать смотреть  Аттестационная работа. Образовательная программа внеурочной деятельности Химия красок
Аттестационная работа. Образовательная программа внеурочной деятельности Химия красок Применение неметаллов и их соединений
Применение неметаллов и их соединений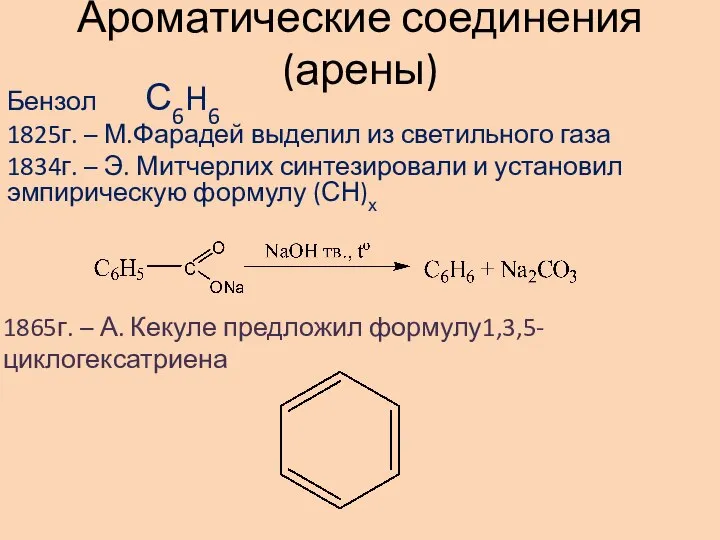 Ароматические соединения (арены)
Ароматические соединения (арены) Типы химической связи
Типы химической связи Алмаз
Алмаз Физическая химия тугоплавких неметаллических и силикатных материалов. Дисперсные системы. (Лекции 1-3)
Физическая химия тугоплавких неметаллических и силикатных материалов. Дисперсные системы. (Лекции 1-3) Основные классы неорганических соединений
Основные классы неорганических соединений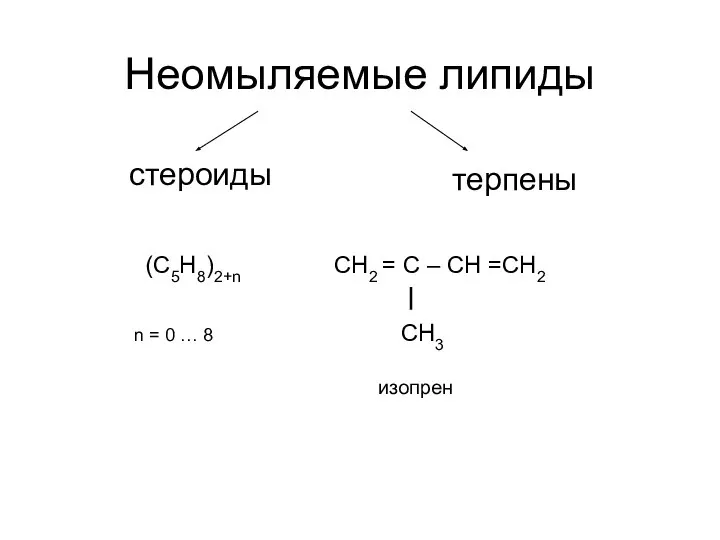 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Равновесие в растворах электролитов
Равновесие в растворах электролитов Физико-химические свойства крахмала
Физико-химические свойства крахмала Химия и стирка
Химия и стирка  Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Поверхностное упрочнение деталей. (Лекция 11)
Поверхностное упрочнение деталей. (Лекция 11) Определение активности ферментов
Определение активности ферментов Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті” Химия вокруг нас
Химия вокруг нас Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Ағзалар мен биосұйықтар минерализатындағы металдық улар
Ағзалар мен биосұйықтар минерализатындағы металдық улар Классификация металлов
Классификация металлов