Содержание
- 2. Актуальность В современном мире всё сильнее наблюдается влияние научно-технического прогресса на все сферы нашей жизни. В
- 3. Цель работы: изучение принципов работы ЭХМИ и постановка демонстрационных лабораторных работ по теме «Электрохимические анализаторы медицинского
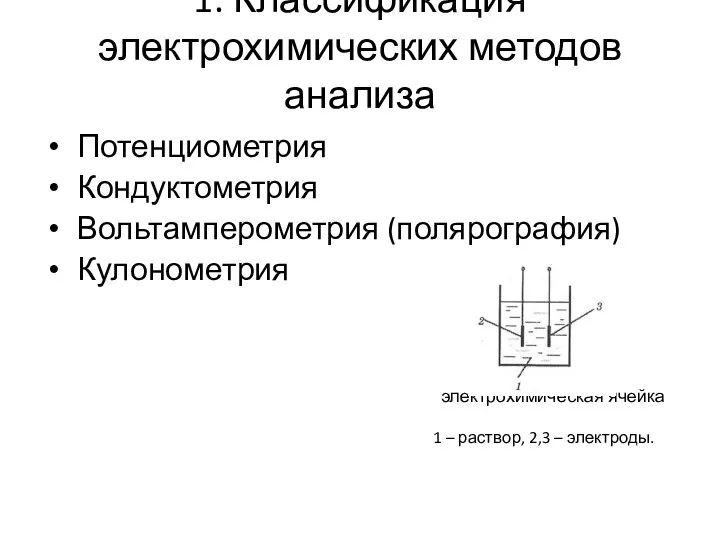
- 4. 1. Классификация электрохимических методов анализа Потенциометрия Кондуктометрия Вольтамперометрия (полярография) Кулонометрия электрохимическая ячейка 1 – раствор, 2,3
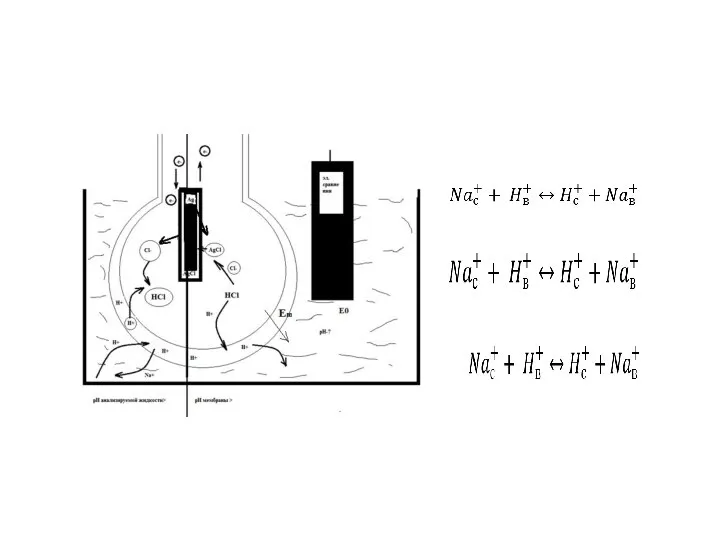
- 5. 1.1. Потенциометрия Принцип действия потенциометрических анализаторов основан на измерении потенциала электрода, размещенного в электролите, по которому
- 6. 1.3. Вольтамперометрия Принцип действия полярографии состоит в определении зависимости силы тока, который протекает между двумя электродами,
- 7. pH метр pH-009 (потенциометр) 2. Выбор моделей электрохимических анализаторов для демонстрации в учебной лаборатории Внешний вид
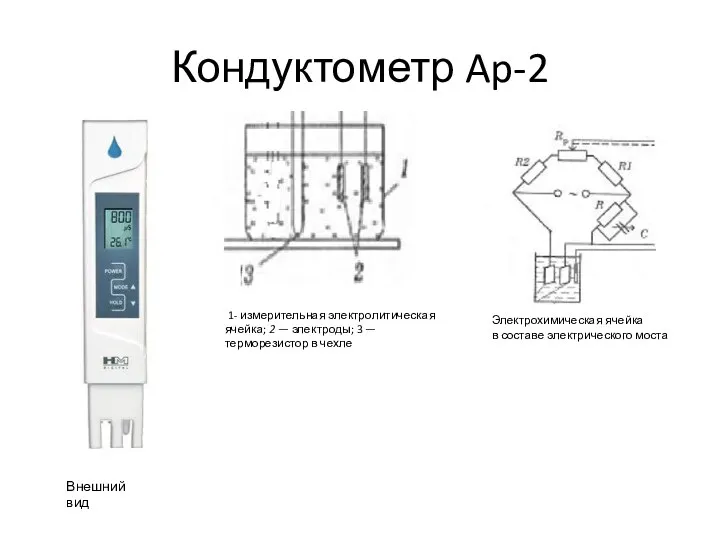
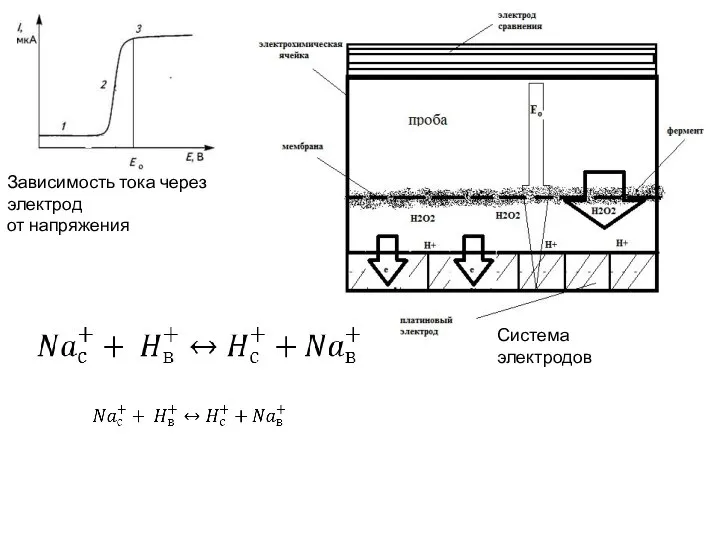
- 9. Кондуктометр Ap-2 1- измерительная электролитическая ячейка; 2 — электроды; 3 — терморезистор в чехле Электрохимическая ячейка
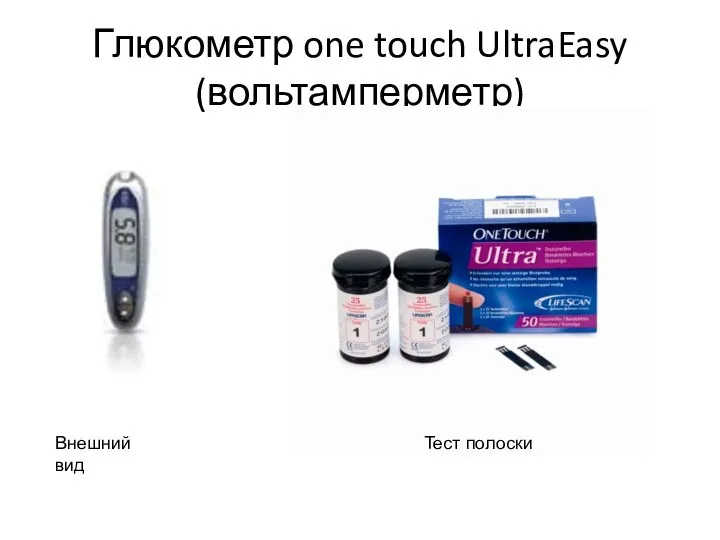
- 10. Глюкометр one touch UltraEasy (вольтамперметр) Внешний вид Тест полоски
- 11. Система электродов Зависимость тока через электрод от напряжения
- 12. 3. Лабораторные работы Демонстрация работы PH-метра Цель работы: измерение водородного показателя (рН) растворов при помощи потенциометрического
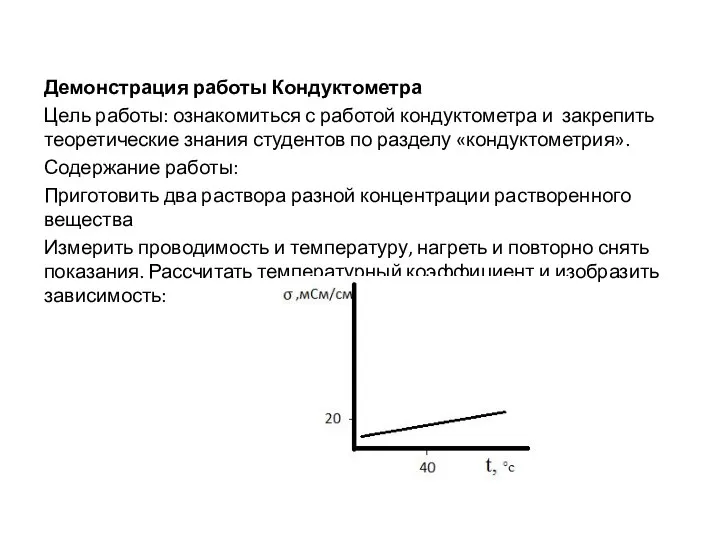
- 13. Демонстрация работы Кондуктометра Цель работы: ознакомиться с работой кондуктометра и закрепить теоретические знания студентов по разделу
- 14. Демонстрация работы глюкометра Цель работы: ознакомиться с глюкометром и закрепить теоретические знания по теме “Вольтамперометрия”. Содержание
- 15. В данной работе рассмотрены основные электрохимические методы исследования (ЭХМИ). Проведен краткий анализ рынка приборов медицинского назначения
- 16. Спасибо за внимание!
- 18. Ag│AgCl │HCl (0,1 M)│стеклнная мембрана│внешний раствор, ( рНвнешн, [H+]внешн) (5) Обозначим разность потенциалов между Ag и
- 19. Величина разности потенциалов в этом случае может быть выражена известным уравнением Нернста: DU2 = DU20 +
- 20. В общем случае, если жидкость является частью электрической цепи, то она ведет себя при определенных условиях
- 22. Скачать презентацию










![Ag│AgCl │HCl (0,1 M)│стеклнная мембрана│внешний раствор, ( рНвнешн, [H+]внешн) (5) Обозначим](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397149/slide-17.jpg)


 Составление уравнений ОВР
Составление уравнений ОВР Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры
Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры Органічні речовини в живій природі
Органічні речовини в живій природі  Обмен нуклеотидов
Обмен нуклеотидов Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза
Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты
Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты  Бензол и его свойства
Бензол и его свойства Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2
Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2 Занимательные задачи по химии
Занимательные задачи по химии Вода - растворитель
Вода - растворитель Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Типы химических реакций (11 класс)
Типы химических реакций (11 класс) Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов «terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың
«terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың углерод и его свойства
углерод и его свойства Олигонуклеотидный синтез
Олигонуклеотидный синтез Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения
Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения Любопытная органическая химия
Любопытная органическая химия Роль органической химии в жизни человека
Роль органической химии в жизни человека Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Соединения галогенов.
Соединения галогенов. Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора