Содержание
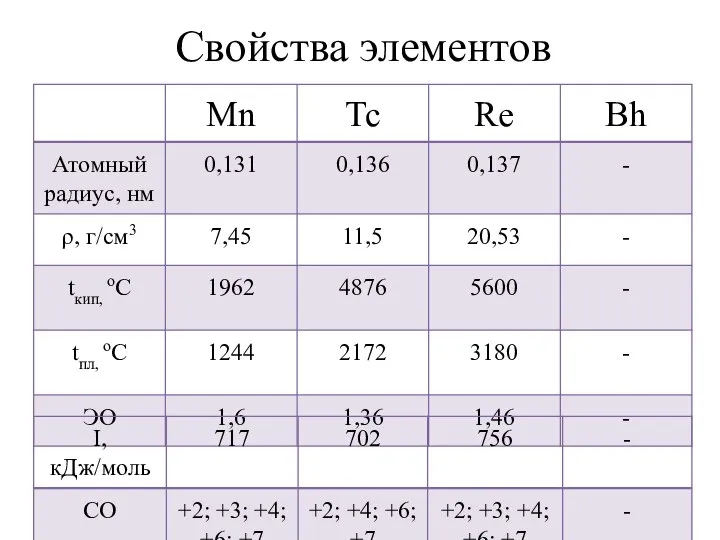
- 2. Свойства элементов
- 3. Распространение в природе Среднее содержание марганца в земной коре 0,1 %, в большинстве изверженных пород 0,06-0,2
- 4. Технеций в земной коре не содержится. Очень малые его количества были получены искусственно, с помощью ядерных
- 5. Марганец Серебристо – белый, твердый, стойкий на воздухе, активный металл. Содержащий примеси марганец хрупок. Чистый Mn
- 6. C водородом марганец не реагирует. При комнатной температуре Mn с H2O реагирует очень медленно, но при
- 7. Важнейшие соединения марганца Соединения марганца (II) Оксид марганца (II) MnO – твердое зеленое вещество, практически не
- 8. При длительном и сильном нагревании оксид марганца (II) растворяется в концентрированных растворах щелочей, образуя соли –
- 9. Mn(OH)2 – основание средней силы, хорошо растворяется в кислотах: Mn(OH)2 + H2SO4 ↔ MnSO4 + 2H2O
- 10. Соединения марганца (III) Оксид марганца (III) – твердое вещество бурого цвета, в воде практически не растворяется.
- 11. На воздухе MnO(ОН) быстро окисляется до оксида марганца (IV) 4 MnO(ОН) + О2 → 4 MnO2
- 12. Соединения марганца (IV) Оксид марганца (IV) MnO2 -темно-бурое твердое практически не растворимое в воде вещество. Получают
- 13. Гидроксид марганца (IV) Mn(OН)4 легко дегидратируется: Mn(OН)4 MnO2 + 2Н2О. и поэтому в тех реакциях, где
- 14. Соединения марганца (VI) Оксид марганца (VI) MnO3 при обычных условиях не существует. Марганцовистая кислота Н2MnO4 нестойкая,
- 15. Соединения марганца (VII) Оксид марганца (VII) Mn2О7 – зеленовато-бурая маслянистая жидкость, растворимая в воде, при этом
- 16. Марганцевая кислота НMnО4 получается при растворении в большом количестве холодной воды оксида марганца (VII): Mn2О7 +
- 17. При взаимодействии марганца, MnО и Mn(ОН)2 с кислотами в водном растворе образуются аквакомплексы [Mn(H2O)6]2+, придающие растворам
- 18. Окислительно-восстановительные свойства соединений марганца Для соединений марганца очень характерны окислительно-восстановительные реакции. Марганец (VII), имея высшую степень
- 19. MnO2 и K2MnO4 тоже проявляют сильные окислительные свойства (особенно в кислой среде): MnО2 + Н2О2 +
- 20. Способы получения марганца Промышленное получение марганца начинается с добычи и обогащения руд. Если используют карбонатную руду
- 21. Для практических целей чаще всего используют ферромарганец, полученный в доменном процессе при восстановлении руд железа и
- 22. Применение марганца — Почти 90% всего металла расходуется в черной металлургии. В виде ферромарганца — сплава
- 23. Применение соединений марганца — В органическом синтезе в качестве окислителей и катализаторов; в полиграфии и производстве
- 24. Технеций Серебристо-коричневый радиоактивный металл. По химические свойствам Тс близок к Mn и особенно к Re, в
- 25. Получены оксифториды технеция TcOF4 и TcO3F: 2Tc + O2 + 4F2 =2TcOF4 (t) Хлорирование технеция дает
- 26. Применение. Пертехнаты используются как ингибиторы коррозии малоуглеродистой стали. Изотоп 99mTc — в диагностике опухолей головного мозга,
- 27. Рений Плотный, серебристо-белый металл. Рений не реагирует с азотом и водородом; порошок рения лишь адсорбирует водород.
- 28. Способы получения рения Основным способом промышленного получения рениевого порошка является восстановление перрената калия водородом: 2KReO4 +
- 29. Восстановление водородом производится аналогично восстановлению окислов вольфрама и молибдена в трубчатых электрических печах. Восстанавливаемую соль помещают
- 30. Из них необходимо извлекать рений. Раствор может быть концентрирован выпариванием. Затем, добавляя перекись водорода, соединения рения
- 31. Кроме того, использование рения в сплавах с вольфрамом и молибденом позволяет облегчить обработку этих тугоплавких металлов.
- 32. Борий Нестабильный радиоактивный химический элемент. О химических свойствах бория ничего неизвестно, но можно сделать несколько предположений
- 34. Скачать презентацию






























 Atomic structure and properties. (Chapter 3)
Atomic structure and properties. (Chapter 3) Товароведная характеристика и показатели качества соленой рыбы
Товароведная характеристика и показатели качества соленой рыбы Автомобильный транспорт как источник химического загрязнения тяжелыми металлами
Автомобильный транспорт как источник химического загрязнения тяжелыми металлами Зависимость свойств химических элементов от положения в ПСХЭ
Зависимость свойств химических элементов от положения в ПСХЭ Периодический закон и строение атома
Периодический закон и строение атома Ситуационная задача по биохимии
Ситуационная задача по биохимии Качественные реакции на ионы железа Fe2+ и Fe3+
Качественные реакции на ионы железа Fe2+ и Fe3+ Харчові добавки Підготували: Возна Руслана Таран Ірина
Харчові добавки Підготували: Возна Руслана Таран Ірина  Аттестационная работа. Химия в нашей жизни
Аттестационная работа. Химия в нашей жизни Сульфаниламидные препараты. Хинолоны
Сульфаниламидные препараты. Хинолоны Создание косметических средств
Создание косметических средств Горные породы и минералы. Камни-самоцветы
Горные породы и минералы. Камни-самоцветы Получение и приминение этилена
Получение и приминение этилена Элементы химической кинетики
Элементы химической кинетики Вода та її властивості
Вода та її властивості Цвет и другие диагностические признаки осадочных пород
Цвет и другие диагностические признаки осадочных пород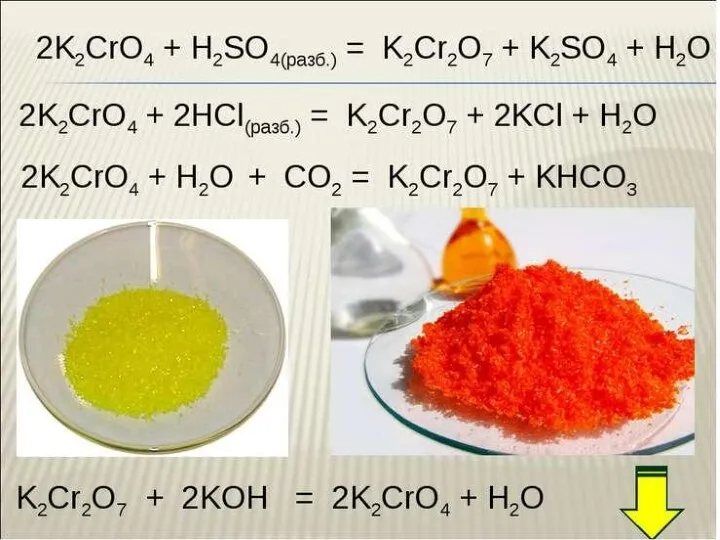 Хром. Соединения хрома
Хром. Соединения хрома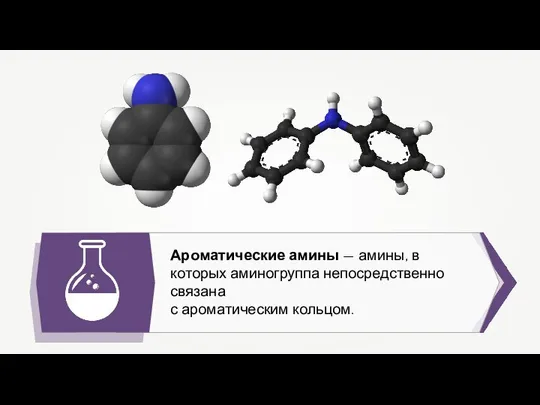 Ароматические амины
Ароматические амины Ароматические оксисоединения. Фенолы
Ароматические оксисоединения. Фенолы Синтетичні речовини у сільському господарстві, медицині та промисловості Презентація на тему:
Синтетичні речовини у сільському господарстві, медицині та промисловості Презентація на тему:  Металлы. Классификация металлов
Металлы. Классификация металлов Вклад М.В. Ломоносова в дидактику химии
Вклад М.В. Ломоносова в дидактику химии Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва Карбонильные соединения
Карбонильные соединения Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.
Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.  Основы органической химии
Основы органической химии ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А. М. БУТЛЕРОВА Становление органической химии. Предпосылки теории строения
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ А. М. БУТЛЕРОВА Становление органической химии. Предпосылки теории строения  Ферменты 3. Медицинская энзимология. (Лекция 3)
Ферменты 3. Медицинская энзимология. (Лекция 3)