Содержание
- 2. Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в
- 3. К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма. В начале XVIII
- 4. В окружающей нас среде химические элементы металлы встречаются как в виде простых веществ (или в свободном
- 5. Форма нахождения элементов металлов в естественных условиях зависит от их химической активности. Химически малоактивные металлы (например,
- 6. Если металл в природных условиях находится в свободном состоянии, то его получение сводится лишь к разделению
- 7. Однако большинство металлов получают в результате химических реакций из руд. Руда – природное минеральное образование, в
- 8. Чтобы получить металлы из руды в свободном состоянии, необходимо провести процесс восстановления: Men+ + ne- =
- 9. Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на: - пирометаллургические,
- 10. Восстановление с помощью водорода Водород как восстановитель может использоваться для получения металлов со средней и малой
- 11. Восстановление металлами (металлотермия) Металлы используются в качестве восстановителей для получения других металлов из самых различных соединений.
- 12. При высокой температуре углерод и оксид углерода(II) являются сильными восстановителями: CuO+CO=Cu+CO2 PbO+C=Pb+CO
- 13. Свободный углерод (в виде кокса) и оксид углерода(II) служат восстановителями при промышленном производстве железа в доменном
- 15. Постоянный электрический ток является самым сильным восстановителем. С помощью электролиза в промышленных условиях получают многие активные
- 16. Весь производимый в промышленных масштабах алюминий получают путем электролиза раствора оксида алюминия в расплавленном криолите Na3AlF6.
- 17. Домашнее задание: Параграф §65.
- 19. Скачать презентацию
















 Анализ красителей и консервантов, входящих в состав безалкогольных газированных и негазированных напитков
Анализ красителей и консервантов, входящих в состав безалкогольных газированных и негазированных напитков Презентация по Химии "Предмет химии" - скачать смотреть
Презентация по Химии "Предмет химии" - скачать смотреть  Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних
Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних Галогенидные и полигалогенидные комплексы постпереходных элементов
Галогенидные и полигалогенидные комплексы постпереходных элементов Электродные процессы, их биологическая роль и применение в медицине
Электродные процессы, их биологическая роль и применение в медицине Взаимодействие солей аммония со щелочами
Взаимодействие солей аммония со щелочами Алканы. Получение и применение алканов
Алканы. Получение и применение алканов Алкины
Алкины Химическая связь
Химическая связь Презентация по Химии "Штучні волокна" - скачать смотреть бесплатно
Презентация по Химии "Штучні волокна" - скачать смотреть бесплатно Пептиды. Белки
Пептиды. Белки Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Сполуки фосфору
Сполуки фосфору Навчальний проект «Дослідження зміни концентрації CO2 у класній кімнаті під час занять»
Навчальний проект «Дослідження зміни концентрації CO2 у класній кімнаті під час занять» Производные пирролидина, пиразолона и пиразолидиндиона: их свойства, анализ, хранение, применение
Производные пирролидина, пиразолона и пиразолидиндиона: их свойства, анализ, хранение, применение Витамины и авитаминоз - презентация_
Витамины и авитаминоз - презентация_ Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Электродные материалы для электрохимических систем
Электродные материалы для электрохимических систем Комплексті қосылыстар
Комплексті қосылыстар Абсолютное первенство по химии
Абсолютное первенство по химии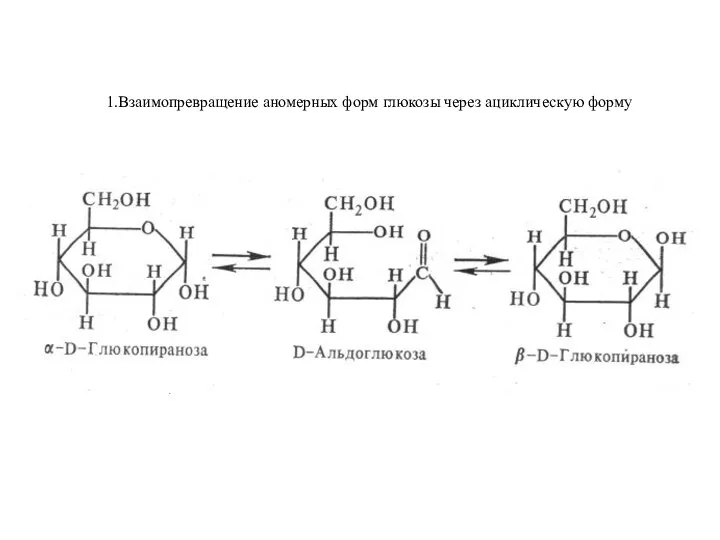 Взаимопревращение аномерных форм глюкозы через ациклическую форму
Взаимопревращение аномерных форм глюкозы через ациклическую форму Биологически важные ароматические и гетероциклические соединения
Биологически важные ароматические и гетероциклические соединения Химическая связь
Химическая связь Полимерные материалы и изделия
Полимерные материалы и изделия Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8)
Классификация дисперсных систем. Электрокинетические свойства и устойчивость коллоидных растворов. (Лекция 8) Хром и его соединения
Хром и его соединения Липиды. Классификация
Липиды. Классификация