Содержание
- 2. Основные понятия термодинамики ТЕРМОДИНАМИКА (ТД) – это наука о взаимных превращениях различных видов энергии.
- 3. Химическая термодинамика изучает: Переходы химической энергии в другие формы- тепловую, электрическую и. т.д., Каковы энергетические эффекты
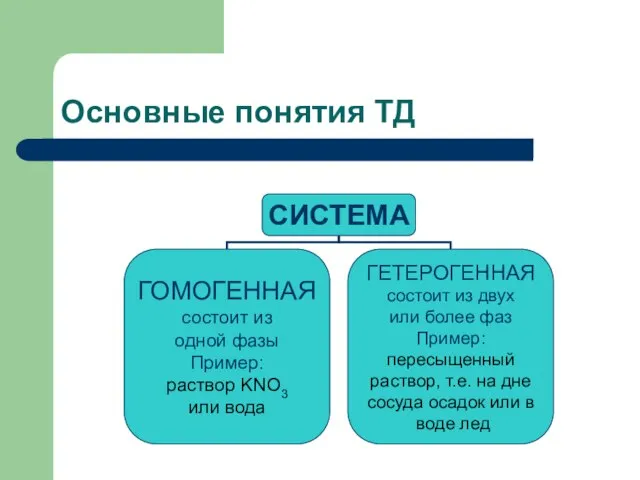
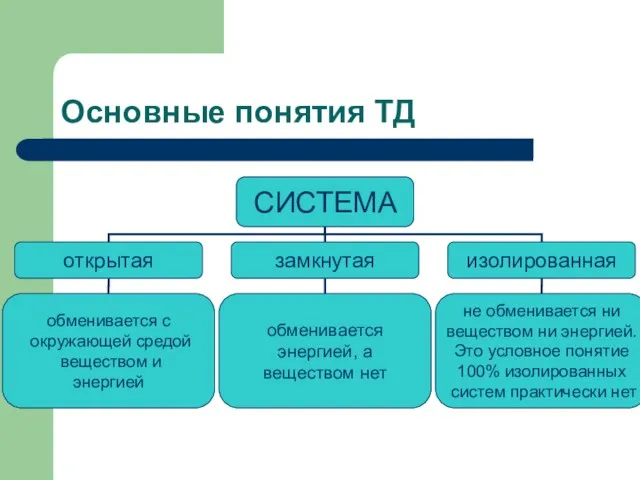
- 4. Основные понятия ТД Объектом изучения в термодинамике является система. Система - это совокупность веществ находящихся во
- 5. Основные понятия ТД
- 6. Основные понятия ТД Фаза-это часть системы, однородная во всех точках по составу и свойствам и отделенная
- 7. Основные понятия ТД
- 8. Термодинамические параметры Температура – Т Давление – Р Плотность – ρ Концентрация - С Теплоемкость –
- 9. Параметры химической термодинамики U - внутренняя энергия Н - энтальпия S - энтропия G - энергия
- 10. Внутренняя энергия системы Внутренняя энергия системы (U) - представляет собой ее полную энергию, которая складывается из
- 11. Единицы измерения Единицы измерения внутренней энергии: [U] = Дж, кДж. Абсолютное значение внутренней энергии определить невозможно,
- 12. Внутренняя энергия системы Внутренняя энергия - это функция состояния, которая характеризует полный запас энергии системы. Изменение
- 13. Термодинамический процесс - это изменение состояния системы, сопровождающийся изменением хотя бы одного из параметров системы во
- 14. Термодинамический процесс В зависимости от условий перехода системы из одного состояния в другое в термодинамике различают
- 15. Теплота - является мерой энергии переданной от одного тела к другому, за счет разницы температур этих
- 16. Работа - является мерой энергии, переданной от одного тела к другому за счет перемещения масс под
- 17. Первый закон термодинамики Выражает количественное соотношение между изменением внутренней энергии, теплотой и работой: Q=ΔU +A Т.е.
- 18. Закон сохранения энергии - энергия не исчезает и не возникает, она переходит из одной формы в
- 19. Изохорный процесс Первый закон ТД: Q=ΔU +A = ΔU + P×ΔV Для изохорного процесса V=const ,
- 20. Изобарный процесс Для изобарного процесса Р=const. В изобарных процессах тепловой эффект химической реакции равен изменению энтальпии
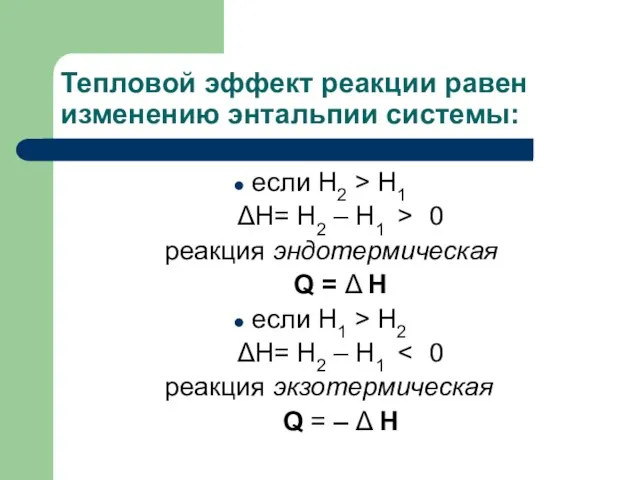
- 21. Тепловой эффект реакции - это количество теплоты, которое выделяется или поглощается системой после протекания химической реакции
- 22. Тепловой эффект реакции равен изменению энтальпии системы: если H2 > H1 ΔH= H2 – H1 >
- 23. Энтальпия образования - количество теплоты, которое выделяется или поглощается при образовании 1 моля сложного вещества из
- 24. Стандартная энтальпия образования Для сравнения энтальпий образования различных соединений их определяют при одинаковых стандартных условиях: Т=298
- 25. Единицы измерения Единицы измерения энтальпии образования: Значения стандартных энтальпий образования приведены в таблицах, необходимо обращать внимание
- 26. ПРИМЕР
- 27. ПРАВИЛО! энтальпии образования простых веществ равны нулю для устойчивых простых веществ энтальпия равна нулю Например: Для
- 28. Термохимические уравнения это уравнения химической реакции в котором указан тепловой эффект химической реакции и агрегатные состояния.
- 29. Виды агрегатного состояния вещества т – твердое к – кристаллическое, ам. – аморфное, ж – жидкое,
- 30. ПРИМЕР
- 31. Особенности термохимических уравнений в термохимических уравнениях могут быть дробные стехиометрические коэффициенты.
- 32. Особенности термохимических уравнений С термохимических уравнениями можно производить алгебраические действия. Их можно складывать, вычитать, умножать на
- 33. Закон Гесса Тепловой эффект химической реакции определяется лишь начальным и конечным состояниями системы реагирующих веществ и
- 34. Пример. Получение СО2 1 путь: С + О2 = СО2 ΔН1 2 путь: С + 1/2О2
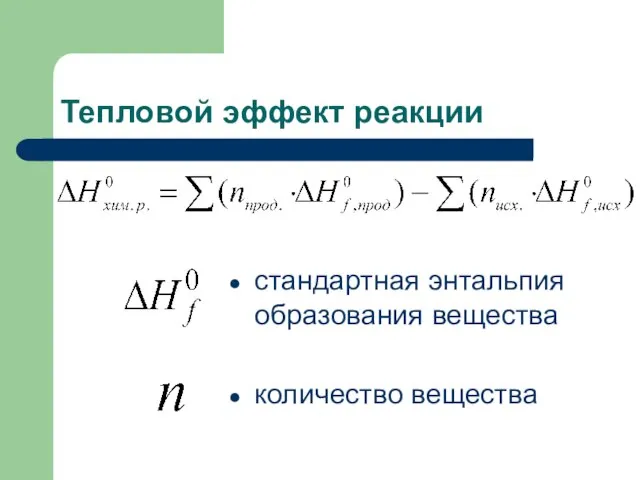
- 35. Следствие из закона Гесса Теплота химической реакции равна разности между суммой энтальпий образования продуктов реакции и
- 36. Тепловой эффект реакции стандартная энтальпия образования вещества количество вещества
- 37. Пример. Рассчитать ΔН0 химической реакции
- 38. Пример. Рассчитать ΔН0 MgO
- 39. Задача Вычислите ΔН0 SO3 если при сгорании 64г серы выделилось 790 кДж тепла. Решение: S +3/2O2
- 40. Задача Сколько тепла выделится при взаимодействии 4,48 литров N2 (н.у.) с Н2 , если ΔН0 (NH3)=–46
- 41. Возможность и направление протекания химических реакций
- 42. Самопроизвольность протекания реакции При изучении химических взаимодействий важно оценить возможность или невозможность их самопроизвольного протекания при
- 43. Второй закон термодинамики Определяет критерий самопроизвольного протекания процесса в изолированных системах - энтропию
- 44. Энтропия это параметр характеризующий хаотичность движения частиц, является мерой молекулярного, атомного и ионного беспорядка.
- 45. Параметры состояния вещества Параметры макросостояния системы: Р -давление, Т – температура ,V – объем Параметры микросостояния
- 46. Термодинамическая вероятность состояния системы (W) это число микросостояний, с помощью которых осуществляется данное макросостояние
- 47. Уравнение Больцмана Уравнение Больцмана придало энтропии физический смысл.
- 48. Основные положения Энтропия- это мера термодинамической вероятности состояния веществ и систем. Любая изолированная система предоставленная самой
- 49. Изменение энтропии ΔS = S2 –S1 если ΔS > 0, то процесс протекает в прямом направлении,
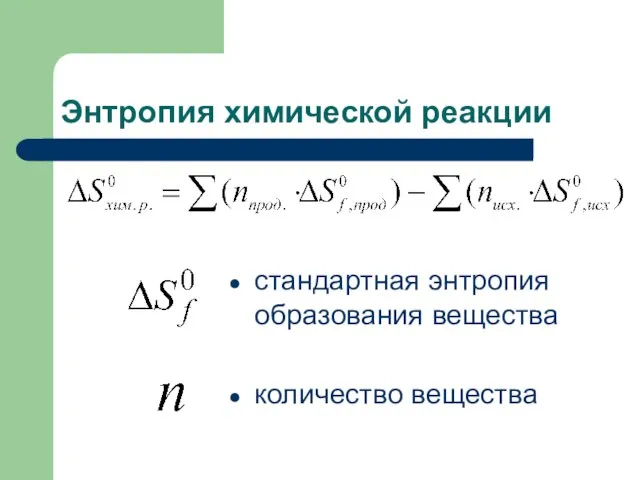
- 50. Энтропия химической реакции стандартная энтропия образования вещества количество вещества
- 51. Основные положения значения стандартных энтропий приведены в таблице; значение энтропий зависит от агрегатного состояния веществ.
- 52. Пример:
- 53. Абсолютное значение энтропии В отличие от энтальпии и внутренней энергии можно определить абсолютное значение энтропии всех
- 54. Пример Сграфит тв. + СО2 = 2СОгаз ΔS=175,4 1моль 2 моль ΔS>0 твердые и жидкие вещества
- 55. Пример 2Н2(г) + О2(г) = 2Н2О(г) ΔS 2 1 2 в данной реакции объем уменьшается, беспорядок
- 56. Факторы неизолированных систем 1.Энтальпийный ΔН- отражает стремление системы к образованию связей в результате взаимного притяжения частиц,
- 57. Энергия Гиббса Энтропийный и энтальпийный факторы обычно действуют в противоположных направлениях и общее направление реакции определяется
- 58. Уравнение энергии Гиббса
- 59. Величина и знак ΔG позволяют судить о принципиальной возможности и направлении процесса. ΔG Δ G>0 прямая
- 60. Пример Fe2O3(тв) +3Н2 (г) =2Fe (тв) +3Н2О(г) ΔН х.р. = 96,61 кДж Возможна ли данная реакция
- 61. Пример При какой температуре начнется эта реакция? Решение: Найдем температуру при которой ΔG=0? ΔH =T ΔS
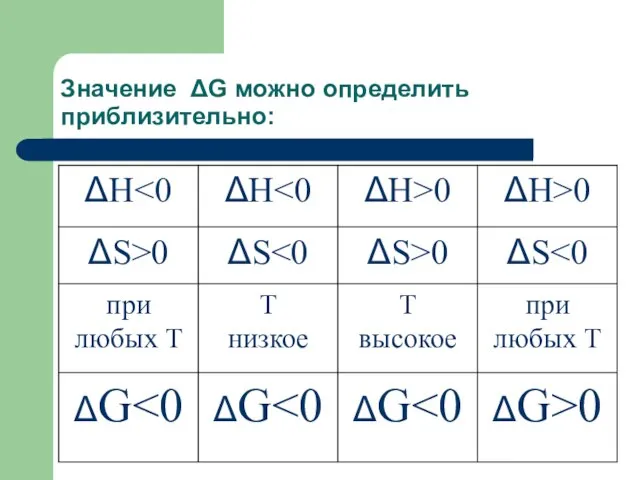
- 62. Значение ΔG можно определить приблизительно:
- 63. Энергия Гиббса химической реакции стандартная энергия Гиббса образования вещества количество вещества
- 64. Стандартная энергия Гиббса образования химического соединения ΔG° это энергия Гиббса реакции образования одного моля этого соединения
- 65. Устойчивость соединений вещество термодинамически устойчиво и может быть получено из простых веществ такие вещества термодинамически неустойчивы,
- 66. ПРИМЕР NO, NO2 , при стандартных условиях их получают косвенным путем: Cu + HNO3 → Cu(NO3)2
- 67. ВАЖНО! Любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса.
- 68. Химическое равновесие и константа равновесия
- 69. Состояние равновесия это такое состояние системы при которой ΔG = 0, а скорость прямой реакции равна
- 70. Константа равновесия характеризует количественное состояние равновесия
- 71. Расчет константы равновесия Для расчета константы равновесия используются равновесные концентрации. Если в реакции все вещества находятся
- 72. Парциальное давление это такое давление газа, входящего в смесь, которое он оказывал бы, если бы занимал
- 73. ПРИМЕР
- 74. Связь Кр и ΔG° Константа равновесия связана со стандартной энергией Гиббса следующим соотношением: Зная значения ΔG°
- 75. Смещение равновесия При изменении внешних условий меняются равновесные концентрации, происходит смещение равновесия. Направление смещения химического равновесия
- 76. Принцип Ле–Шателье При внешнем воздействии равновесие смещается в сторону ослабления этого воздействия.
- 77. 1. Влияние температуры на равновесие химической реакции Повышение температуры - смещает равновесие в сторону эндотермической реакции
- 78. 2. Влияние давления на равновесие химической реакции Повышение давления смещает равновесие в сторону меньшего объема. 3Н2
- 79. 3. Влияние концентрации на равновесие химической реакции Повышение концентрации исходных веществ смещает равновесие в сторону продуктов
- 81. Скачать презентацию







![Единицы измерения Единицы измерения внутренней энергии: [U] = Дж, кДж. Абсолютное](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/499637/slide-10.jpg)
































































 Бутлеровтың құрылыс теориясы
Бутлеровтың құрылыс теориясы Спирты. Тема 5
Спирты. Тема 5 Анализ карбоновых кислот и их производных
Анализ карбоновых кислот и их производных Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Кислоты, их состав и название. Цель урока: 1. Сформировать понятия о кислотах. 2. Рассмотреть состав, название и классификацию кислот. 3. Познакомить учащихся с важнейшими неорганическими кислотами. © Осиевская И.А.
Кислоты, их состав и название. Цель урока: 1. Сформировать понятия о кислотах. 2. Рассмотреть состав, название и классификацию кислот. 3. Познакомить учащихся с важнейшими неорганическими кислотами. © Осиевская И.А.  Фосфор и его соединения
Фосфор и его соединения Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть
Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть  Методика решения части С2 ГИА 9 класс
Методика решения части С2 ГИА 9 класс Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Сульфаты и оксиды металлов
Сульфаты и оксиды металлов Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Небезпечні хімічні речовини Підготувала: учениця 8 – А класу Кіровоградського НВК №34 Подколзіна Анна
Небезпечні хімічні речовини Підготувала: учениця 8 – А класу Кіровоградського НВК №34 Подколзіна Анна  Почему протекают химические реакции
Почему протекают химические реакции Презентация по химии Амины
Презентация по химии Амины Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Неметаллы IVA и IIIA групп Углерод, кремний , бор
Неметаллы IVA и IIIA групп Углерод, кремний , бор Разложение отходов. 11 класс
Разложение отходов. 11 класс 10 класс семинар-написание формул органических веществ
10 класс семинар-написание формул органических веществ Электролиз водных растворов
Электролиз водных растворов Физическая и коллоидная химия
Физическая и коллоидная химия Влияние фтора на организм человека
Влияние фтора на организм человека Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Гор
Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Гор Классификация углеводородов
Классификация углеводородов Материаловедение. Теория сплавов
Материаловедение. Теория сплавов Древесина и её топливные свойства
Древесина и её топливные свойства Підгрупа карбону
Підгрупа карбону Вторичная переработка углеводородов
Вторичная переработка углеводородов