Содержание
- 2. Как рассматривалось ранее: где А' – полезная работа, P∙ΔV – работа расширения
- 3. Для изобарно-изотермических условий (P,T = const): где G – энергия Гиббса, функция состояния системы, убыль которой
- 4. Для решения вопроса о самопроизвольном протекании реакции в закрытых системах используют изменение энергии Гиббса (ΔG).
- 5. Любая реакция при постоянных температуре и давлении протекает самопроизвольно в направлении убыли энергии Гиббса. Величина ΔG
- 6. В ходе самопроизвольного процесса в закрытых системах энергия Гиббса уменьшается до определенной величины, принимая минимально возможное
- 7. Убыль энергии Гиббса может быть определена из соотношения: Δ G = ΔН – Т ⋅ Δ
- 8. Расчет стандартного изменения энергии Гиббса при любой температуре обычно проводят по приближенному уравнению, если не нужна
- 9. Для расчета процесса необходимо: записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции; расставить стехиометрические
- 10. При условии оба направления процесса равновероятны. Температура, при которой прямой и обратный процессы равновероятны, может быть
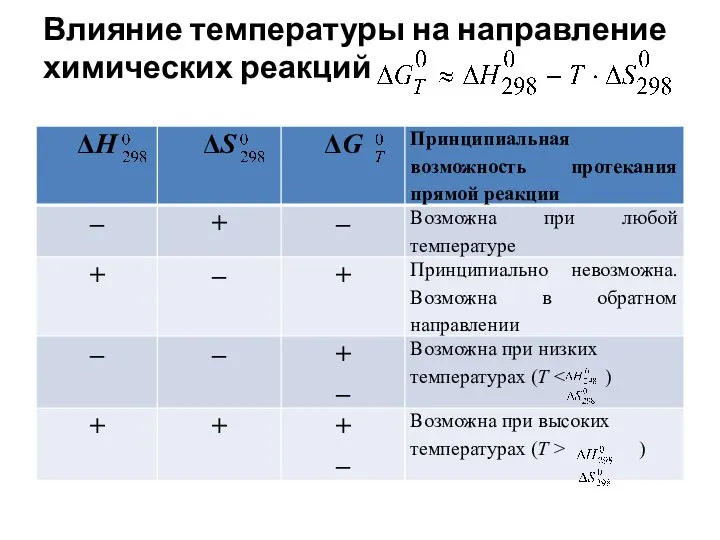
- 11. Самопроизвольное течение реакции в закрытых системах контролируется как энтальпийным ( ), так и энтропийным ( )
- 12. Если Т → ∞, то ΔG → (– ). При высоких температурах величина и знак определяются
- 13. Влияние температуры на направление химических реакций
- 14. Так как энергия Гиббса является функцией состояния, расчет стандартной энергии Гиббса реакции проводится также по уравнению,
- 15. – стандартное изменение энергии Гиббса реакции образования 1 моль вещества из простых веществ при условии, что
- 16. Для любой реакции при некоторых произвольно выбранных значениях давления и температуры можно рассчитать величину . Связь
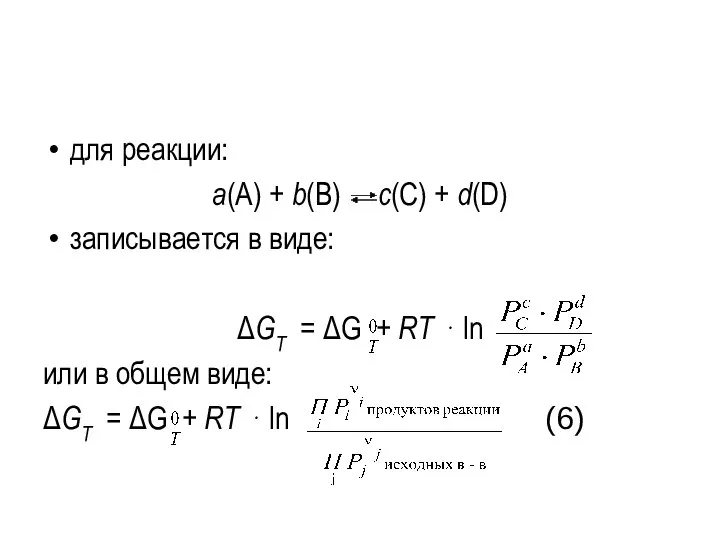
- 17. для реакции: a(А) + b(В) с(С) + d(D) записывается в виде: ΔGТ = ΔG + RT
- 18. Рi − начальные парциальные давления, при которых газы вступили в реакцию (атм); – произведение начальных парциальных
- 19. Величина ΔGT в уравнении (6) − это изменение энергии Гиббса, которое при данной температуре Т соответствует
- 20. ΔG стандартное изменение энергии Гиббса в уравнении изотермы имеет аналогичный смысл, но для условий, которые
- 21. Используя уравнение изотермы (6) для любой реакции при некоторых произвольно выбранных значениях давления и температуры можно
- 22. Анализ многочисленных экспериментальных данных показал, что при реальных изменениях условий (начальных парциальных давлений реагирующих веществ) второе
- 23. Процесс термодинамически невозможен как самопроизвольный при ΔG >> 0 (> 50 kДж). Если ΔG Значения ΔG
- 24. Если начальные парциальные давления веществ, участвующих в реакции, равны 1 атм, то ΔGТ = ΔG ,
- 25. Отсюда получаем одно из важнейших уравнений термодинамики, связывающее константу химического равновесия со стандартным изменением энергии Гиббса:
- 26. Поскольку , то уравнение (7) примет вид:
- 27. В равновесном процессе, протекающем при V,T = const, максимально полезная работа, произведенная системой, равна убыли энергии
- 28. Изменение энергии Гельмгольца связано с изменением внутренней энергии и энтропии уравнением: ΔF = ΔU – TΔS
- 29. Если реакция протекает в растворах, то изменением объема можно пренебречь и считать, что ΔF ≈ ΔG.
- 30. Пример 1. Возможен ли в стандартных условиях процесс взаимодействия азота и кислорода воздуха N2 г +
- 31. ΔG = ΔН – ТΔS = 180 400 – 298 ⋅ 24,66 = 173 051 Дж
- 32. 2 способ ΔG = 2ΔG (NO) – ΔG (N2) – ΔG (O2) = = 2 ⋅
- 33. Пример 2. Определить давление разложения 3Fe2O3 тв ⇄ 2Fe3O4 тв + 1/2O2 г при 627оС. При
- 34. ΔS = 2 ⋅ S (Fe3O4) + ⋅ S (O2) – 3S (Fe2O3) = = 2
- 35. Kр = Р , Р(О ) = (Kp)2 = 1,72 ⋅ 10–13 атм. Если давление кислорода
- 36. Пример 3. Определить ΔH и ΔS процесса испарения бромида олова (II). Давление насыщенного пара SnBr2 при
- 37. Так как ln1 = 0, то из второго уравнения можно выразить ΔH через ΔS (ΔH =
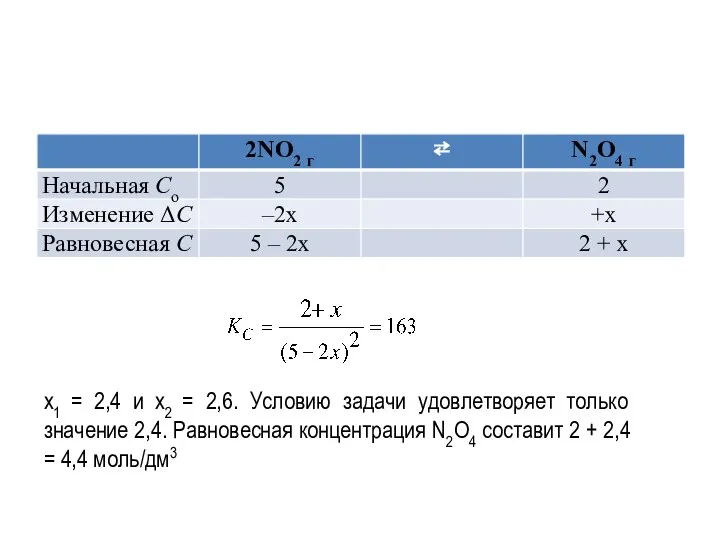
- 38. Пример 4. Определить равновесную концентрацию N2O4 г при стандартной температуре, если начальные концентрации составляли: Сo(NO2) =
- 40. x1 = 2,4 и x2 = 2,6. Условию задачи удовлетворяет только значение 2,4. Равновесная концентрация N2O4
- 42. Скачать презентацию






















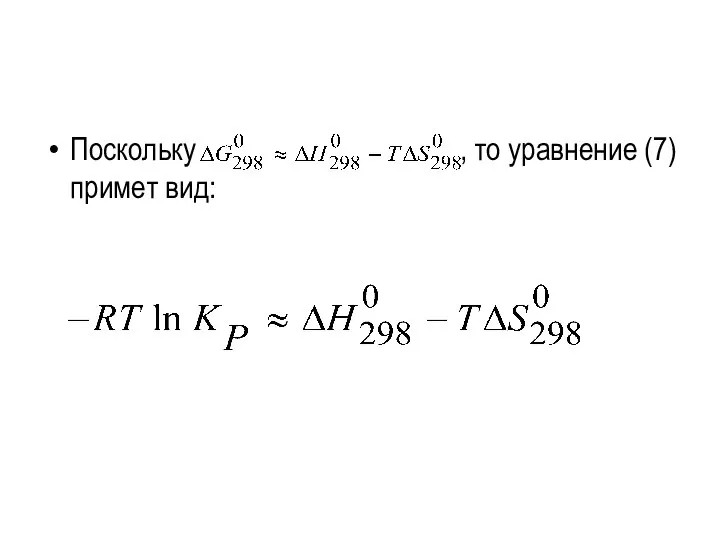












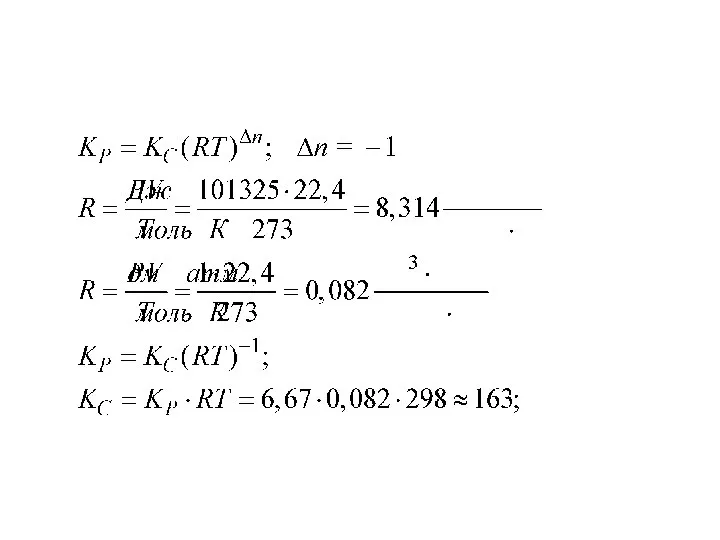
 Способы очистки воды в быту
Способы очистки воды в быту Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв
Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв Яковлева Татьяна Алексеевна Ярославль, 2009 г.
Яковлева Татьяна Алексеевна Ярославль, 2009 г.  Шоу «Юный химик»
Шоу «Юный химик» Полимеры. Классификация, применение
Полимеры. Классификация, применение Талдаудың электрохимиялық әдістері: анодты полярография. Талдаудың электрохимиялық әдістері: катодты полярография
Талдаудың электрохимиялық әдістері: анодты полярография. Талдаудың электрохимиялық әдістері: катодты полярография Жидкие кристаллы
Жидкие кристаллы Физико-химия дисперсных систем. Коллоидные растворы
Физико-химия дисперсных систем. Коллоидные растворы Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.
Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.  ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА» Презентация Классификация кислот
Презентация Классификация кислот  Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель х
Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель х Повторение. Периодический закон и периодическая система Д.И. Менделеева в свете строения атома
Повторение. Периодический закон и периодическая система Д.И. Менделеева в свете строения атома Коррозия металлов. (Лекция 7)
Коррозия металлов. (Лекция 7) Классификация сталей
Классификация сталей Констукционные и функциональные волокнистые композиты
Констукционные и функциональные волокнистые композиты Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Мұнайлардың жіктелуі
Мұнайлардың жіктелуі Бета-окисление жирных кислот
Бета-окисление жирных кислот Классификация минералов по химическому принципу. Занятие 14
Классификация минералов по химическому принципу. Занятие 14 Способы переработки нефти
Способы переработки нефти СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ
СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ  Конструкция прибора ЛПУ 01
Конструкция прибора ЛПУ 01 Кристаллография и основы кристаллохимии. Лекция 5
Кристаллография и основы кристаллохимии. Лекция 5 Hydrogen
Hydrogen Липиды. Классификация липидов
Липиды. Классификация липидов Бионеорганическая химия. Особенности биохимический процессов. (Лекция 1)
Бионеорганическая химия. Особенности биохимический процессов. (Лекция 1)