Содержание
- 2. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В СОЕДИНЕНИЯХ «Тот эффект, который оказывает атом или группа атомов на электронную плотность
- 3. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Индуктивный эффект можно определить и так. «I-эффект – это смещение
- 4. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ + I-эффект: В целом можно предложить 2 ряда заместителей в
- 5. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Существует ряд правил для определения направления величины индуктивного эффекта:
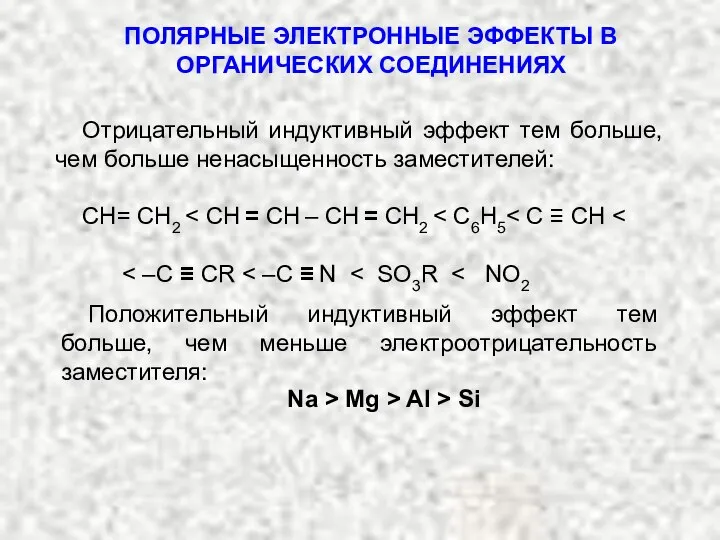
- 6. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Отрицательный индуктивный эффект тем больше, чем больше ненасыщенность заместителей: СН=
- 7. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Мезомерный эффект. Если индуктивный эффект действует через σ-связи (в насыщенных
- 8. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Поскольку М-эффект действует через π-связи, а также через неподелённые электронные
- 9. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Граничные структуры таким образом могут быть нарисованы, но в действительности
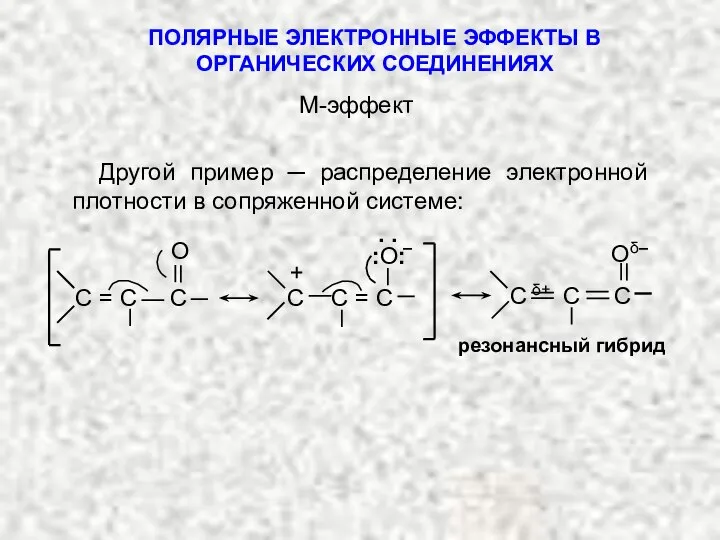
- 10. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Другой пример ─ распределение электронной плотности в сопряженной системе: М-эффект
- 11. –СR=CR2 -C ≡ N ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Для определения величины и знака мезомерного
- 12. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ исключением являются галогены: F > Cl > Br > I.
- 13. Мезомерный эффект играет очень важную роль в реакционной способности частиц. Наличие протяжённого М-эффекта может приводить к
- 15. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Ответ на пример: У аллильного карбкатиона стабильность больше, так как
- 16. Чтобы разделить заряды нужно сообщить энергию. Один из физических законов гласит, что устойчивость заряженной частицы повышается
- 17. 1) Если молекула может быть представлена 2-мя или более граничными структурами, отличающимися лишь распределе-нием электронов (ядра
- 18. Наличие в молекуле минимального числа неспареных электронов Локализация заряда (более устойчивой является структура, в которой «+»
- 19. Степень разделения заряда (структура с разделёнными зарядами менее устойчива, чем структура с неразделёнными зарядами) Полнота или
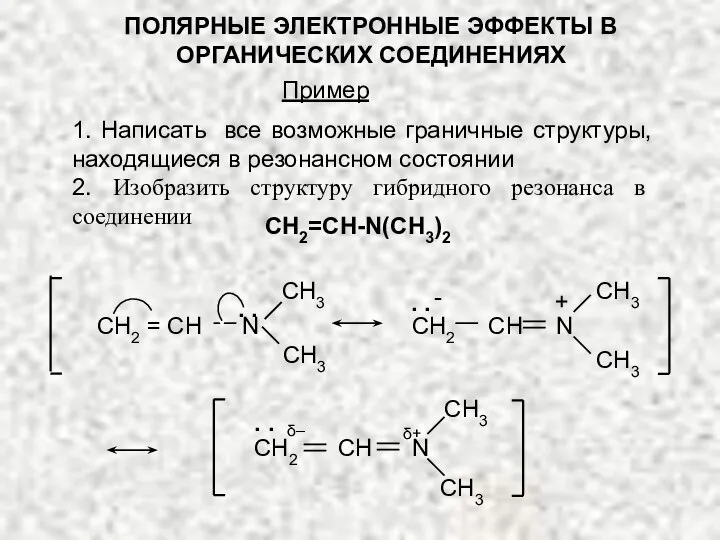
- 20. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ 1. Написать все возможные граничные структуры, находящиеся в резонансном состоянии
- 21. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Теория резонанса Под термином "РЕЗОНАНС" следует понимать способ изображения молекулы,
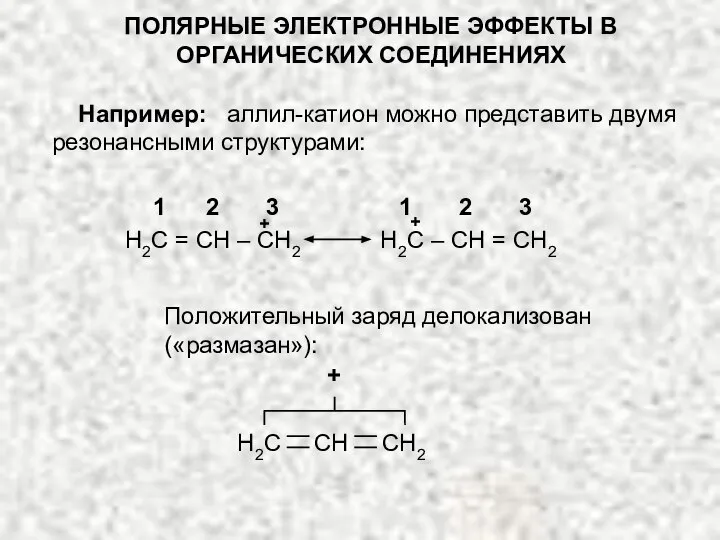
- 22. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Например: аллил-катион можно представить двумя резонансными структурами: Положительный заряд делокализован
- 23. ПОЛЯРНЫЕ ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Положения теории резонанса 1) Если молекула может быть представлена двумя
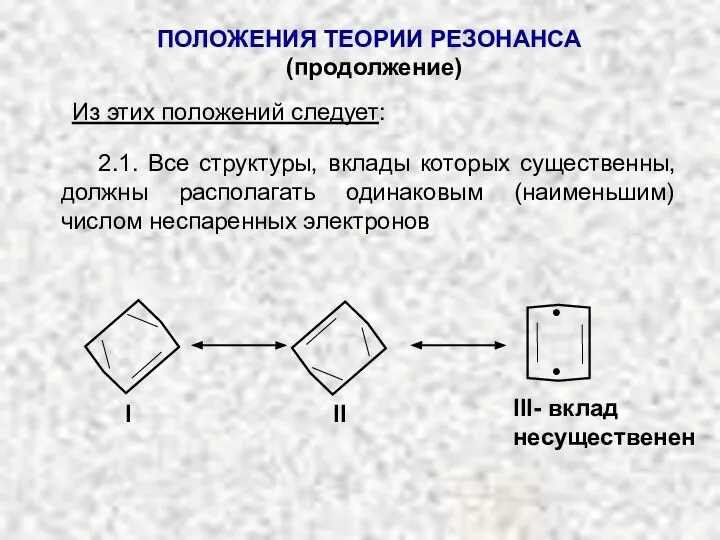
- 24. ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА (продолжение) Из этих положений следует: 2.1. Все структуры, вклады которых существенны, должны располагать
- 25. ПОЛОЖЕНИЯ ТЕОРИИ РЕЗОНАНСА (продолжение) 2.2. Локализация заряда: из двух структур с разделёнными зарядами более устойчивой будет
- 26. 2.4. Соблюдение правила октета (полнота или неполнота заполнения октета): (II) Несмотря на то, что в структуре
- 27. Резонансный гибрид стабильнее чем любая из участвующих в резонансе структур. Такое увеличение устойчивости называют энергией резонанса.
- 29. Скачать презентацию





















 Презентация по Химии "Алкены." - скачать смотреть бесплатно_
Презентация по Химии "Алкены." - скачать смотреть бесплатно_ Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Энзимология. Структура и механизм действия ферментов. (Лекция 2)
Энзимология. Структура и механизм действия ферментов. (Лекция 2) Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Химическая термодинамика. (Лекция 4)
Химическая термодинамика. (Лекция 4) Фразеологизмы, которые пришли из химии
Фразеологизмы, которые пришли из химии ТВОРЦІ ХІМІЇ
ТВОРЦІ ХІМІЇ  Моносахариды, глюкоза
Моносахариды, глюкоза Биодеградируемые полимеры – продукты биотехнологии
Биодеградируемые полимеры – продукты биотехнологии Природные источники углеводородов
Природные источники углеводородов Виконала Гаєвська Зоряна Учениця 10 класу
Виконала Гаєвська Зоряна Учениця 10 класу  Теоретические аспекты
Теоретические аспекты Распределение химических веществ по классам
Распределение химических веществ по классам Металлы в нашей жизни
Металлы в нашей жизни Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Особенности химии фтора
Особенности химии фтора Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай
Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай  Экзогенная серия. Группа выветривания
Экзогенная серия. Группа выветривания Элементы симметрии кристаллических структур
Элементы симметрии кристаллических структур Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов
Подготовка воды к количественному химическому анализу. Количественное определение азота, аммиака, нитритов, нитратов Характеристика ядов, изолируемых минерализацией в клинической фармации
Характеристика ядов, изолируемых минерализацией в клинической фармации Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Нобелевские премии по химии
Нобелевские премии по химии Фации метаморфизма
Фации метаморфизма Химия и организм человека
Химия и организм человека Наука химия
Наука химия Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Комплексономертиялық титрлеу. Дәріс № 6
Комплексономертиялық титрлеу. Дәріс № 6