Содержание
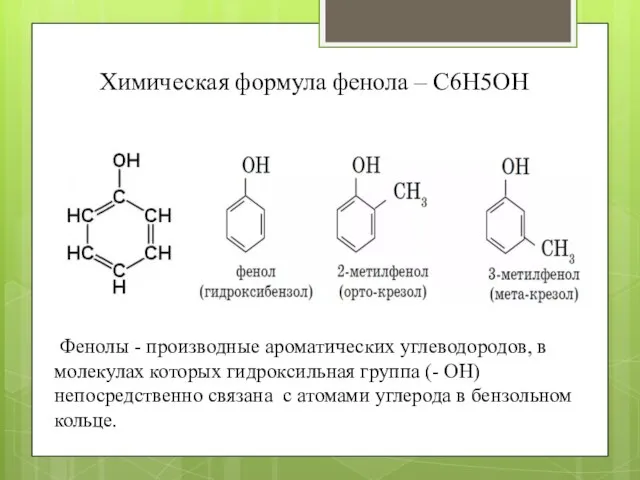
- 2. Химическая формула фенола – С6H5ОН Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (-
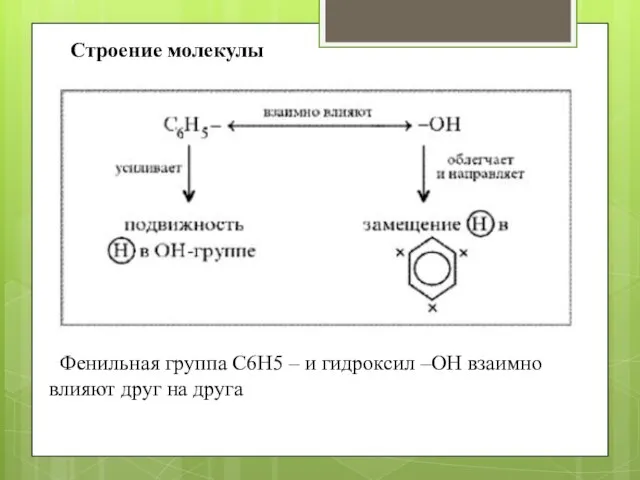
- 3. Строение молекулы Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
- 4. Не поделённая электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего
- 5. Химические свойства фенола I. Свойства гидроксильной группы Кислотные свойства – выражены ярче, чем у предельных спиртов
- 6. II. Свойства бензольного кольца 1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях
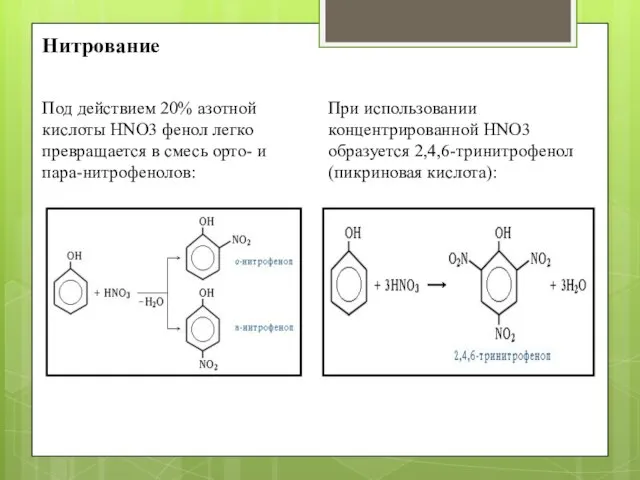
- 7. Нитрование Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов: При
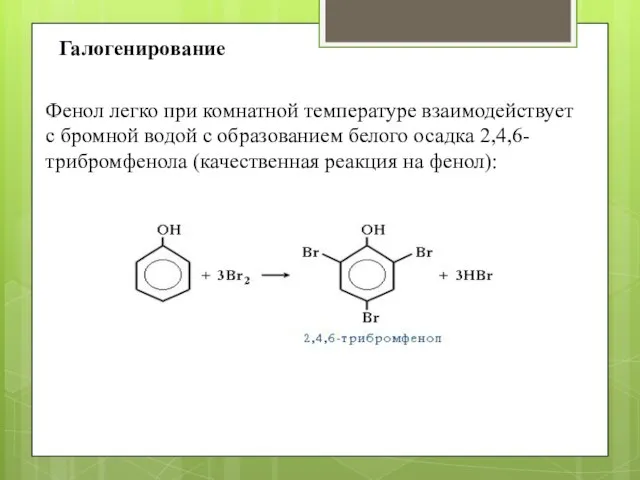
- 8. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция
- 9. Конденсация с альдегидами 2). Гидрирование фенола C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH -
- 10. Физические свойства Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой
- 11. Изомерия и номенклатура фенолов Возможны 2 типа изомерии: а) изомерия положения заместителей в бензольном кольце: б)
- 12. Токсические свойства Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые
- 13. Применение фенолов Производство синтетических смол, пластмасс, полиамидов; 2. Лекарственных препаратов; 3. Красителей; 4. Поверхностно-активных веществ; 5.
- 14. Строение молекулы Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга Неподеленная электронная
- 16. Скачать презентацию








 Обнаружение нитратов в растениях
Обнаружение нитратов в растениях ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна
ЗАСТОСУВАННЯ РІДКИХ КРИСТАЛІВ Виконала учениця 10 класу Гаєвська Зоряна  Резина и каучук
Резина и каучук Типы ингибирования и их характерные черты
Типы ингибирования и их характерные черты Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас
Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Бор (Borum)
Бор (Borum) Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь Количество вещества
Количество вещества Энергетика и направление химических реакций
Энергетика и направление химических реакций Химические реакции спиртов
Химические реакции спиртов Презентация по Химии "Утилизация попутного нефтяного газа" - скачать смотреть
Презентация по Химии "Утилизация попутного нефтяного газа" - скачать смотреть  Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі
Повітря. Основні забруднювачі: теплоенергетика, кольорова та чорна металургія, використання фреонів, підприємства будматеріалі Неорганические вещества в структуре питания
Неорганические вещества в структуре питания Применение нитратов
Применение нитратов Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) № 16. Аминокислоты
№ 16. Аминокислоты  Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Презентация по химии Количественный анализ Химические методы анализа
Презентация по химии Количественный анализ Химические методы анализа  Вещества и их системы. Смешивание растворов
Вещества и их системы. Смешивание растворов Нуклеофильные реакции. (Лекция 7)
Нуклеофильные реакции. (Лекция 7) Группа веществ, не требующих особых методов изолирования. (Лекция 15)
Группа веществ, не требующих особых методов изолирования. (Лекция 15) Применение муравьиного спирта
Применение муравьиного спирта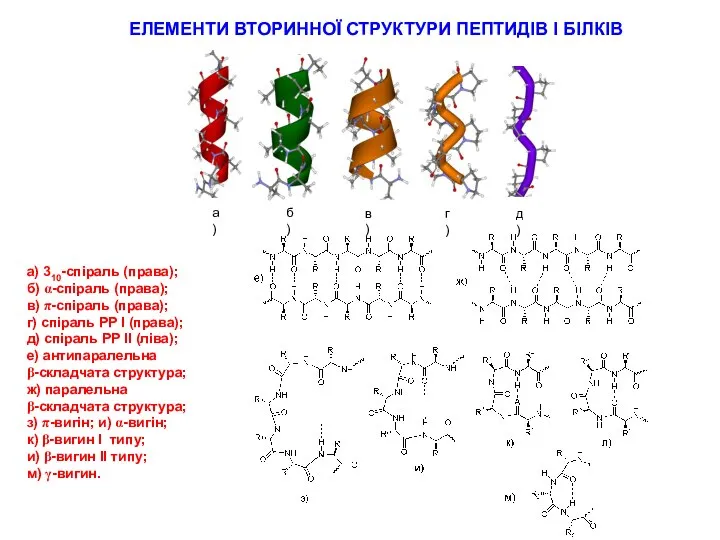 Елементи вторинної структури пептидів і білків
Елементи вторинної структури пептидів і білків Биогенные элементы периодической системы
Биогенные элементы периодической системы Химическая связь
Химическая связь