Содержание
- 2. План лекции 1. Теории химической связи 2. Основное и возбуждённое состояние электронов в атоме 3. Типы
- 3. 1. Теории химической связи Теория химической связи Бертоле: в основе химической связи лежит чисто гравитационное притяжение
- 4. Г.Льюис (1875 - 1946) В.Коссель (1888 - 1956) Электронная теория валентности
- 5. Электронная теория валентности Г.Н.Льюис и В.Коссель, 1916 Согласно электронной теории валентности, атомы, образуя связи, приближаются к
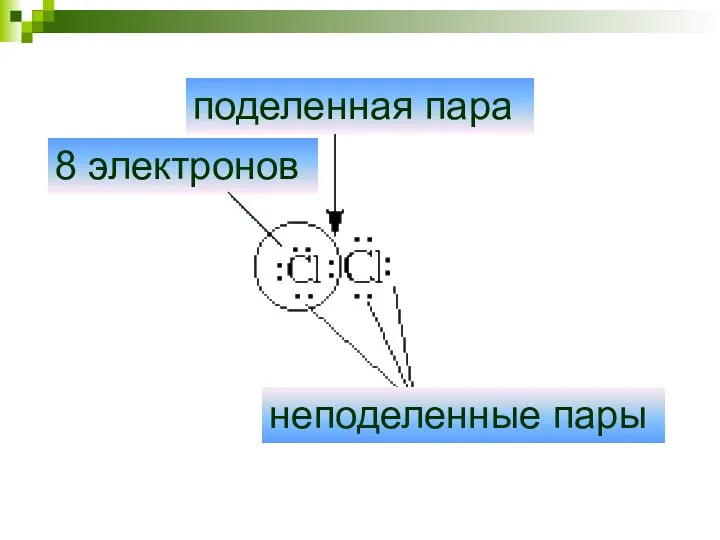
- 6. Правило октета - когда атом какого либо элемента образует химическую связь, обретая, теряя, обобществляя электроны, его
- 8. поделенная пара неподеленные пары 8 электронов
- 9. Современная теория химической связи базируется на трех основных методах: метод валентных связей ВС описывает химическую связь
- 10. Химическая связь – вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией, обуславливающих существование двух-
- 11. 2. Основное и возбуждённое состояние электронов в атоме
- 12. В ряде случаев с целью увеличения валентных возмож-ностей перед образованием химической связи атом перехо-дит в «возбужденное
- 13. Переход электронов при «возбуждении» атома возможен только в пределах одного энергетического уровня. Независимо от порядка заполнения
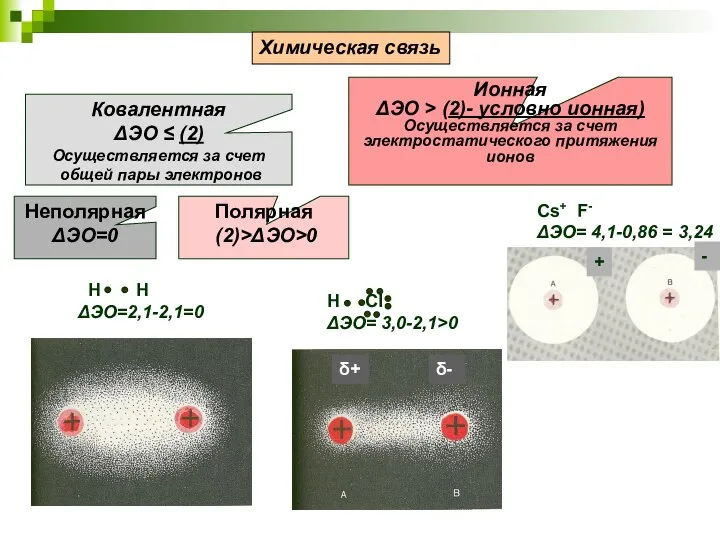
- 14. 3.Типы химических связей (ВС) Тип химической связи определяется степенью смещения общей электронной плотности к ядру одного
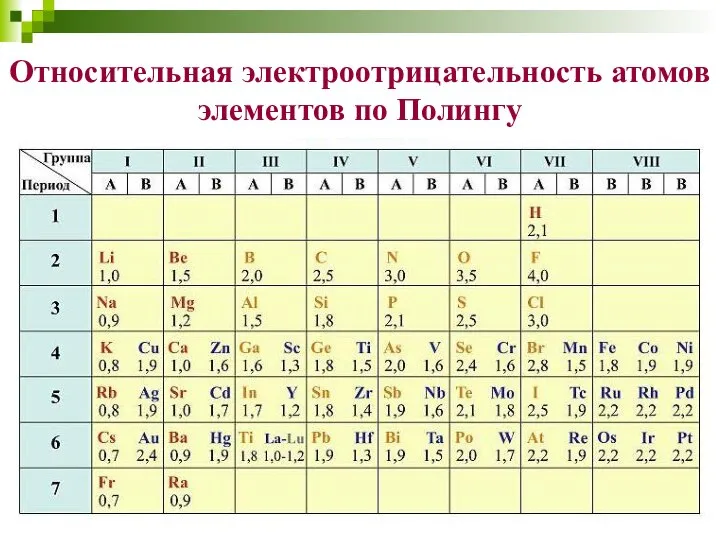
- 15. Относительная электроотрицательность атомов элементов по Полингу
- 16. Cs+ F- ΔЭО= 4,1-0,86 = 3,24 Химическая связь Ковалентная ΔЭО ≤ (2) Осуществляется за счет общей
- 17. Зависимость между Δэ.о. и степенью смещения общего электронного облака (%ионности)
- 18. Характер связей между атомами в молекулах Ковалентная неполярная – общее электронное облако расположено симметрично относительно ядер
- 19. Электроны, принимающие участие в образовании связи называются валентными. Na 1s22s22p63s1 Mg 1s22s22p6 3s2 O 1s22s22p4 As
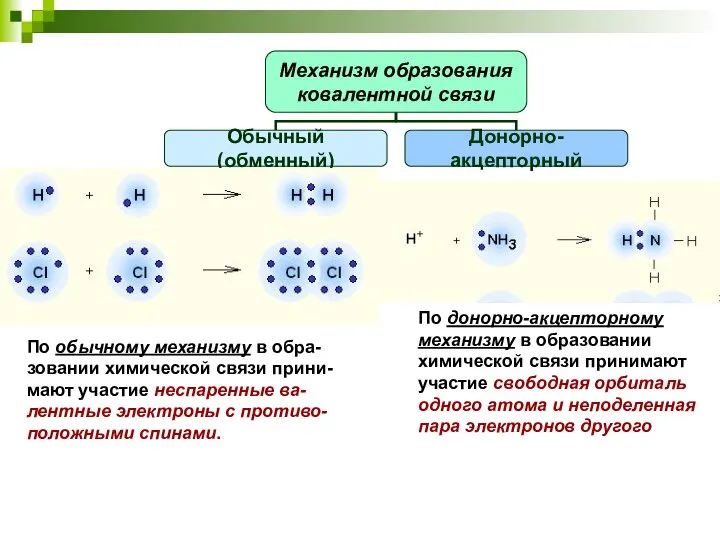
- 20. По обычному механизму в обра-зовании химической связи прини-мают участие неспаренные ва-лентные электроны с противо-положными спинами. По
- 21. Степень окисления – это условный заряд атома элемента в соединении, вычисленный, исходя из предположения, что соединение
- 22. 5. Основные характеристики химической связи Химическая связь характеризуется энергией, длиной и валентным углом. Энергия связи –
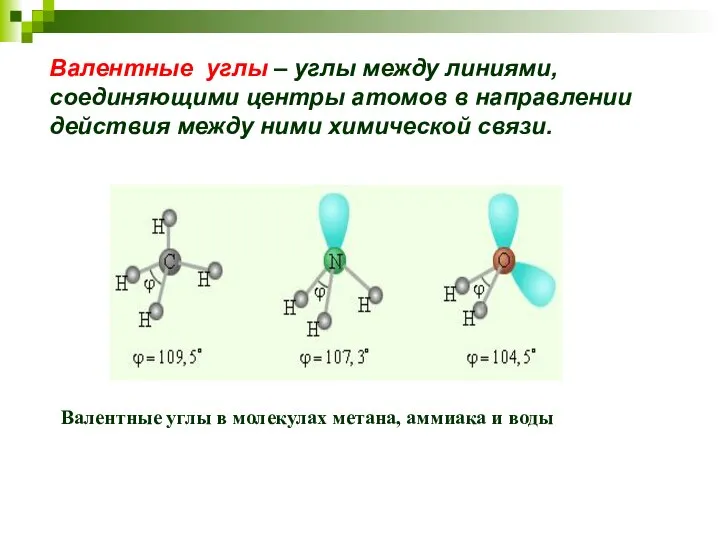
- 23. Валентные углы – углы между линиями, соединяющими центры атомов в направлении действия между ними химической связи.
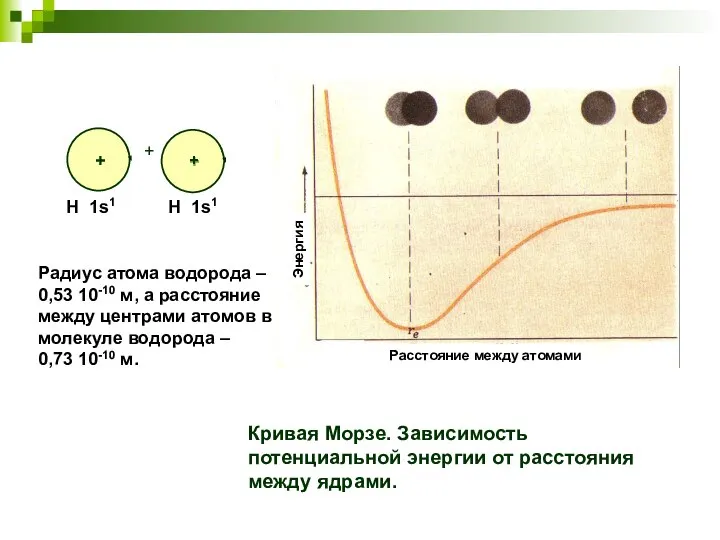
- 24. Радиус атома водорода – 0,53 10-10 м, а расстояние между центрами атомов в молекуле водорода –
- 25. Основные свойства ковалентной связи Химическая связь, образованная парой электронов, обобществляемых между двумя соседними атомами, называется ковалентной
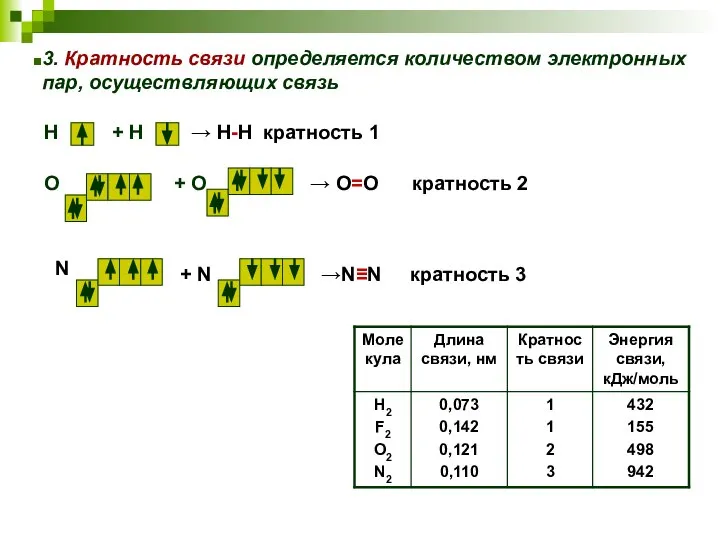
- 26. 3. Кратность связи определяется количеством электронных пар, осуществляющих связь Н + Н → Н-Н кратность 1
- 27. 4. Поляризуемость связи – способность молекулы с неполярной или малополярной связью становиться полярной под действием внешнего
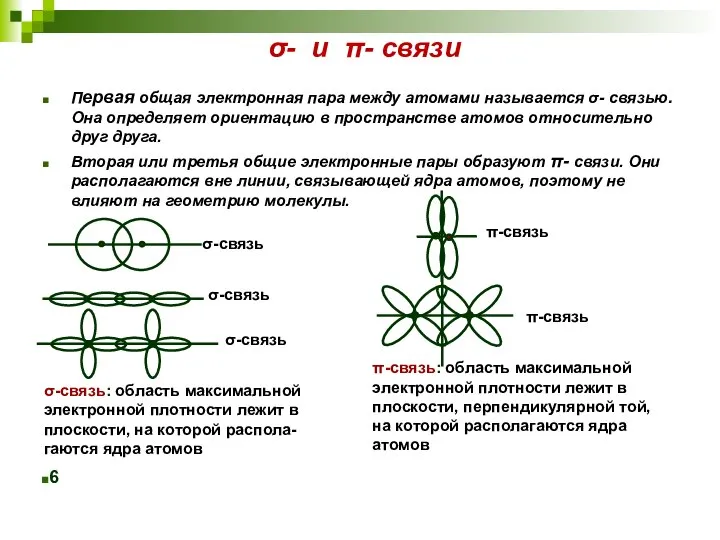
- 28. σ- и π- связи σ-связь: область максимальной электронной плотности лежит в плоскости, на которой распола- гаются
- 29. 6. Гибридизация орбиталей. Геометрическая форма молекул В молекуле все связи, независимо от того, каким электронами они
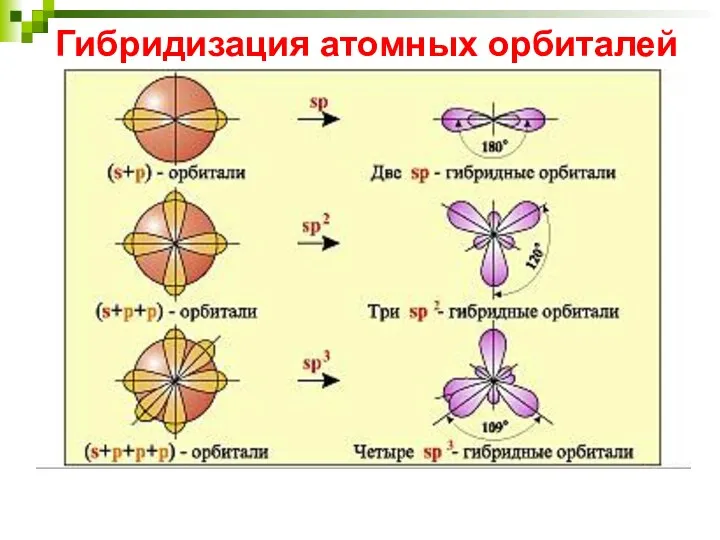
- 30. Гибридизация – это формальный прием, посредством которого можно предсказать геометрическую форму молекулы. Согласно гибридизации во многих
- 31. При гибридизации происходит перераспределение электронной плотности, которое требует затрат энергии. В результате гибридизации электронное облако вытягивается
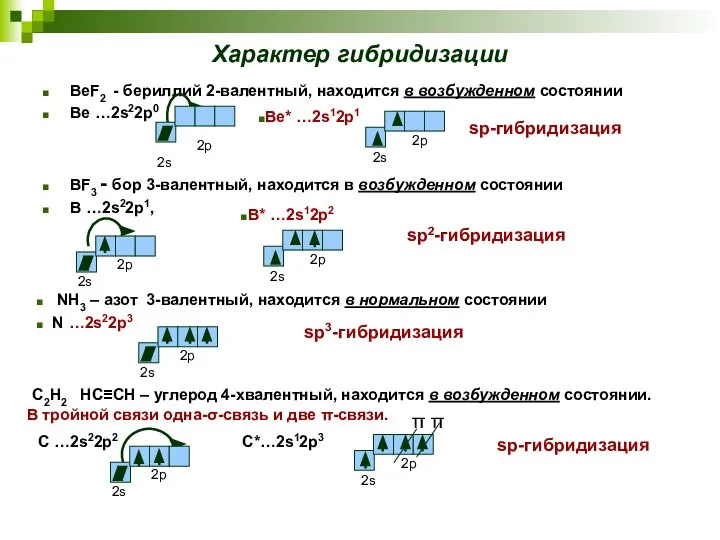
- 32. Характер гибридизации BeF2 - бериллий 2-валентный, находится в возбужденном состоянии Be …2s22p0 BF3 - бор 3-валентный,
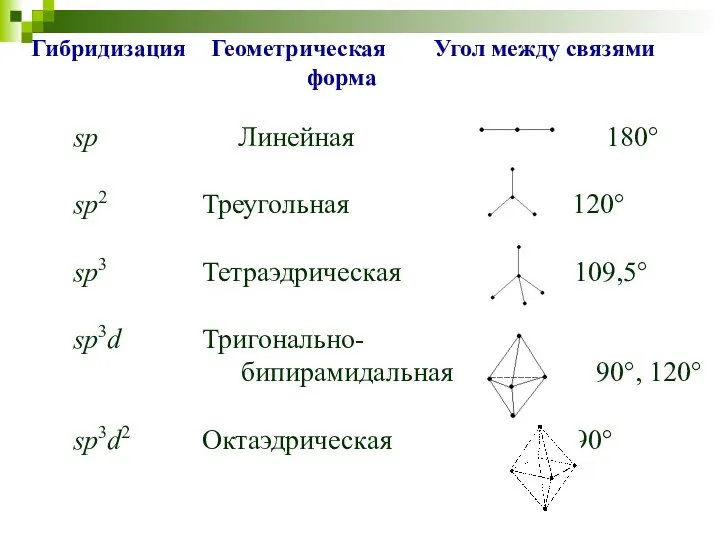
- 33. Гибридизация Геометрическая Угол между связями форма sp Линейная 180° sp2 Треугольная 120° sp3 Тетраэдрическая 109,5° sp3d
- 34. Гибридизация атомных орбиталей
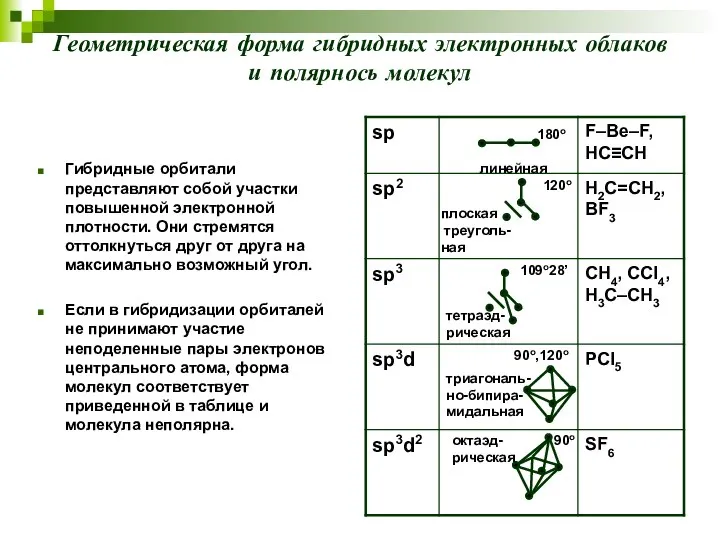
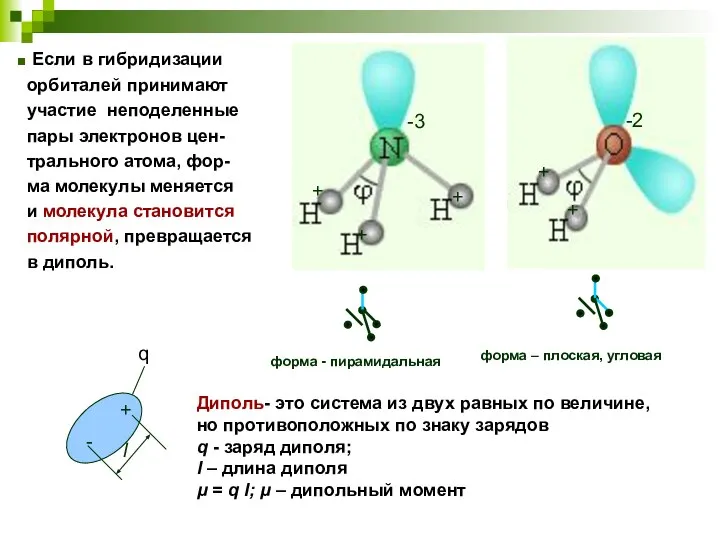
- 35. Геометрическая форма гибридных электронных облаков и полярнось молекул Гибридные орбитали представляют собой участки повышенной электронной плотности.
- 36. форма - пирамидальная форма – плоская, угловая Диполь- это система из двух равных по величине, но
- 37. Дипольные моменты молекул O=C=O H-Cl σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ+ σ-
- 38. ОПРЕДЕЛЕНИЕ ГЕОМЕТРИЧЕСКОЙ ФОРМЫ МОЛЕКУЛЫ 1. Привести графическую формулу молекулы и определить валентность её центрального атома. 2.
- 39. 7. Ионная связь Химическая связь, образованная за счет кулоновских сил притяжения между противоположно заряженными ионами, называется
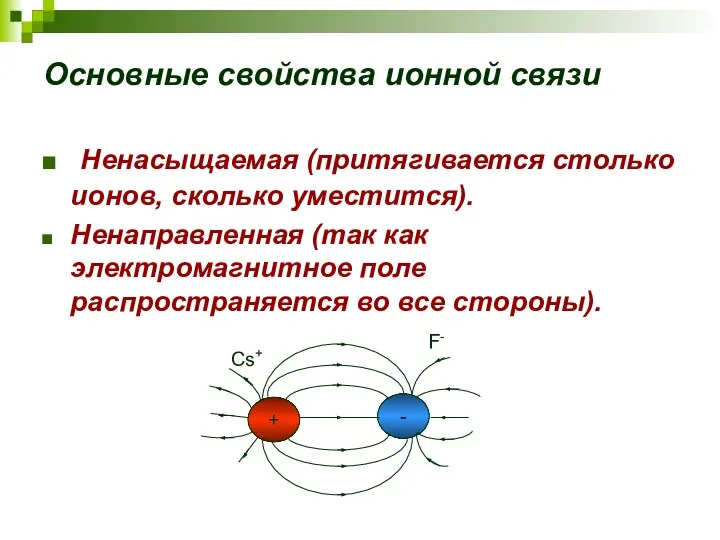
- 40. Основные свойства ионной связи Ненасыщаемая (притягивается столько ионов, сколько уместится). Ненаправленная (так как электромагнитное поле распространяется
- 42. Кристаллическая решетка ионного соединения Na Cl
- 43. Устойчивость ионных соединений Большинство ионных соединений устойчивы в виде кристаллических решеток. Энергия кристаллической решетки – энергия,
- 44. Na+(г) + Сl-(г) = Na+Cl-(тв) Энергия решетки = -787 кДж/моль Понижение энергии решетки – повышение устойчивости
- 45. Тест Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом 1. протонов 2. нейтронов 3.
- 46. Тест Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом 1. протонов 2. нейтронов 3.
- 47. В молекуле сероводорода все связи 1. ковалентные неполярные 2. ковалентные полярные 3. донорно – акцепторные 4.
- 48. В молекуле сероводорода все связи 1. ковалентные неполярные 2. ковалентные полярные 3. донорно – акцепторные 4.
- 49. В подгруппах с увеличением порядкового номера элемента ЭО 1. увеличивается 2. уменьшается 3. изменяется периодически 4.
- 50. В подгруппах с увеличением порядкового номера элемента ЭО 1. увеличивается 2. уменьшается 3. изменяется периодически 4.
- 51. Степень ионности связей возрастает в ряду 1. Na2O, BaO, CO2 2. H20, CH4, CaH2 3. BH3,
- 52. Степень ионности связей возрастает в ряду 1. Na2O, BaO, CO2 2. H20, CH4, CaH2 3. BH3,
- 53. Другие типы химической связи Металлическая связь Водородная связь Вандерваальсовы силы
- 54. 8. Металлическая связь Металлическая связь - химическая связь между атомами в металлическом кристалле, возникающая за счёт
- 57. 9. Водородная связь Образование водородной связи обусловлено тем, что в результате сильного смещения электронной пары к
- 58. Водородная связь - форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим
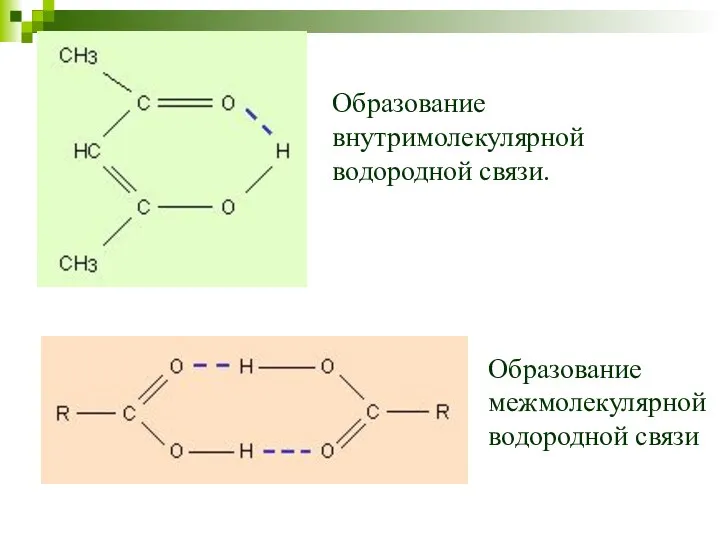
- 59. Образование внутримолекулярной водородной связи. Образование межмолекулярной водородной связи
- 60. Слабые и сильные водородные связи Слабые водородные связи (водородные связи в воде, аммиаке, метаноле) Сильные водородные
- 61. Вопросы к лекции Дайте определение понятию «химическая связь». Каковы два обязательных условия образования ковалентной связи. Покажите
- 62. 7.Какая характеристика служит мерой полярности молекулы? Как она определяется? Каковы пределы ее значений для неполярных и
- 64. Скачать презентацию














































 ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА» Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Биогеотехнология
Биогеотехнология Скорость химической реакции (химическая кинетика )
Скорость химической реакции (химическая кинетика ) Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Валентность. Правила составления формул бинарных соединений
Валентность. Правила составления формул бинарных соединений Химические компоненты клетки. Неорганические компоненты
Химические компоненты клетки. Неорганические компоненты Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно
Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно Генетика человека с основами медицинской генетики.(Лекция 2)
Генетика человека с основами медицинской генетики.(Лекция 2) Гели (Студни)
Гели (Студни) Сероводород в природе. Получение сероводорода синтетическим способом
Сероводород в природе. Получение сероводорода синтетическим способом Операции термической обработки
Операции термической обработки Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин 9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Алмазы, искусственный и естественный рост
Алмазы, искусственный и естественный рост Своя Игра Химия
Своя Игра Химия Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Основные виды и понятия курса органической химии в старшей школе
Основные виды и понятия курса органической химии в старшей школе Anionic Polymerization
Anionic Polymerization Ліпіди. Класифікація ліпідів
Ліпіди. Класифікація ліпідів Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Chemical physics. Atomic structure
Chemical physics. Atomic structure Сплавы
Сплавы