Содержание
- 2. C6H12O6 + 6O2 = 6CO2 + 6H2O + 673 ккал/моль CuSO4 + H2O + 2* 96500
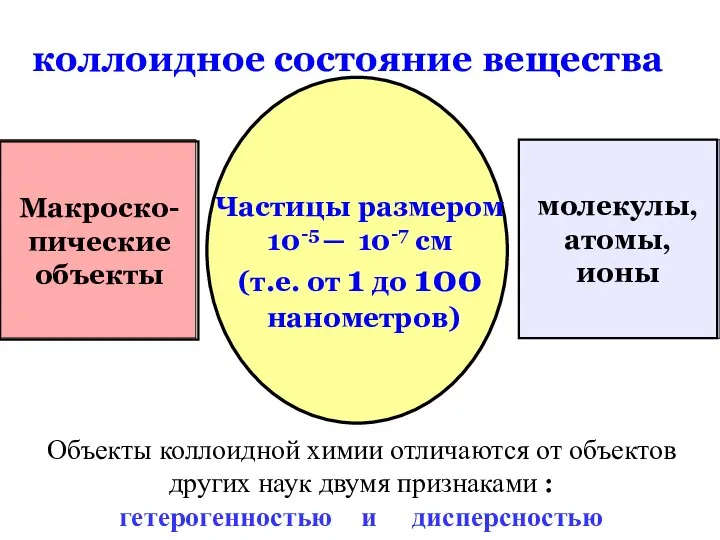
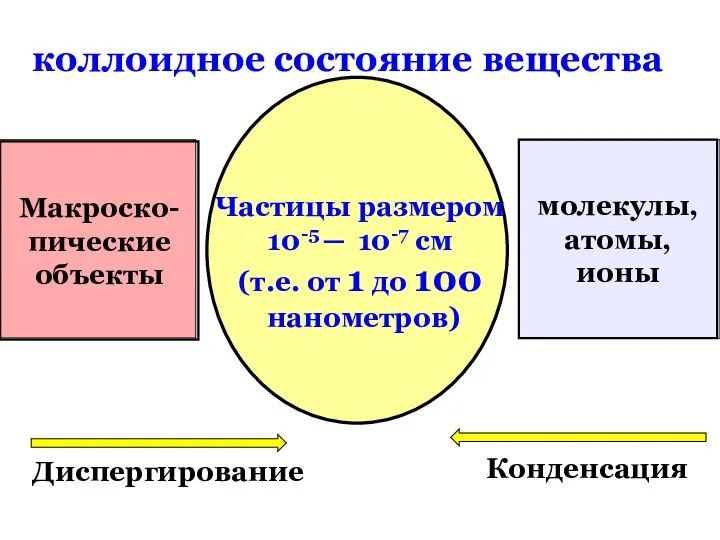
- 3. коллоидное состояние вещества Макроско- пические объекты молекулы, атомы, ионы Частицы размером 10-5 ─ 10-7 см (т.е.
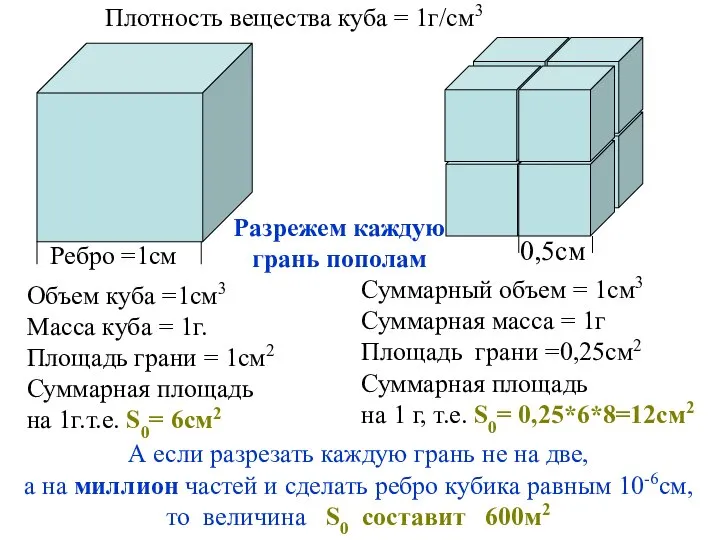
- 4. Плотность вещества куба = 1г/см3 Ребро =1см Объем куба =1см3 Масса куба = 1г. Площадь грани
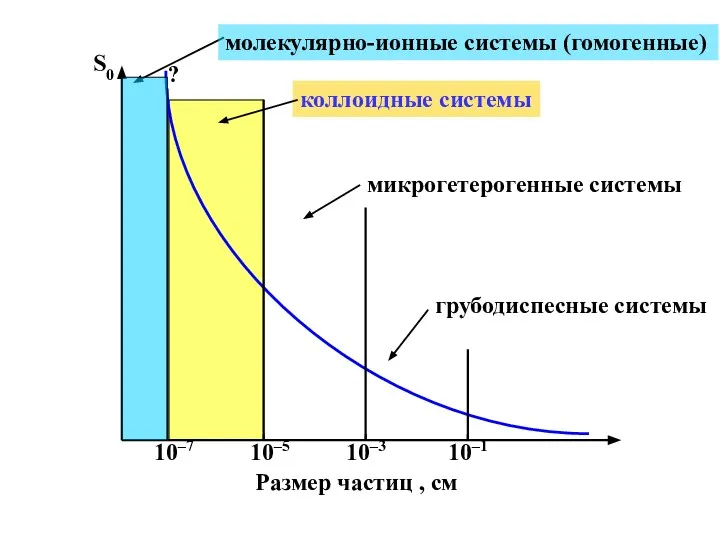
- 5. S0 Размер частиц , см 10–7 10–3 10–5 10–1 молекулярно-ионные системы (гомогенные) коллоидные системы микрогетерогенные системы
- 6. Ионы
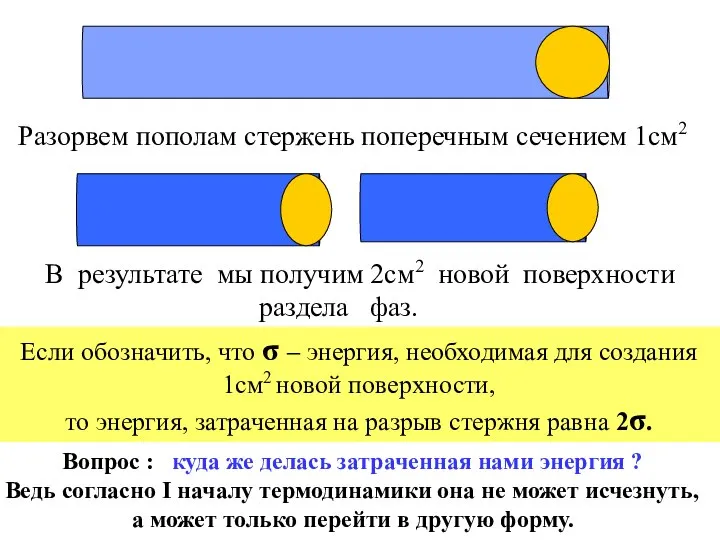
- 7. Разорвем пополам стержень поперечным сечением 1см2 В результате мы получим 2см2 новой поверхности раздела фаз. Если
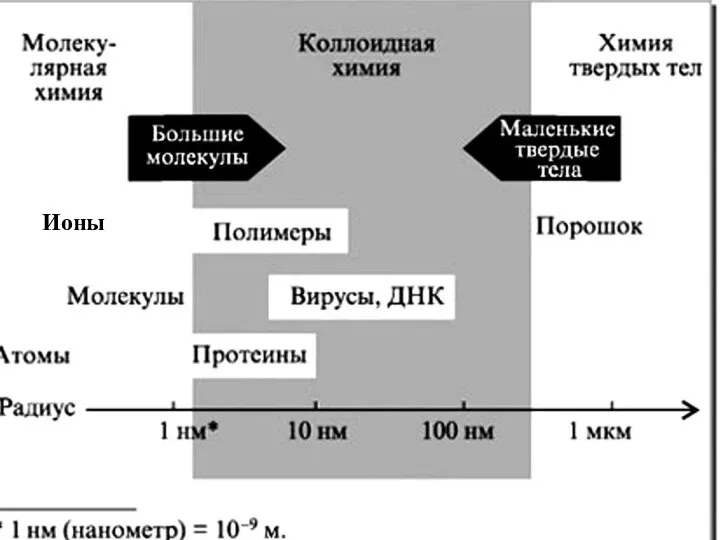
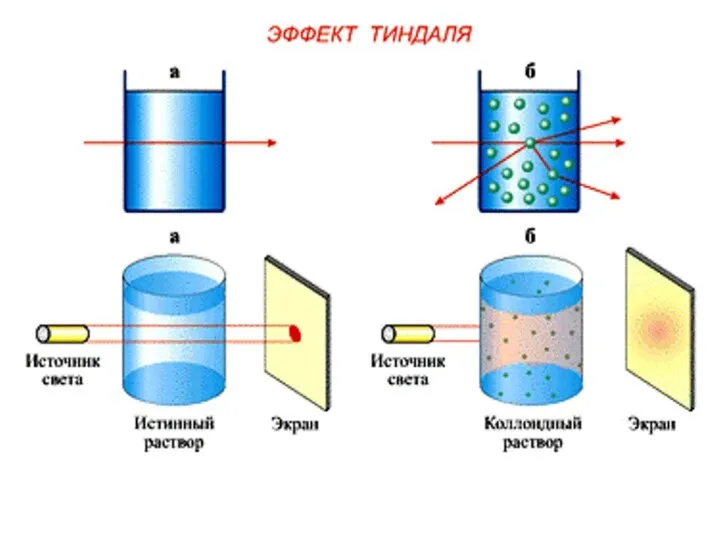
- 8. i Коллоидная химия - это наука о физико-химических свойствах гетерогенных высокодисперсных систем. Действительно, эта энергия осталась
- 9. Что касается физико-химической части нашего курса, то мы разберем следующие вопросы: электропроводность растворов электролитов; 2) принципы
- 10. 2) Живой клетке , чтобы не погибнуть, необходимо добывать энергию из окружающей среды, транспортировать её в
- 11. Заметим , что в отличие от самопроизвольно протекающих реакций , которые идут за счет уменьшения свободной
- 12. Процессы обратимого трансформирования химической энергии в иные её виды (в первую очередь, в электрическую и механическую)
- 13. Электропроводность растворов электролитов. Cуществуют два вида проводников : проводники первого рода , в которых переносчиками электрического
- 14. На границе двух проводников , один из которых первого, а другой – второго рода, обязательно протекает
- 15. Удельная электропроводность (κ) . Один из основных законов электричества – закон Ома: (I.1) I = U
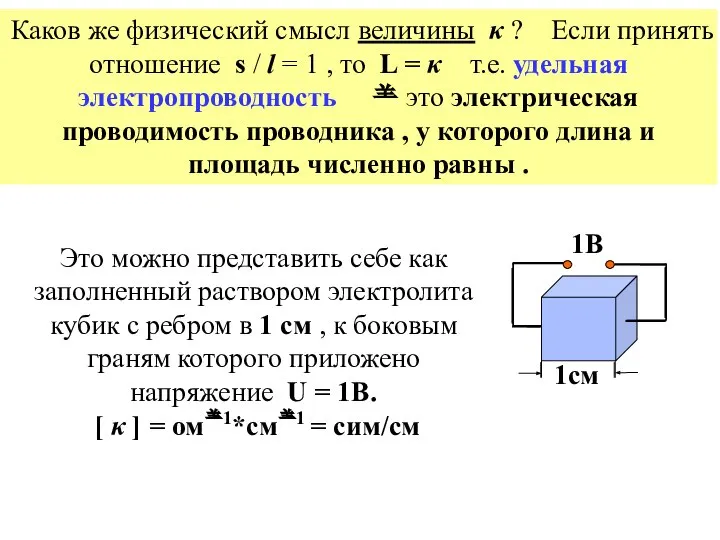
- 16. Каков же физический смысл величины κ ? Если принять отношение s / l = 1 ,
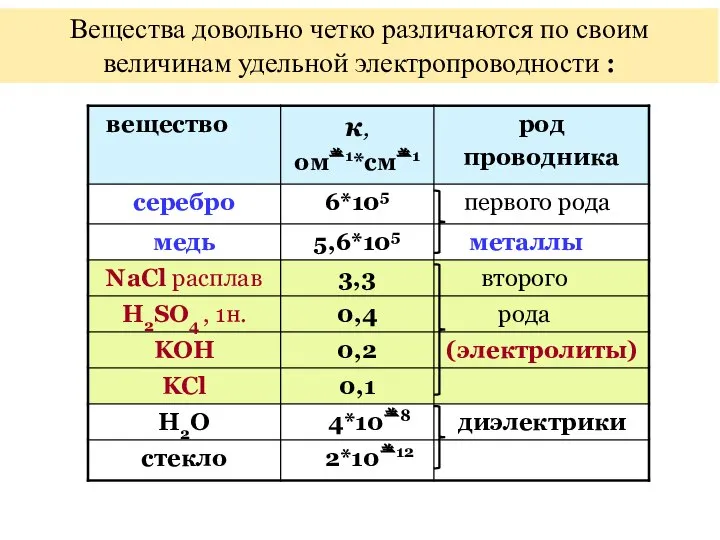
- 17. Вещества довольно четко различаются по своим величинам удельной электропроводности :
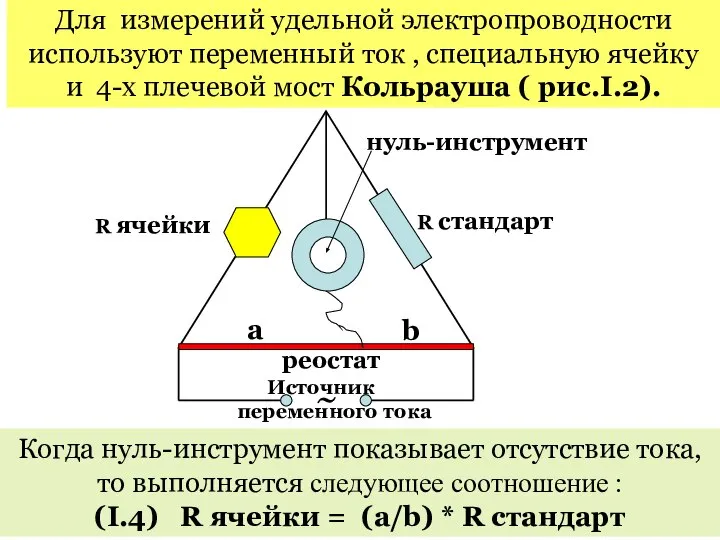
- 18. Для измерений удельной электропроводности используют переменный ток , специальную ячейку и 4-х плечевой мост Кольрауша (
- 19. Подставив (I.4) в (I.3) получим : b l κ = * (a*Rстанд) s Величина l /
- 20. Портативный кондуктометр SG7 профессиональный кондуктометр для для анализа технологических растворов в лаборатории и на производстве с
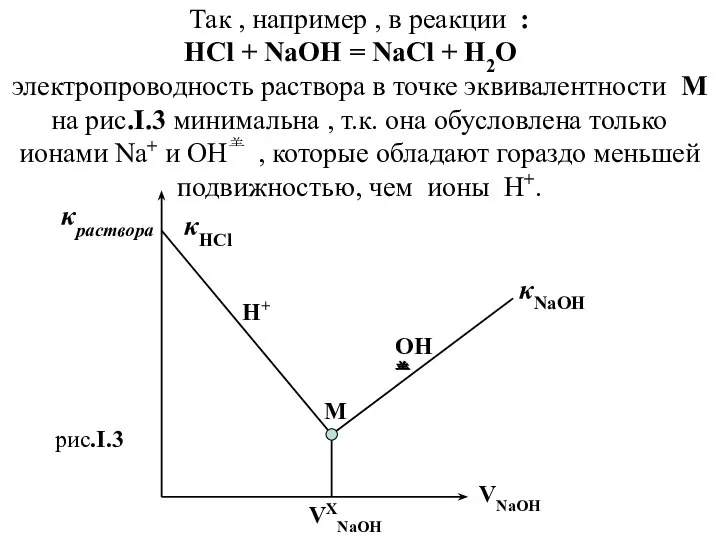
- 21. Так , например , в реакции : HCl + NaOH = NaCl + H2O электропроводность раствора
- 22. Метод потенциометрического титрования имеет ряд преимуществ, делающим его весьма привлекательным именно для медицинских исследований : a)
- 23. Удельная электропроводность растворов электролитов зависит от температуры, от состава раствора , от концентрации , от степени
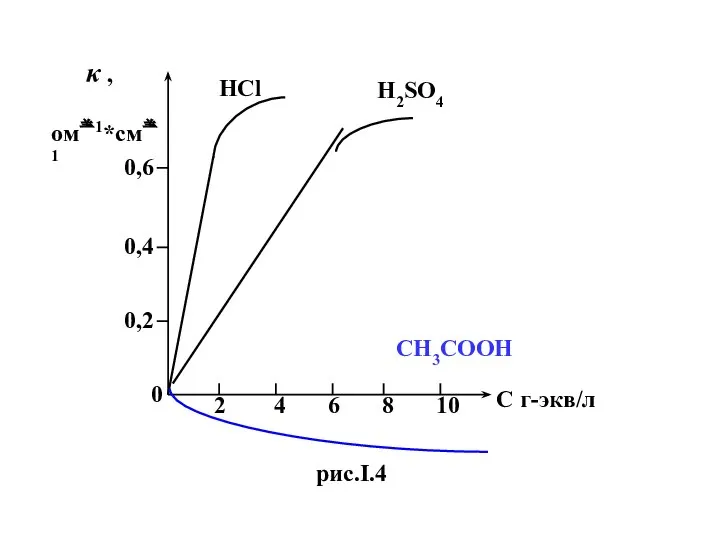
- 24. На первый взгляд из формулы (I.5) следует ,что удельная электропроводность (κ) должна линейно увеличиваться с ростом
- 25. 0 2 4 6 8 10 С г-экв/л κ , ом1*см1 0,6 0,4 0,2 HCl H2SO4
- 26. Для слабых электролитов ( CH3COOH) при малых концентрациях с ростом с растет и κ , т.к.
- 27. C учетом вышеизложенного становится ясно , что для удобства сопоставления электропроводностей разных электролитов было бы целесообразно
- 28. Эквивалентная электропроводность ( λ ) . κ * 1000 (I.6) λ = ────── , где: С
- 29. ( При этом площадь электродов должна быть такой , чтобы между ними поместился необходимый объем раствора
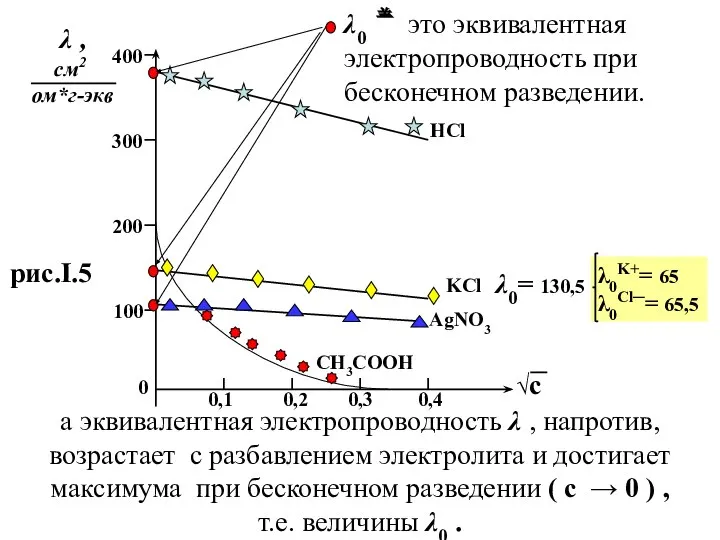
- 30. √с λ , см2 ом*г-экв 400 300 200 100 0 0,1 0,2 0,3 0,4 HCl KCl
- 31. Кольрауш предложил разделить все электролиты по их зависимости λ от √ с на три группы :
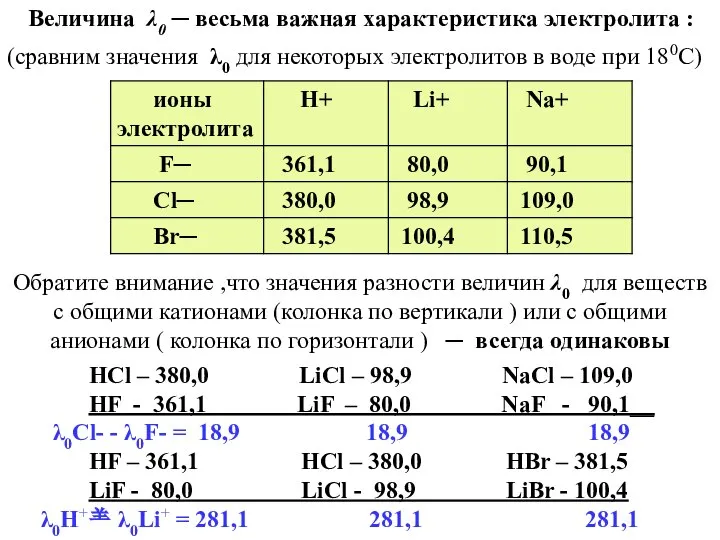
- 32. Величина λ0 ─ весьма важная характеристика электролита : (сравним значения λ0 для некоторых электролитов в воде
- 33. Сравнивая полученные нами данные , мы можем прийти к тому же выводу , к которому в
- 34. Важными следствиями закона Кольрауша являются : а) возможность расчета λ0 для слабого электролита на основе легко
- 35. Термодинамические функции состояния – это : 1) Внутренняя энергия: ΔU = Q ─ W ; 2)
- 36. Переход химической энергии в электрическую . Вывод уравнения Нернста . Запишем уравнение химической реакции , в
- 37. Нас же , напротив , интересует химическая реакция , в результате которой будет совершена полезная работа
- 38. Если реагирующие вещества и продукты реакции присутствуют в равновесных концентрациях , то ∆G = 0 ,
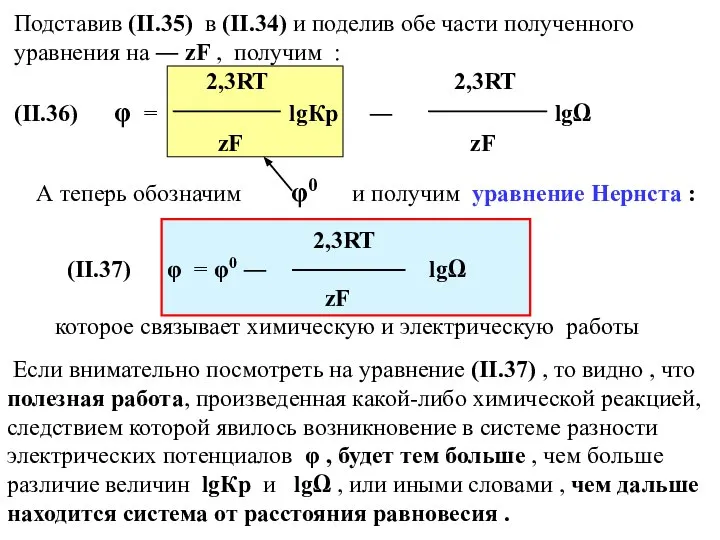
- 39. Подставив (II.35) в (II.34) и поделив обе части полученного уравнения на ― zF , получим :
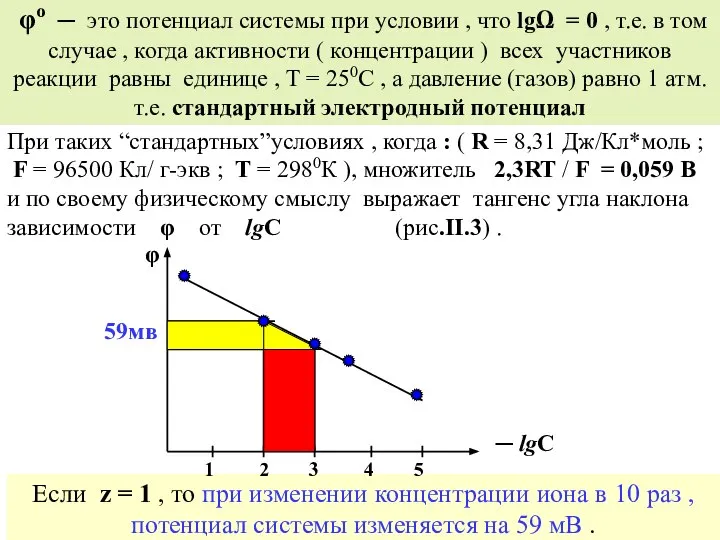
- 40. φо ─ это потенциал системы при условии , что lgΩ = 0 , т.е. в том
- 41. В настоящее время существует большой выбор портативных иономеров с ионселективными электродами, обратимыми относительно разных ионов, которые
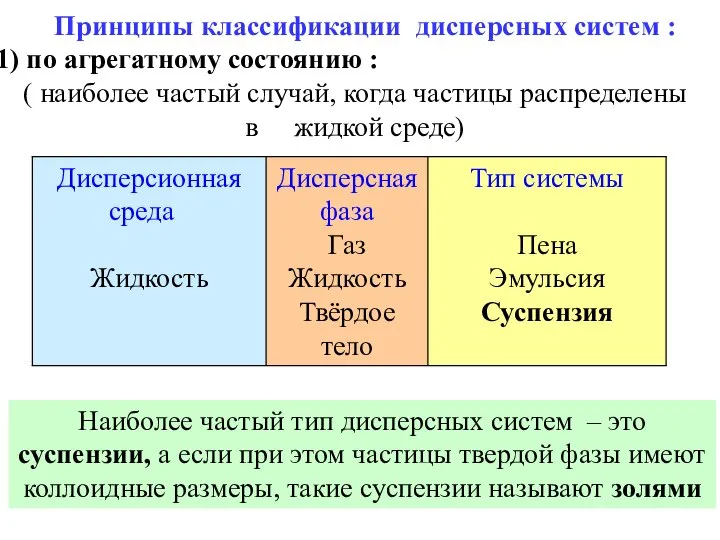
- 42. Принципы классификации дисперсных систем : по агрегатному состоянию : ( наиболее частый случай, когда частицы распределены
- 43. 3) по топографическому признаку : а) корпускулярные , где частицы имеют коллоидные размеры по всем трем
- 44. Например , клеточные мембраны имеют толщину ~ 10-6см ; нервы и мышцы имеют сечение 10-6 *
- 45. коллоидное состояние вещества Макроско- пические объекты молекулы, атомы, ионы Частицы размером 10-5 ─ 10-7 см (т.е.
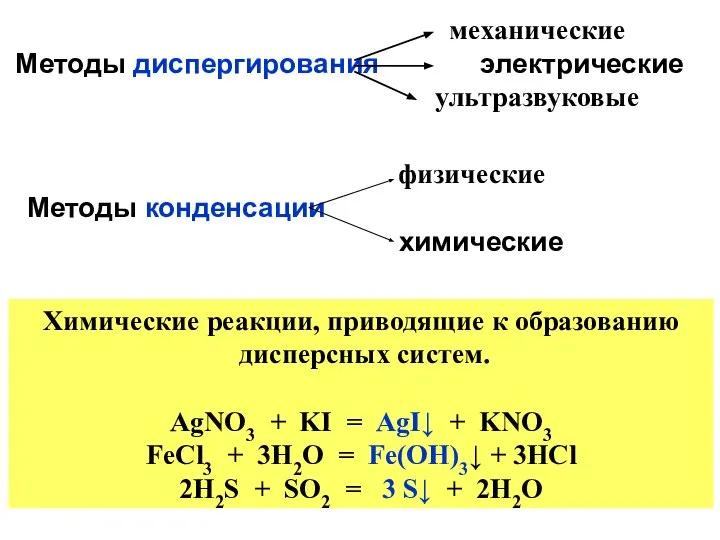
- 46. механические Методы диспергирования электрические ультразвуковые физические Методы конденсации химические Химические реакции, приводящие к образованию дисперсных систем.
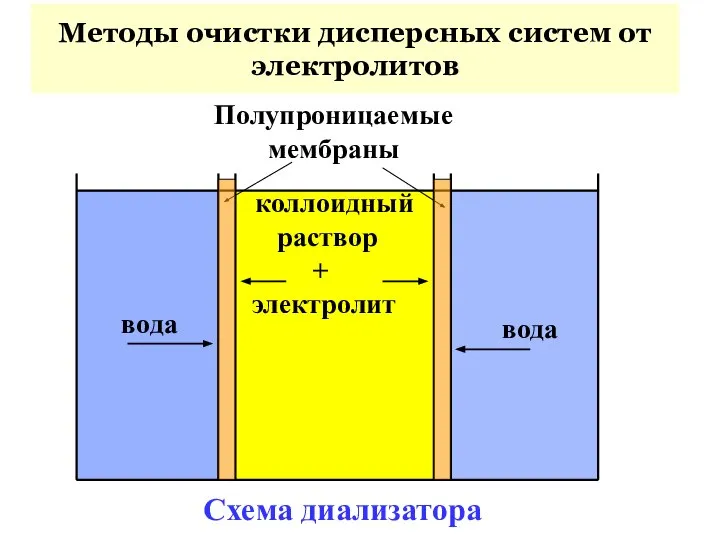
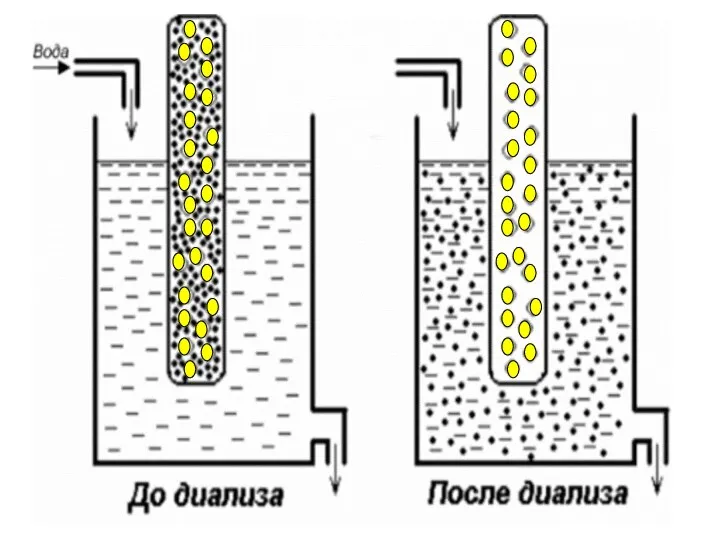
- 47. вода коллоидный раствор + электролит вода Полупроницаемые мембраны Схема диализатора Методы очистки дисперсных систем от электролитов
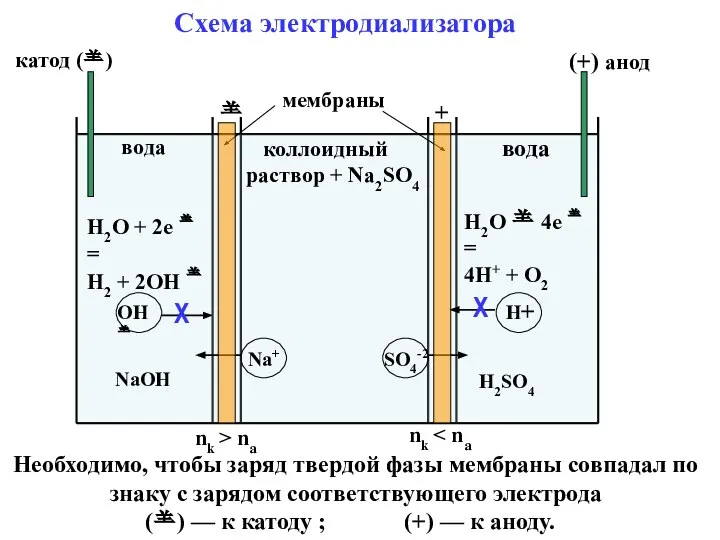
- 49. вода коллоидный раствор + Na2SO4 вода + катод () (+) анод мембраны nk > na
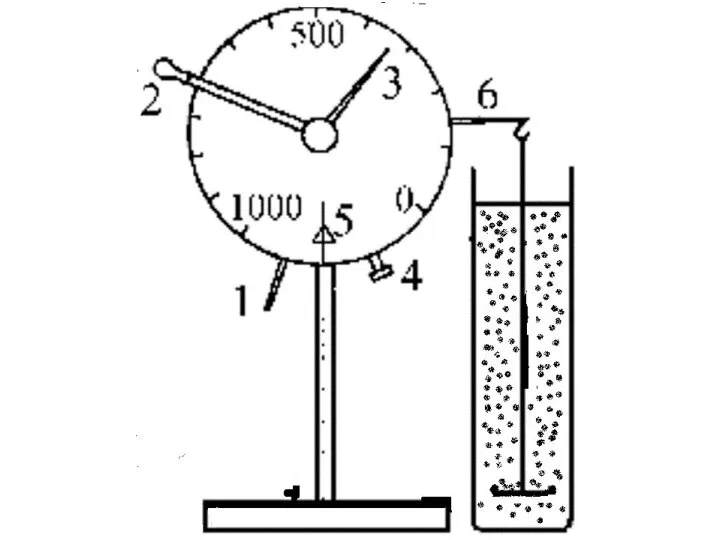
- 56. Седиментационные методы анализа основаны на исследовании процесса оседания частиц под действием силы тяжести . Когда частица
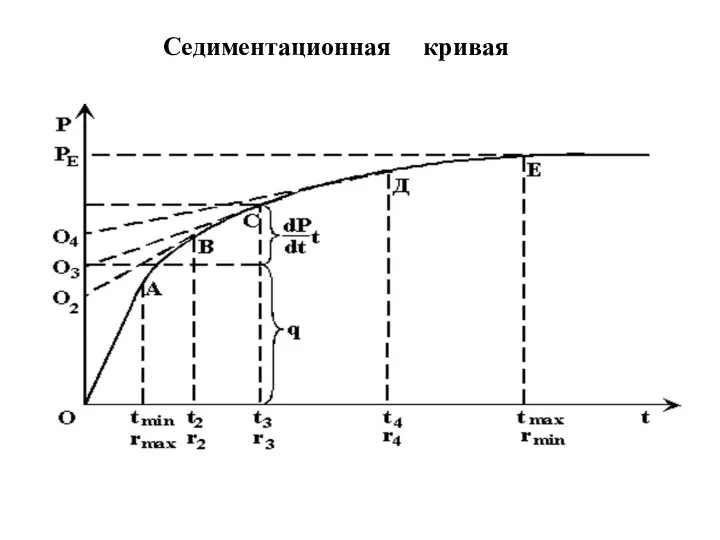
- 59. Cедиментационная кривая
- 60. Обычный микроскоп
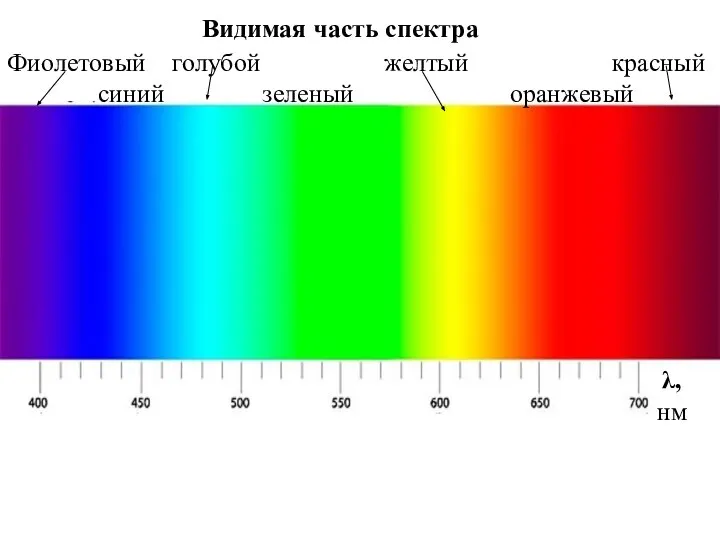
- 61. Видимая часть спектра Фиолетовый голубой желтый красный синий зеленый оранжевый λ, нм
- 62. Разрешающая способность обычного микроскопа λ (III.20) d = -------------- где : 2 n sin (α/2) λ
- 64. Скачать презентацию





































 Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно
Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно Методы синтеза коллоидных кристаллов. (Лекция 13)
Методы синтеза коллоидных кристаллов. (Лекция 13) Геохимия щелочных пикробазальтов хребта Хэнтэй
Геохимия щелочных пикробазальтов хребта Хэнтэй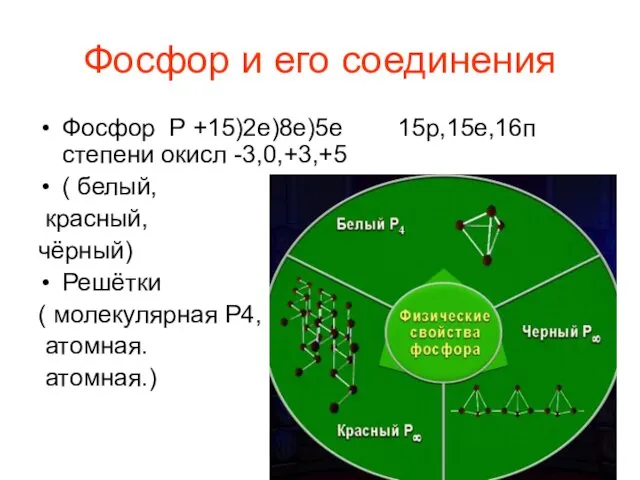 Фосфор и его соединения
Фосфор и его соединения Сложное вещество
Сложное вещество Органическая химия Скорость химических реакций
Органическая химия Скорость химических реакций  Тема урока «Важнейшие соединения серы». Цель: рассмотреть свойства важнейших соединений серы-сероводорода, оксидов серы (IV) и (V
Тема урока «Важнейшие соединения серы». Цель: рассмотреть свойства важнейших соединений серы-сероводорода, оксидов серы (IV) и (V Выполнила ученица 3 «Б» класса Юдина Валерия Руководитель Алистратова Н.В.
Выполнила ученица 3 «Б» класса Юдина Валерия Руководитель Алистратова Н.В. Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений
Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Кислоты, их классификация и свойства Презентация к уроку химии для 8 класса Учитель МОУ «Куженерская средняя общеобразовате
Кислоты, их классификация и свойства Презентация к уроку химии для 8 класса Учитель МОУ «Куженерская средняя общеобразовате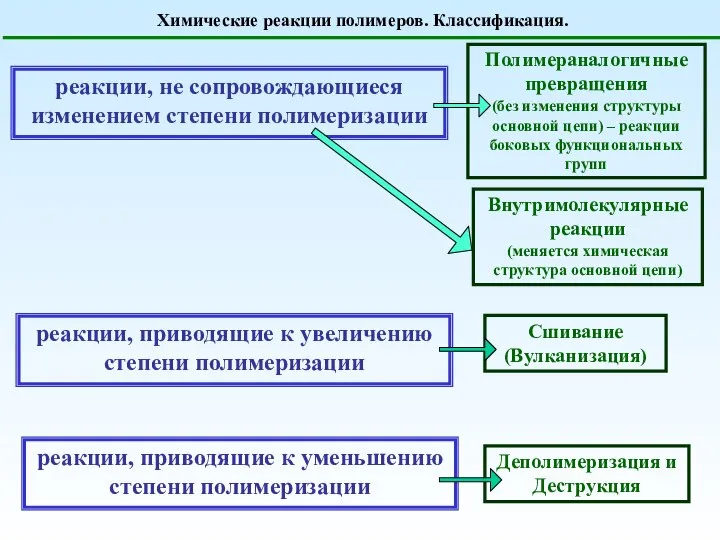 Химические реакции полимеров. Классификация
Химические реакции полимеров. Классификация Презентация по Химии "Оксиды: их свойства и применение" - скачать смотреть
Презентация по Химии "Оксиды: их свойства и применение" - скачать смотреть  Поверхностно-активные вещества
Поверхностно-активные вещества Почему протекают химические реакции
Почему протекают химические реакции Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика ХИМИЧЕСКИЕ ОПЫТЫ Виктория Кузнецова – viki.rdf.ru
ХИМИЧЕСКИЕ ОПЫТЫ Виктория Кузнецова – viki.rdf.ru  Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Алканы. Гомологический ряд
Алканы. Гомологический ряд Газообразное состояние вещества
Газообразное состояние вещества Химия. Роберт Бойль
Химия. Роберт Бойль Типы химических реакций в органической химии
Типы химических реакций в органической химии Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Отримання кисню. Властивості кисню
Отримання кисню. Властивості кисню Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Относительная молекулярная масса
Относительная молекулярная масса