Содержание
- 2. Цели урока: Сформировать представления учащихся о причинах протекания реакций; Научить учащихся рассчитывать тепловой эффект химических реакций
- 3. Задачи урока: Обучающая: познакомиться с понятия-ми «стандартная теплота образова-ния», «энтропия», «стандартная энергия Гиббса». Развивающая: развивать абстрактное
- 4. Проверим Правильные ответы Вариант 1: а, в, а, а, 5, б, г, в. Вариант 2: б,
- 5. Изучение нового материала Закон Гесса. Стандартные теплоты образования и сгорания. Расчет теплового эффекта реакции. Энтропия. Энергия
- 6. Закон Гесса. Тепловой эффект химической реакции не зависит от пути процесса, а только от вида и
- 7. Стандартные теплоты образования и сгорания. Для расчета теплового эффекта реакции Q используют стандартные теплоты образования Qобр
- 8. Стандартная теплота образования показывает, сколько кДж энергии выделилось или поглотилось при образовании 1 моль сложного вещества
- 9. Расчет теплового эффекта реакции. Расчеты теплового эффекта реакции проводятся согласно следствию из закона Гесса: тепловой эффект
- 10. Задача Найдите тепловой эффект реакции горения метана СH4. Первый способ - через стандартные теплоты образования. Запишем
- 11. Второй способ – через стандартные теплоты сгорания. Гораздо проще решить эту задачу через Qсгор. Так как
- 12. Энтропия. Кроме такой характеристики системы, как энтальпия H, существует энтропия S. С одной стороны, каждая система
- 13. Энергия Гиббса Разница ∆Н и T∆S называется энергией Гиббса. ∆G = ∆Н – T∆S [кДж/моль]. ∆Н
- 15. Скачать презентацию












 Простые вещества-металлы 9 класс
Простые вещества-металлы 9 класс Строение вещества. Строение атома и периодическая система элементов
Строение вещества. Строение атома и периодическая система элементов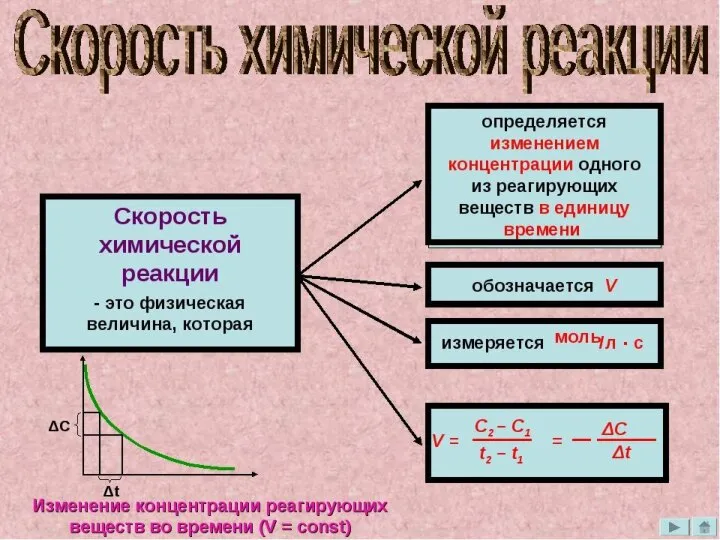 Скорость химичесой реакции и химическое равновесие
Скорость химичесой реакции и химическое равновесие Любимый Алюминий
Любимый Алюминий Нанопористые материалы
Нанопористые материалы Кислородосодержащие органические соединения (2 часть)
Кислородосодержащие органические соединения (2 часть) Электрофильные реакции
Электрофильные реакции Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл
Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл Производство биогаза из отходов животноводства и птицеводства
Производство биогаза из отходов животноводства и птицеводства Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Массовая доля вещества в растворе
Массовая доля вещества в растворе Ароматические углеводороды (арены). Бензол
Ароматические углеводороды (арены). Бензол Презентация по Химии "Хімія в побуті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в побуті" - скачать смотреть бесплатно Растворы. 11 класс
Растворы. 11 класс Метаморфические горные породы
Метаморфические горные породы Water vapor. Nitrous oxide. Aerosols
Water vapor. Nitrous oxide. Aerosols Побутова хімія У чому її користь, а у чому шкода?
Побутова хімія У чому її користь, а у чому шкода?  Структура и текстура горных пород
Структура и текстура горных пород Получение и свойства азота
Получение и свойства азота . Зонная модель электронной проводимости металлов С точки зрения электропроводности все вещества могут быть разделены на металлы (61036105)Ом-1 см-1, полупроводники = 102109 Ом1· см1 и диэлектрики 10101022 Ом1· см1. Качественное ра
. Зонная модель электронной проводимости металлов С точки зрения электропроводности все вещества могут быть разделены на металлы (61036105)Ом-1 см-1, полупроводники = 102109 Ом1· см1 и диэлектрики 10101022 Ом1· см1. Качественное ра Фолиевая кислота
Фолиевая кислота  Презентация по Химии "РАСТВОРЕНИЕ. РАСТВОРЫ" - скачать смотреть бесплатно
Презентация по Химии "РАСТВОРЕНИЕ. РАСТВОРЫ" - скачать смотреть бесплатно Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Спирты
Спирты Программа «Gaussian»
Программа «Gaussian» Основные понятия термодинамики фазовых равновесий. Фазовые равновесия в однокомпонентных системах
Основные понятия термодинамики фазовых равновесий. Фазовые равновесия в однокомпонентных системах Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль
Аминокислоты, пептиды, белки, нуклеиновые кислоты. Их биологическая роль