Содержание
- 2. Литература 1. Глинка Н.Л. Общая химия. М.; Интеграл – Пресс. 2009г. 728 с. 2. Коробейникова Е.Г.
- 3. Ознакомиться с физико-химическими и пожароопасными свойствами алифатических углеводородов, способами получения, областью применения в профессии. Цели занятия:
- 4. 1. Алифатические углеводороды, их физико-химические и пожароопасные свойства. 2. Сравнительная характеристика пожарной опасности углеводородов. 3. Галогенпроизводные
- 5. Многие органические соединения являются пожаро-взрывоопасными: - Природные газы: метан этан, пропан, бутан – горючие вещества. -
- 6. Углеводороды – органические вещества, состоящие из углерода и водорода. Алканы (предельные) – СnH2n+2 Алкены (непредельные) –
- 7. Алканы (предельные, насыщенные, парафиновые углеводороды) - соединения углерода с водородом, в которых атомы углерода связаны между
- 8. Гомологический ряд алканов
- 9. 1. Выделяют из природных источников (газ, нефть, каменный уголь, горючие сланцы) – ректификация. 2. Газификация угля:
- 10. Все алканы нерастворимы в воде. Плотность d С1 – С4 – газы; С5 – С15 –
- 11. Алканы малоактивны, не обесцвечивают бромную воду и KMnO4. Вступают в реакции: - замещения – галогенирования; -
- 12. Общее уравнение реакции горения углеводорода СmHn + (m+n/4)O2 = mCO2 + n/2H2O + Q, где m
- 13. Водород у алканов замещается на галогены по свободно-радикальному механизму: CH4 + CI2 → CH3CI + HCI
- 14. Горение: С5Н12 + 8(О2 + 3,76N2) + 5CO2 + 6H2O + 8 * 3,76 N2 Каталитическое
- 15. Метан СН4 – болотный, рудниковый газ. Взрывается с воздухом в пределах 4 – 16%об.при температуре 600
- 16. Алкены (непредельные, ненасыщенные, олефины) – соединения углерода с водородом, в которых атомы углерода связаны между собой
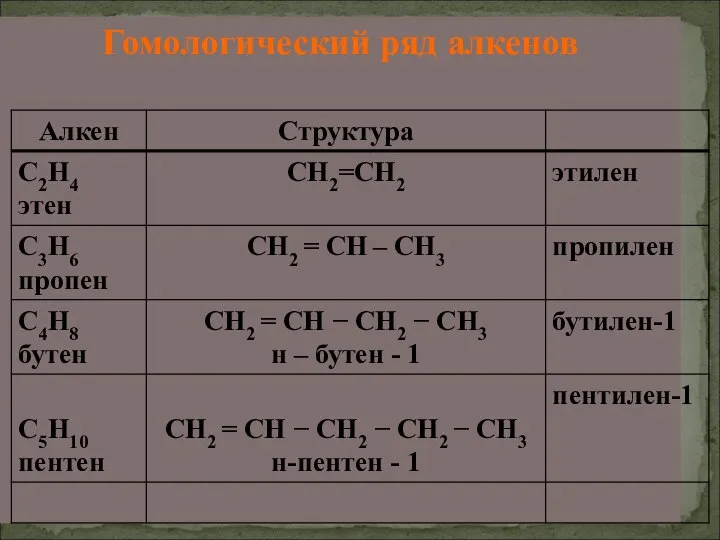
- 17. Гомологический ряд алкенов
- 18. Алкены обладают четырьмя видами изомерии: - углеродного скелета; - кратной (двойной) связи; - пространственной; - межклассовой.
- 19. С2 – С4 – газы; С5 – С17 – жидкости; С19 > твердые вещества. Нерастворимы в
- 20. Этилен и его гомологи химически активны. Вступают в реакции присоединения, окисления и полимеризации. Этилен горит коптящим
- 21. 1. Крекингом алканов: С8Н18 → С4Н8 + С4Н10 2. Дегалогенирование галогеналканов: СН2Br = CH2Br + Zn
- 22. Алкины – представитель ацетилен – С2Н2 Ацетилен С2Н2 – бесцв. газ, немного растворим в воде. Горючий
- 23. Вступают в реакции присоединения (ступенчато), разложения, полимеризации (тримеризация ацетилена: 3С2Н2 → С6Н6) Алкины горят ярким пламенем,
- 24. Бутадиен – 1,3. СН2=СН-СН=СН2 С4Н6 С4Н6 – газ, остальные диеновые – жидкости. Характерны реакции присоединения: СН2=СН-СН=СН2
- 25. 1. Из этилового спирта (реакция Лебедева): 2С2Н5ОН → СН2=СН-СН=СН2 + 2Н2О +Н2 бутадиен – 1,3 2.
- 26. Этан Этилен Этин Составить самостоятельно таблицу характеристики для трех газов, используя учебник Глинка Н.Л. по вопросам:
- 27. CH3CI CHCI3 CHI3 хлорметан хлороформ иодоформ Имеют характерный запах, многие обладают наркотическими свойствами. Температура кипения и
- 28. Реакцией замещения: С2Н6 + Br2 → C2H5Br + HBr Гидрогалогенирование: СН3 – СН = СН2 +
- 29. Хлороформ СНCl3 впервые был синтезирован в 1831 году одновременно Либихом и Субейраном. В 1848 году хлороформ
- 30. Хлористый этил (хлорэтан) С2Н5Сl при обычных условиях газ с температурой кипения +120С. При сравнительно небольшом охлаждении
- 31. Все углеводороды являются горючими. Некоторые окислители вызывают самовозгорание органических веществ при смешивании или соприкосновении. 3. Взрыво-пожароопасные
- 32. Ацетилен, метан и этилен в смеси с хлором самовозгорается: С2Н2 + Cl2 = 2HCI + 2C
- 33. Четыреххлористый углерод и четырехбромистый углерод дают со щелочными металлами взрыв при нагревании смеси до 65 –
- 34. Дополнить лекцию учебник Глинка Н.Л. С.561 -565. Построить 5 изомеров для С8Н14 указать класс вещества, назвать
- 36. Скачать презентацию
































 Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений «Уксусная кислота»
«Уксусная кислота»  Исследование минералов в параллельном свете с одним поляризатором
Исследование минералов в параллельном свете с одним поляризатором Биосфера и организм
Биосфера и организм Использование углеводородов в медицине
Использование углеводородов в медицине Хлор
Хлор Коррозия железа
Коррозия железа Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Model chemistry
Model chemistry Энергетические эффекты реакций
Энергетические эффекты реакций Карбоновые кислоты
Карбоновые кислоты Электронное строение атома
Электронное строение атома EdExcel Unit C2 – Discovering Chemistry
EdExcel Unit C2 – Discovering Chemistry Коррозионные повреждения
Коррозионные повреждения Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Насыщенные углеводороды
Насыщенные углеводороды Занимательные опыты
Занимательные опыты Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль Исследование качества питьевой воды в г. Кашира-8 и способы снижения ее общей жесткости
Исследование качества питьевой воды в г. Кашира-8 и способы снижения ее общей жесткости Гипергенез и почвообразование
Гипергенез и почвообразование Азот. Нахождение в природе
Азот. Нахождение в природе Минералы
Минералы Теоретические основы применения органических реагентов в качественном анализе. (Лекция 8)
Теоретические основы применения органических реагентов в качественном анализе. (Лекция 8) Разложение отходов. 11 класс
Разложение отходов. 11 класс Геохимия рудных месторождений
Геохимия рудных месторождений Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС
Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС Металлы в природе. Получение и применение металлов
Металлы в природе. Получение и применение металлов