Содержание
- 2. Оглавление Введение 1.Происхождение названия хлора 2.Открытие хлора 3.Строение атома хлора 4.Положение в таблице Менделеева 5.Соединения хлора
- 3. Введение Хлор - химический элемент, удушливый газ, употребляющиеся в технике и в санитарии как обеззараживающее средство
- 4. Происхождения названия хлора В 1811 г. Дэви предложил для нового элемента название «хлорин» (chlorine). Спустя год
- 5. Открытие хлора Чистый хлор был открыт в 1774 году немецко-шведским химиком Карлом Вильгельмом Шееле. Он был
- 6. Строение атома хлора Атом хлора состоит из положительно заряженного ядра (+17), состоящего из 17 протонов и
- 7. Положение в таблице Менделеева Принадлежит 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической
- 8. Соединения хлора Хлороводород образуется при взаимодействии хлора с водородом: H2+Cl2=t2HCl. Его можно также получить при действии
- 9. Химические свойства хлора Хлор - сильный окислитель. 1) Реакции с металлами: 2Na + Cl2 = 2NaCl
- 10. Применение хлора Хлор очень широко применяется как в быту, так и в промышленности. При помощи хлора
- 12. Скачать презентацию









 Мұнайлардың жіктелуі
Мұнайлардың жіктелуі Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Синтез полимерных комплексонов на основе аминокислот
Синтез полимерных комплексонов на основе аминокислот Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010
Работу выполнила: Пьянкова Елена Руководитель: Баранова Алевтина Владимировна 2010 Деление ядер урана
Деление ядер урана  Физические и химические явления
Физические и химические явления Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов
Моделирование электронной структуры и сенсорных свойств наноструктурированных смешанных оксидов Отношение масс элементов в веществе. Массовые доли элементов в веществе
Отношение масс элементов в веществе. Массовые доли элементов в веществе Витамины и коферменты
Витамины и коферменты Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Алкены
Алкены Моносахариды
Моносахариды Предмет химии. Вещества
Предмет химии. Вещества Карбоновые кислоты и их производные
Карбоновые кислоты и их производные Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования
Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования Метод изолирования Васильевой
Метод изолирования Васильевой Галогены
Галогены Хімія в побуті
Хімія в побуті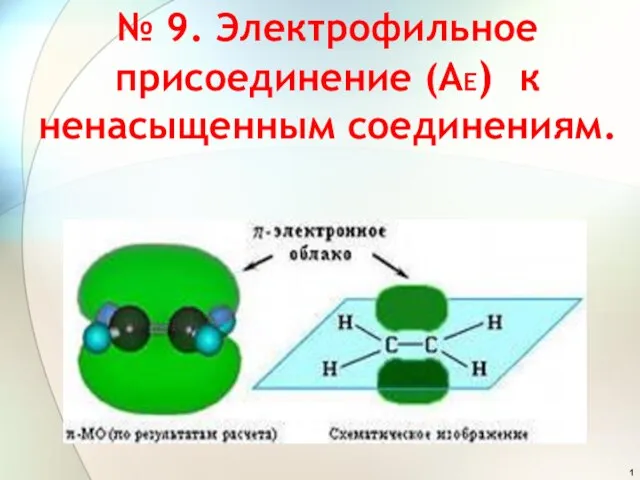 Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.
Презентация по химии Электрофильное присоединение (АЕ) к ненасыщенным соединениям.  Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Використання вуглеводнів
Використання вуглеводнів Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Алканы: изомерия и номенклатура
Алканы: изомерия и номенклатура Презентация по Химии "Закон збереження маси" - скачать смотреть
Презентация по Химии "Закон збереження маси" - скачать смотреть