Слайд 11

Применение
Фосфор является важнейшим биогенным элементом и в то же время находит
очень широкое применение в промышленности.
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
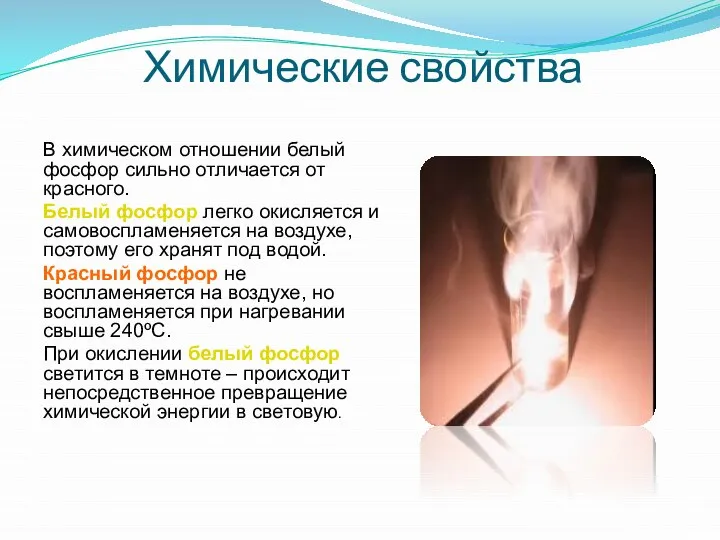
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
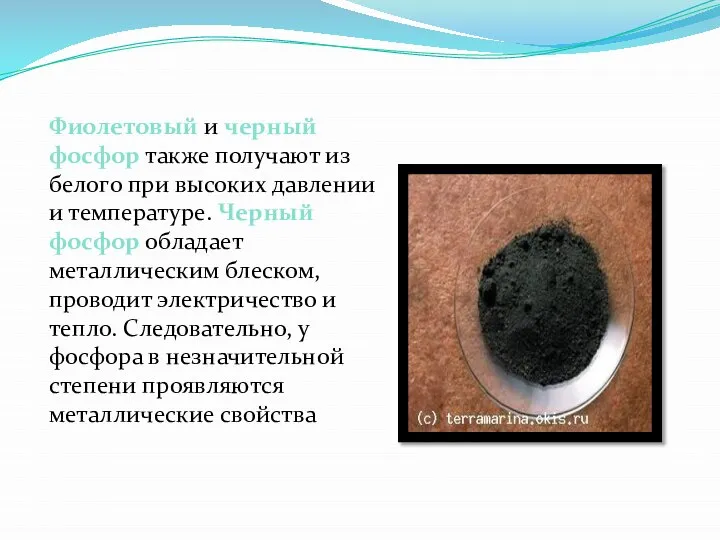
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
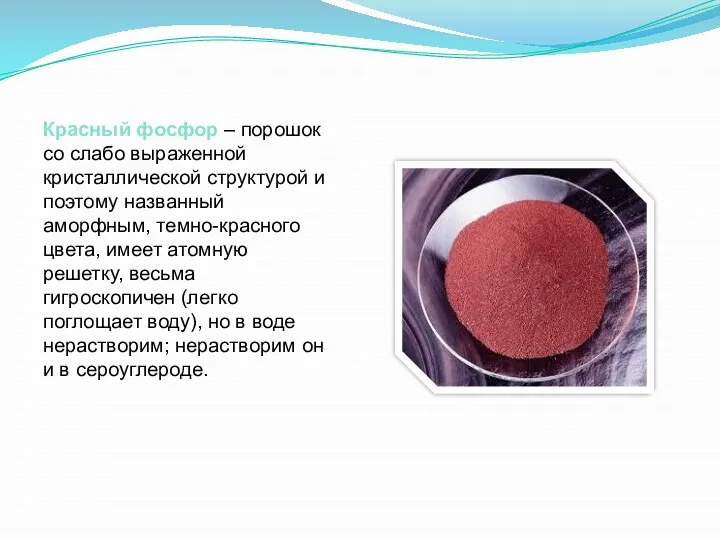
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.









 Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1
Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1 ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров
ВКР: Организация проведения товароведной экспертизы пищевкусовых товаров Значение теории химического строения А.М.Бутлерова
Значение теории химического строения А.М.Бутлерова  Основные стратегии регуляции метаболических путей
Основные стратегии регуляции метаболических путей Хімія для ремонту Лисенко Демид ; Понура Назар
Хімія для ремонту Лисенко Демид ; Понура Назар  Магній. Знаходження в періодичній системі і основні характеристики
Магній. Знаходження в періодичній системі і основні характеристики Типы химических реакций
Типы химических реакций Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть
Презентация по Химии "Предмет органической химии. Органические вещества" - скачать смотреть  Будівельні матеріали: скло, цемент, бетон, їх використання Виконала Учениця 10-А класу ЗОШ 1-3 ст. №1 Кулібаба Яна
Будівельні матеріали: скло, цемент, бетон, їх використання Виконала Учениця 10-А класу ЗОШ 1-3 ст. №1 Кулібаба Яна  Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Набухание наполненных полимеров
Набухание наполненных полимеров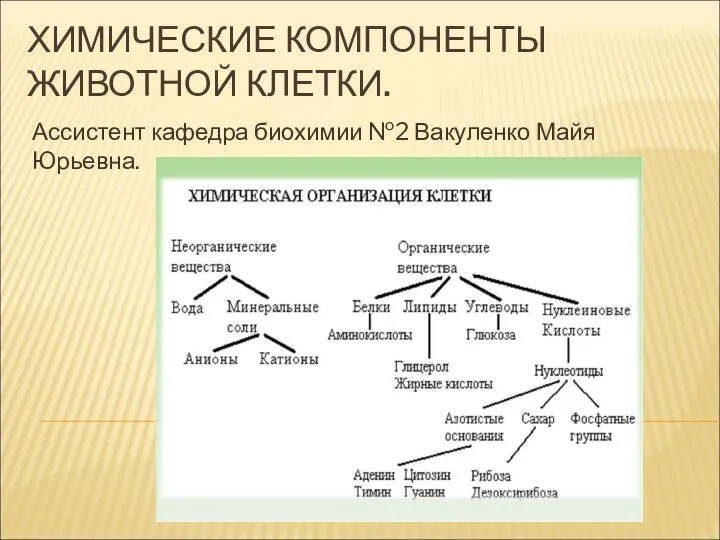 Химические компоненты животной клетки
Химические компоненты животной клетки Химия биогенных элементов
Химия биогенных элементов Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов Занимательная химия
Занимательная химия Аттестационная работа. Элективный курс Химия в доме
Аттестационная работа. Элективный курс Химия в доме Оцет Яковлев Олексій 11-В
Оцет Яковлев Олексій 11-В  Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель х
Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель х КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ 9 класс МКОУ «СОШ № 85» г. Тайшет Иркутской обл. Учитель: Никитюк Л.Ф.
КАЛЬЦИЙ И ЕГО СОЕДИНЕНИЯ 9 класс МКОУ «СОШ № 85» г. Тайшет Иркутской обл. Учитель: Никитюк Л.Ф. Бережём планету вместе. Нефть
Бережём планету вместе. Нефть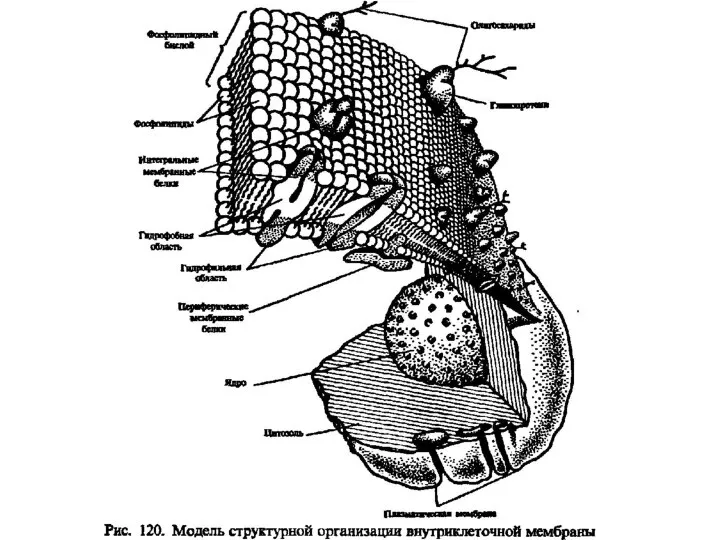 Липиды. Классификация липидов
Липиды. Классификация липидов Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах
Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах Пилинг фруктовыми кислотами
Пилинг фруктовыми кислотами Низкомолекулярные биорегуляторы терпены
Низкомолекулярные биорегуляторы терпены Каталитикалық риформинг
Каталитикалық риформинг