Содержание
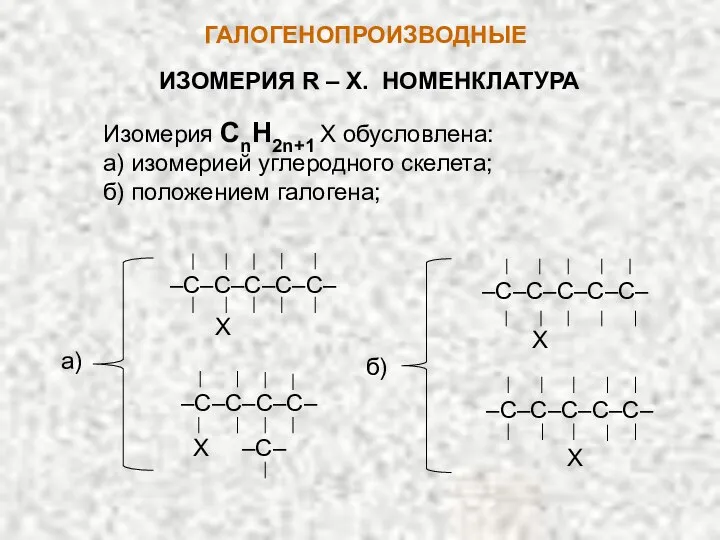
- 2. ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА Изомерия CnH2n+1 X обусловлена: а) изомерией углеродного скелета; б) положением
- 3. ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X Причем название X ставится либо перед, либо после названия радикала:
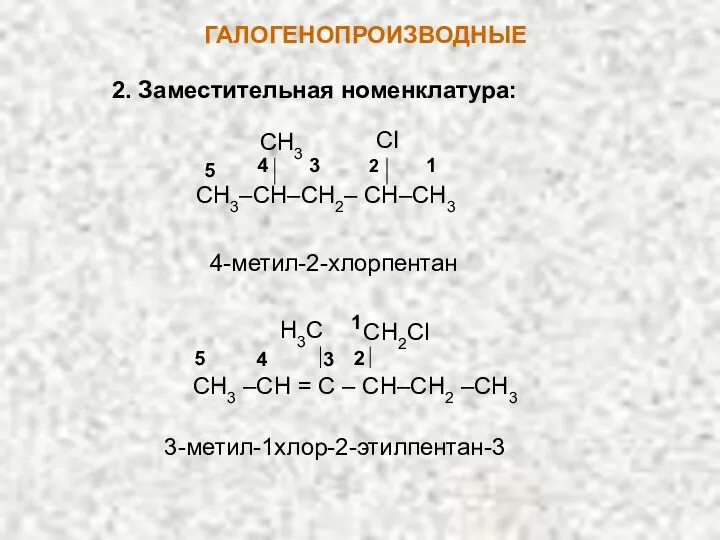
- 4. ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура:
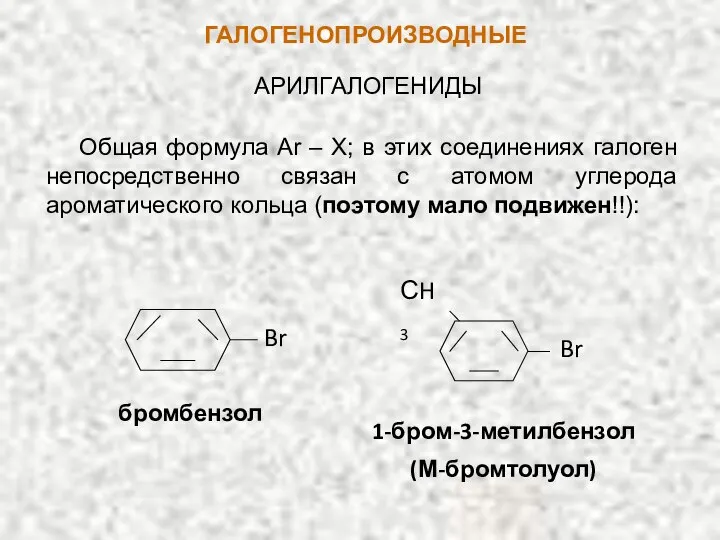
- 5. ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X; в этих соединениях галоген непосредственно связан с атомом углерода
- 6. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из
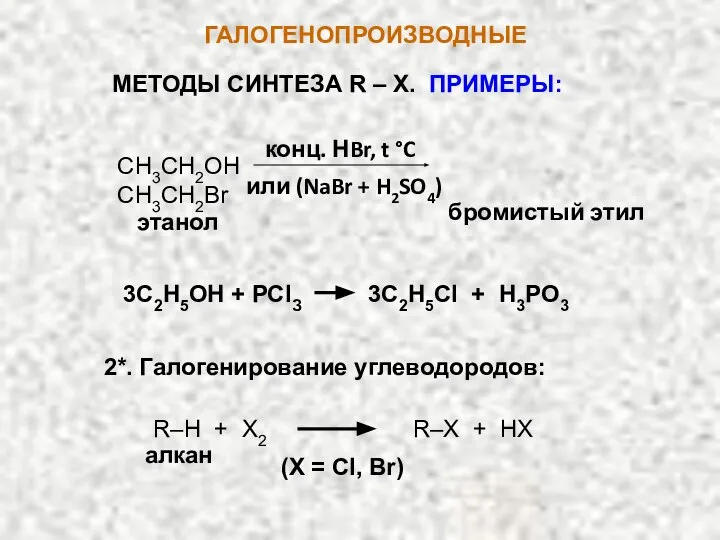
- 7. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ: СН3СН2OН СН3СН2Br конц. НBr, t °C или (NaBr +
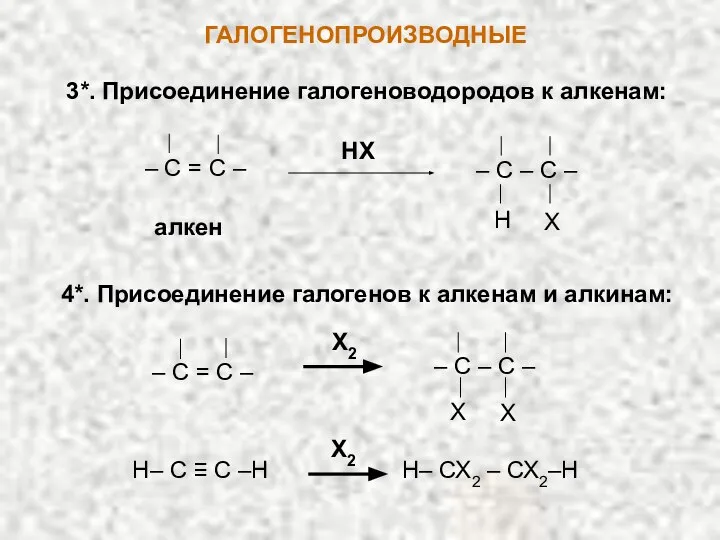
- 8. ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: 4*. Присоединение галогенов к алкенам и алкинам: Х2 Х Х
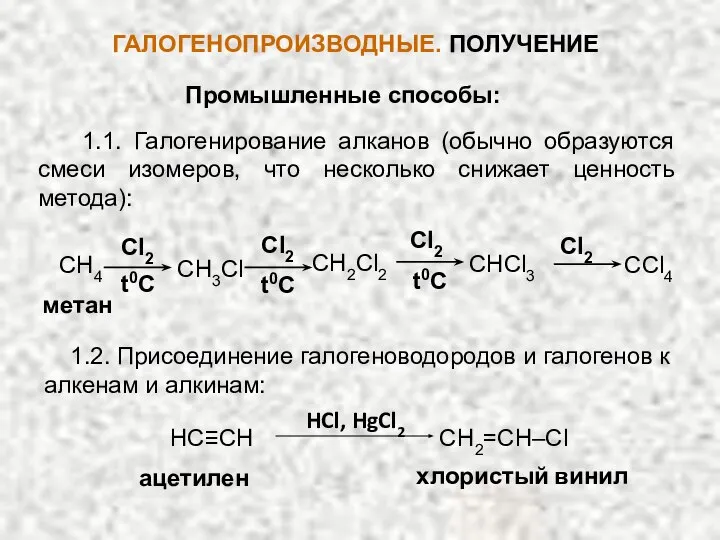
- 9. ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1.1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода):
- 10. Cl2 500°C хлористый винил этилен СН2=СН–Сl СН2 = СН2 СН2 – СН2 Сl Сl ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ
- 11. ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X Температура плавления и кипения R – X Температура плавления и
- 12. ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Компонент А Компонент В Старинное правило: «ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ» (Растворяемое вещество)
- 13. ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: : .. .. δ-
- 14. ГАЛОГЕНОПРОИЗВОДНЫЕ «S» - от слова «substitution» - замещение; «N» - от слова «nucleophilic». В SN –
- 15. ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО– (гидроксил-анион) RO– (алкоголят-ионы) RCOO– (ионы органических кислот) СN– (цианид-ион)
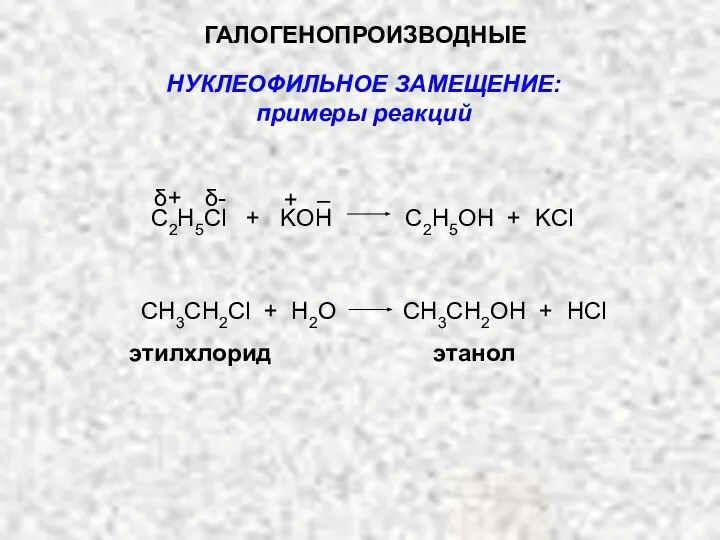
- 16. ГАЛОГЕНОПРОИЗВОДНЫЕ С2H5Cl + KOH C2H5OH + KCl CH3CH2Cl + H2O CH3CH2OH + HCl этилхлорид этанол НУКЛЕОФИЛЬНОЕ
- 17. ОБШАЯ СХЕМА: R:X + :Nu R:Nu + :X– 1. R:X + :ОН– R:OH + :X– спирт
- 18. 4. R:X + –:С ≡ СR′ R:C ≡ CR′ + :X– алкин 5. R:X + Na:R′
- 19. 9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′ [R:NH2R′]+X– RNHR′ + НX алкилбензол реакция
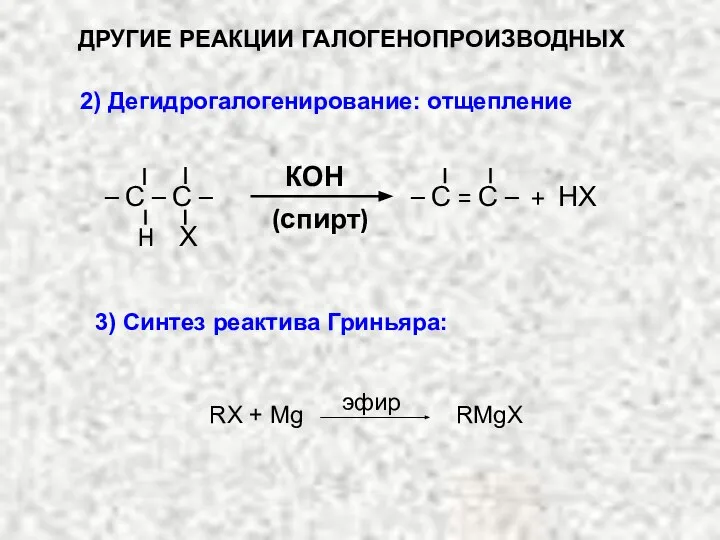
- 20. ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫХ 2) Дегидрогалогенирование: отщепление КОН (спирт) – С = С – + НХ Х
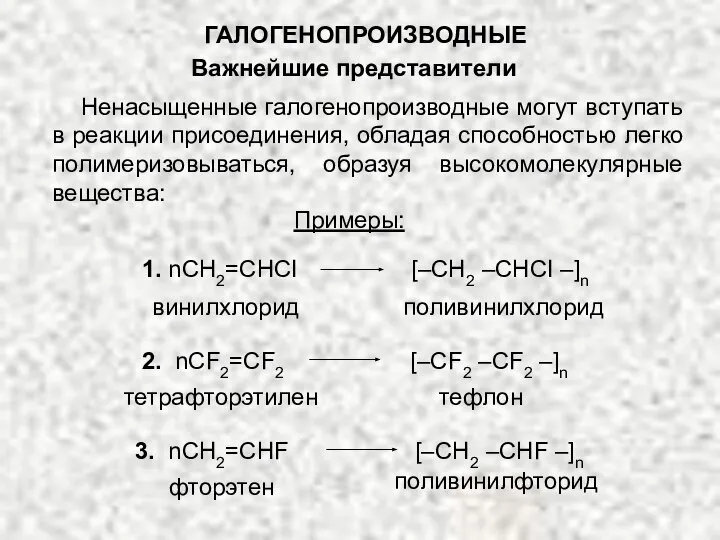
- 21. ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные
- 23. Скачать презентацию










![9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′ [R:NH2R′]+X–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395814/slide-18.jpg)
 Хроматография талдау әдістері
Хроматография талдау әдістері Горение жидкостей
Горение жидкостей Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Примерная рабочая программа основного общего образования предмета Химия
Примерная рабочая программа основного общего образования предмета Химия Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине
Практическая работа. Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: используя знания о свойствах соедине Оксиды азота.
Оксиды азота. Классы органических и неорганических веществ
Классы органических и неорганических веществ Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Дисахариды и полисахариды
Дисахариды и полисахариды Урок в 8 классе
Урок в 8 классе Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка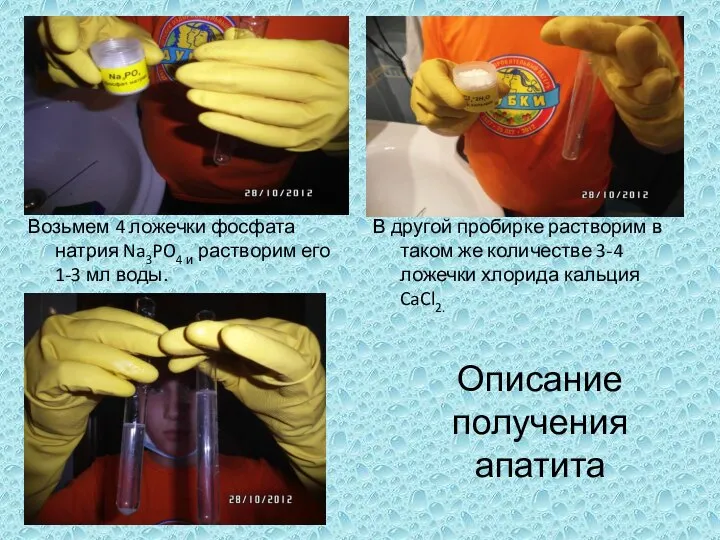 Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды.
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов
Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов Презентация по Химии "Фосфор" - скачать смотреть бесплатно_
Презентация по Химии "Фосфор" - скачать смотреть бесплатно_ Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Органогенні елементи. Хімія в організмах
Органогенні елементи. Хімія в організмах Золоторудное поле «Дуэт»
Золоторудное поле «Дуэт» Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Химические реакторы
Химические реакторы Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Общая и неорганическая химия. Лекция 19. Общая характеристика элементов VIA-группы (халькогены). Кислород
Общая и неорганическая химия. Лекция 19. Общая характеристика элементов VIA-группы (халькогены). Кислород Щелочные металлы
Щелочные металлы Фосфорные удобрения
Фосфорные удобрения Значение химии в жизни человека
Значение химии в жизни человека Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант
Научная работа на тему «Уголь» Научная работа на тему «Уголь» Подготовила: Шакарова Ксения Руководитель: Э.М. Курант pH жидкостей, необходимых для человека
pH жидкостей, необходимых для человека  Применение алкенов
Применение алкенов