Содержание
- 2. Основні відомості Фосфор (від грец. Phosphoros - світлоносний ; лат. Phosphorus) P, хімічний елемент V групи
- 3. Алотропні модифікації Білий фосфор - м’яка, безбарвна кристалічна речовина, схожа на віск. Має молекулярні кристалічні ґратки,
- 4. Алотропні модифікації Червоний фосфор - порошок червоно-бурого кольору, неотруйний. Має атомні кристалічні ґратки. Не розчиняється у
- 5. Алотропні модифікації Чорний фосфор - речовина, схожа на графіт, масна на дотик, має металічний блиск, не
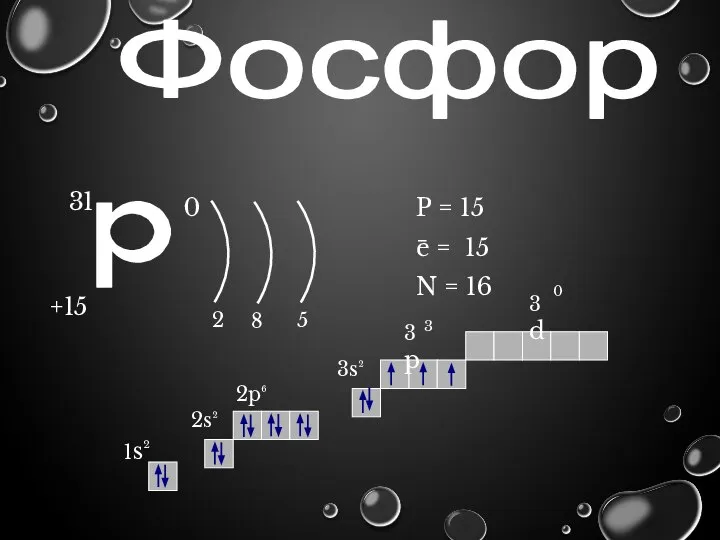
- 7. Фосфор p 31 +15 0 2 8 5 P = 15 e = 15 N =
- 9. Поширення у природі Фосфати Фосфорити
- 10. Застосування фосфору Для виробництва добрив та миючих засобів Червоний фосфор: у виробництві сірників Білий фосфор як
- 11. Фізичні властивості Білий фосфор біла речовина (через домішки може мати жовтуватий відтінок) легко ріжеться ножем і
- 12. Фізичні властивості Червоний фосфор більш термодинамічно стабільна модифікація елементарного фосфору має формулу Р n і являє
- 13. Добування Вільний фосфор отримують з природних фосфатів, прожарюючи їх з коксом і піском: Ca3(PO4)2 +3SiO2 +5C
- 14. Хімічні властивості Для фосфору характерні відновні властивості, які він виявляє у реакціях з неметалами: 4P+3O2 (нестача)
- 15. Хімічні властивості Суміш червоного фосфору з бертолетовою сіллю КСl03 займається з вибухом навіть від найменшого тертя
- 16. Хімічні властивості Фосфор реагує з деякими неметалами-окисниками, при цьому можуть утворюватися похідні Фосфору з різним ступенем
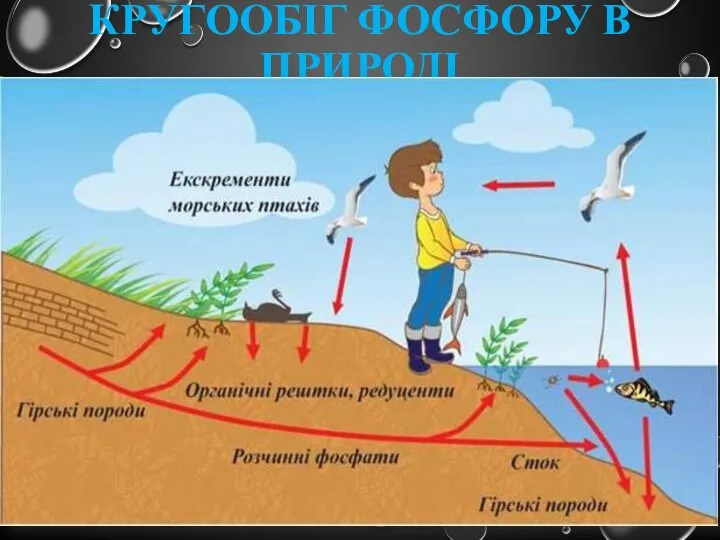
- 17. Кругообіг фосфору в природі
- 19. Скачать презентацию














 Исследование минерализата в клинической фармации
Исследование минерализата в клинической фармации Алкины. Ацетилен – представитель алкинов.
Алкины. Ацетилен – представитель алкинов. Презентация по Химии "Вода как растворитель" - скачать смотреть
Презентация по Химии "Вода как растворитель" - скачать смотреть  Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии Кто многим увлекается, тот многое обретает. П.
Кто многим увлекается, тот многое обретает. П.  Фармацевтическая химия. Фармакокинетика. Фармакодинамика. Молекулярные мишени
Фармацевтическая химия. Фармакокинетика. Фармакодинамика. Молекулярные мишени Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Соляная кислота и ее свойства
Соляная кислота и ее свойства Строение атома
Строение атома Спирты
Спирты Энергетический обмен
Энергетический обмен Anorganická chemie
Anorganická chemie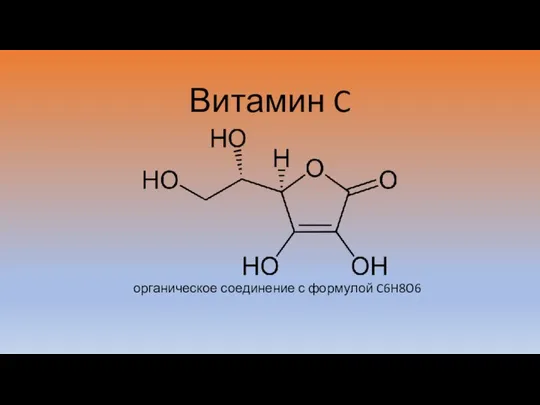 Витамин C
Витамин C G12 - класс антифризов
G12 - класс антифризов Альдегиды и кетоны
Альдегиды и кетоны Весы. Камни Весов
Весы. Камни Весов Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Презентація на тему: “Поняття про полімери на прикладі поліетилену”
Презентація на тему: “Поняття про полімери на прикладі поліетилену”  Презентация Фенолы
Презентация Фенолы Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12)
Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12) Алкины (Ацетилены)
Алкины (Ацетилены) КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс
КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс  Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров фізичні властивості полімеру спиртів та карбонових кислот
фізичні властивості полімеру спиртів та карбонових кислот  Кафедра биохимии УГМУ в прошлом и настоящем. Локализация
Кафедра биохимии УГМУ в прошлом и настоящем. Локализация Соединения галогенов
Соединения галогенов Классификация неорганических веществ
Классификация неорганических веществ Окислительные методы получения органических соединений
Окислительные методы получения органических соединений