Содержание
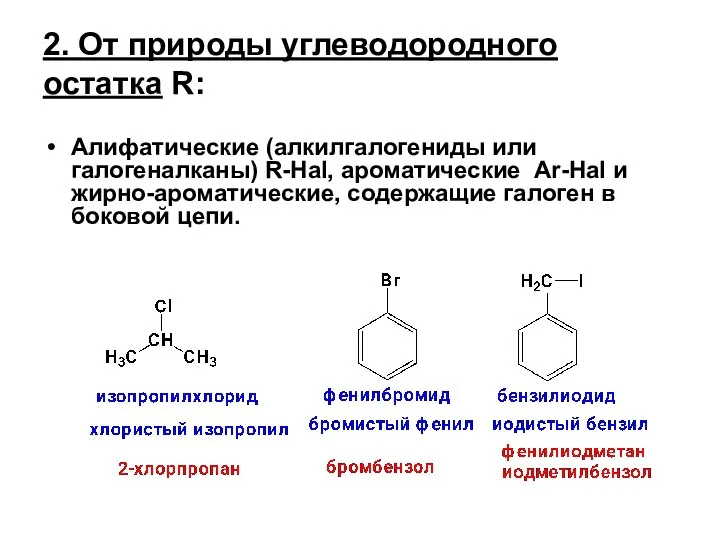
- 2. 2. От природы углеводородного остатка R: Алифатические (алкилгалогениды или галогеналканы) R-Hal, ароматические Ar-Hal и жирно-ароматические, содержащие
- 3. 3. По характеру С в sp3-гибридном состоянии, с которым связан галоген: Первичные – R-СН2- Hal, вторичные
- 4. Номенклатура Радикально-функциональные названия: строятся путем прибавления названия галогена в форме прилагательного перед названием R, или после
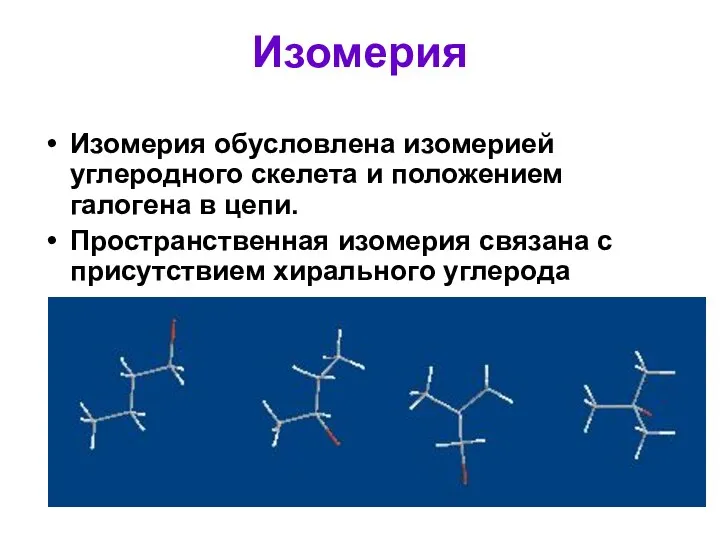
- 6. Изомерия Изомерия обусловлена изомерией углеродного скелета и положением галогена в цепи. Пространственная изомерия связана с присутствием
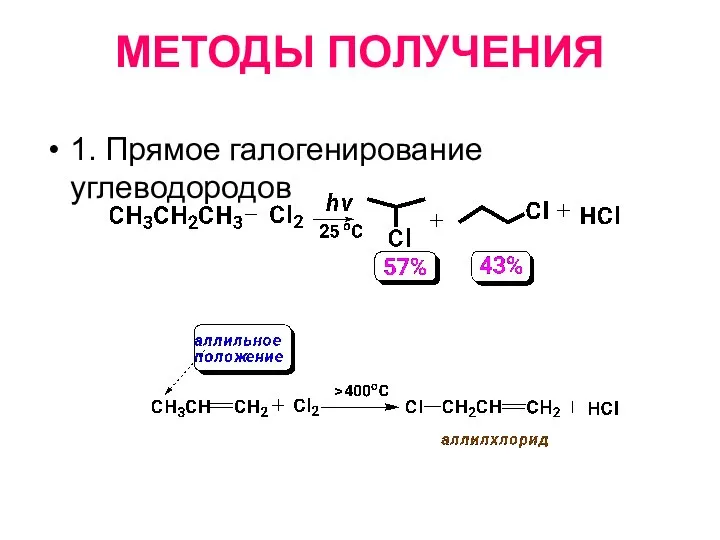
- 7. МЕТОДЫ ПОЛУЧЕНИЯ 1. Прямое галогенирование углеводородов
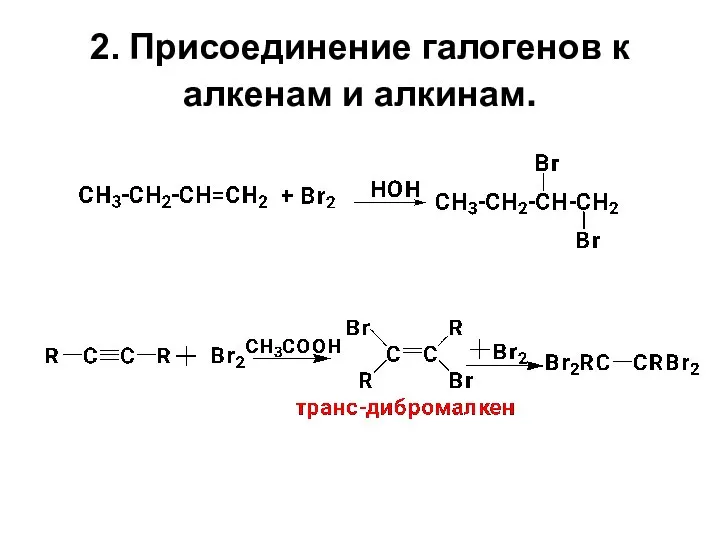
- 9. 2. Присоединение галогенов к алкенам и алкинам.
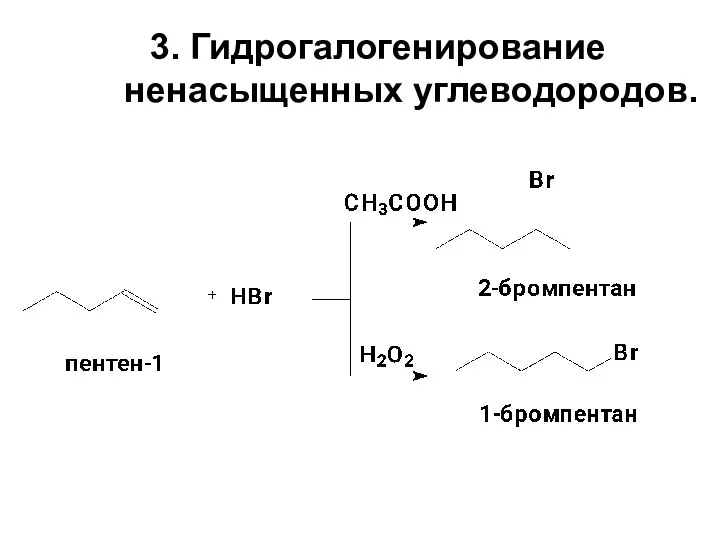
- 10. 3. Гидрогалогенирование ненасыщенных углеводородов.
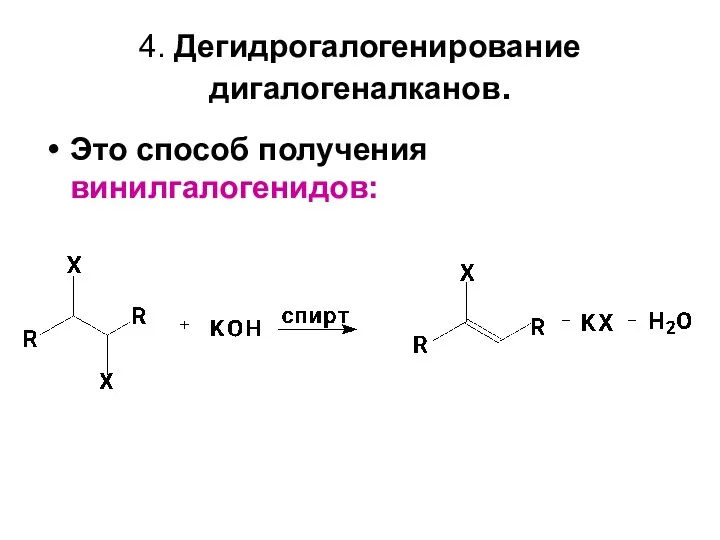
- 11. 4. Дегидрогалогенирование дигалогеналканов. Это способ получения винилгалогенидов:
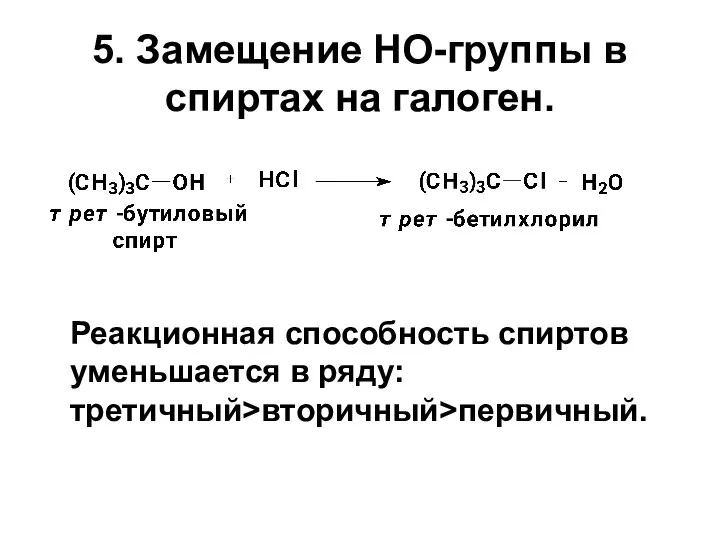
- 12. 5. Замещение HO-группы в спиртах на галоген. Реакционная способность спиртов уменьшается в ряду: третичный>вторичный>первичный.
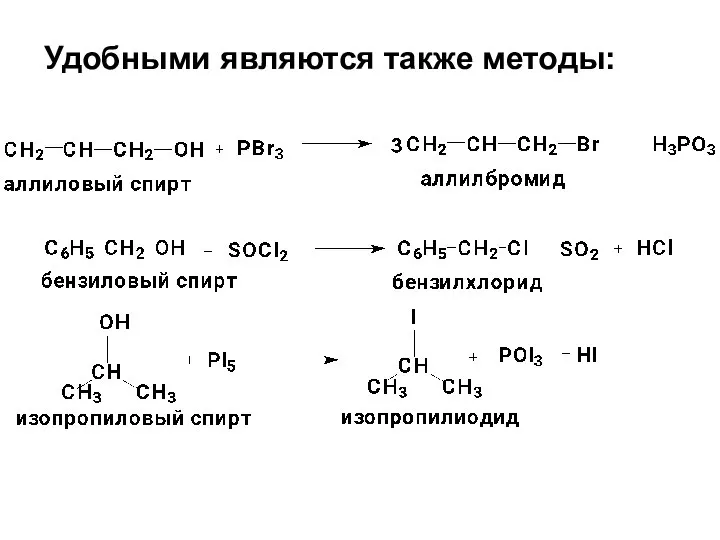
- 13. Удобными являются также методы:
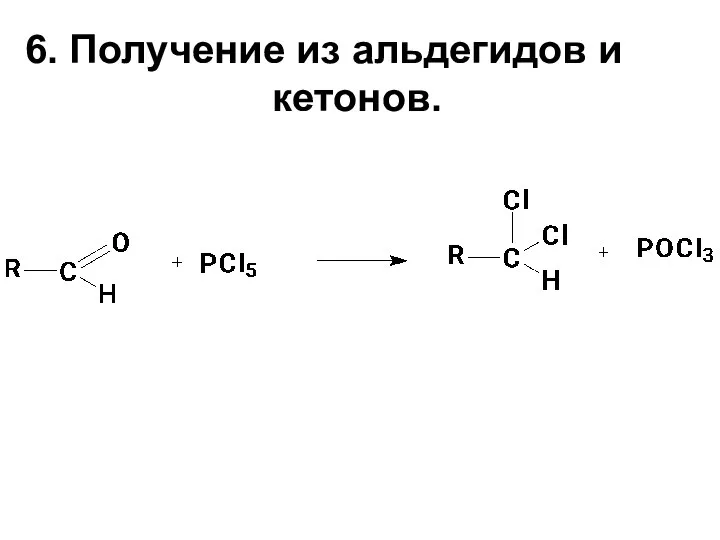
- 14. 6. Получение из альдегидов и кетонов.
- 15. 7. Получение иодпроизводных реакцией Финкельштейна
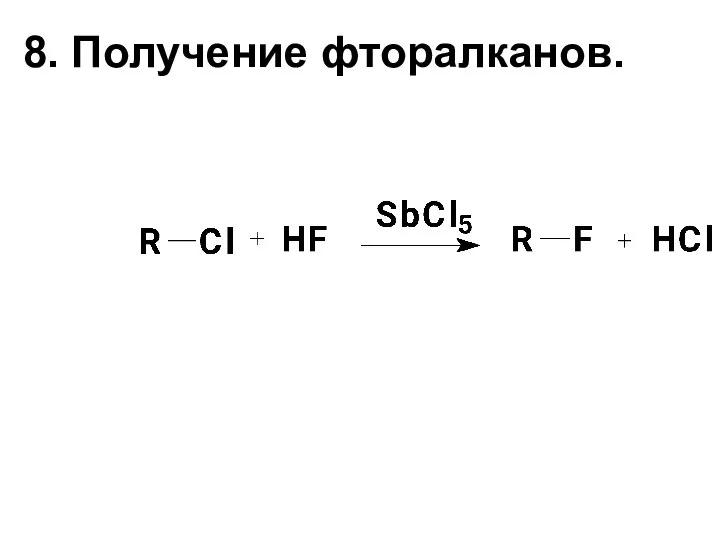
- 16. 8. Получение фторалканов.
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА Физические свойства галогеналканов зависят от природы и числа атомов галогена в молекуле. Низшие и
- 18. Полифторалканы заметно отличаются по свойствам от других галогеналканов. Переход от одного галогена к другому заметно отражается
- 19. Галогеноуглеводороды – полярные соединения, но они почти нерастворимы в воде , так как не образуют с
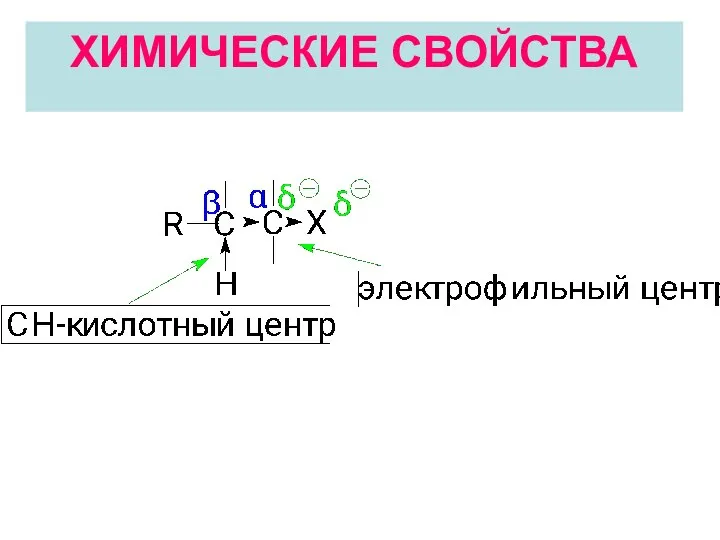
- 20. ХИМИЧЕСКИЕ СВОЙСТВА
- 21. Электрофильный центр (α-атом углерода) возникает вследствие поляризации связи С-Нal и может подвергаться атаке нуклеофилом. В результате
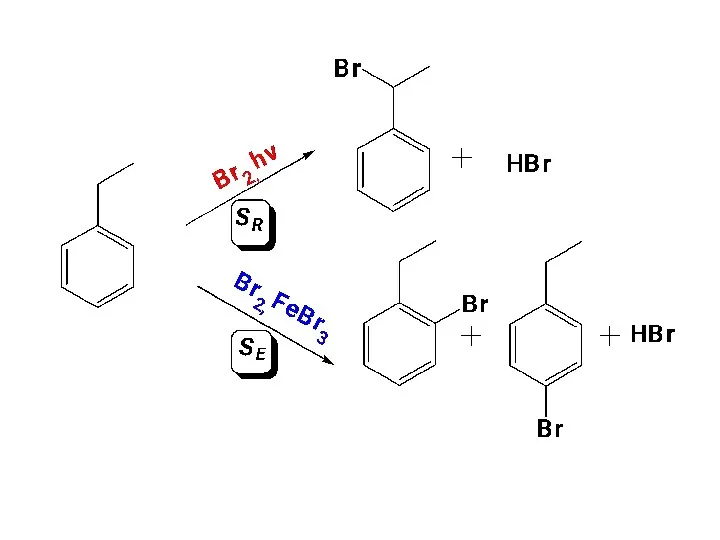
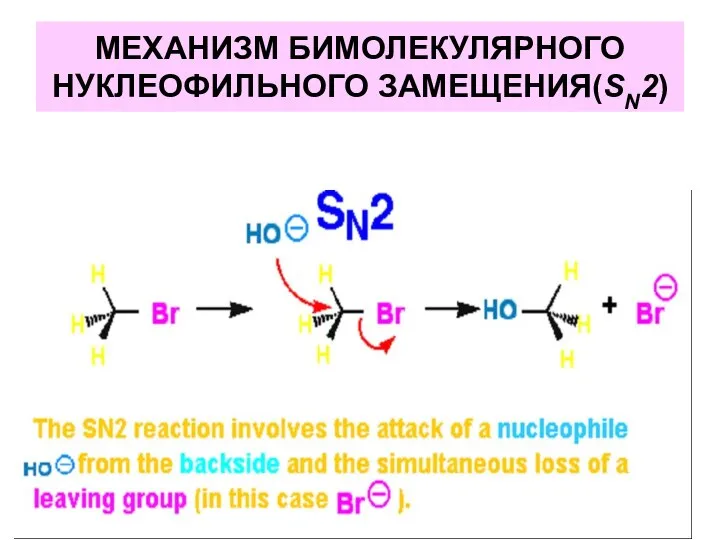
- 22. 1. Реакции нуклеофилов–наиболее распространенные превращения галогеналканов. Именно эти реакции позволяют вводить в органические соединения самые разнообразные
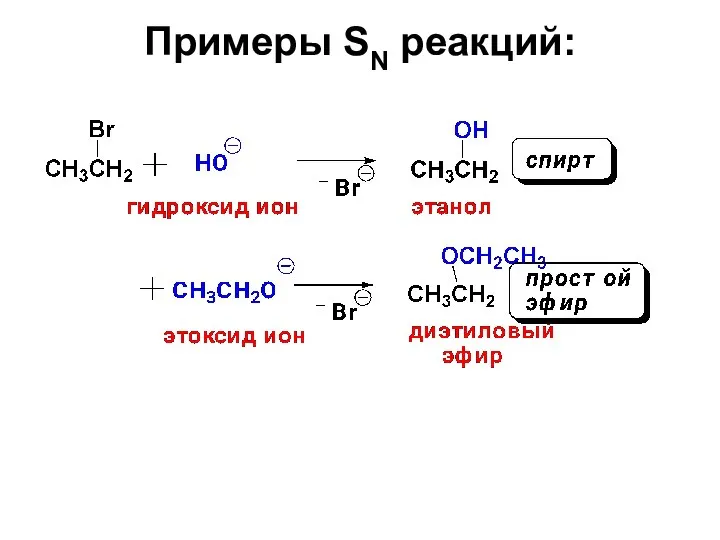
- 23. Примеры SN реакций:
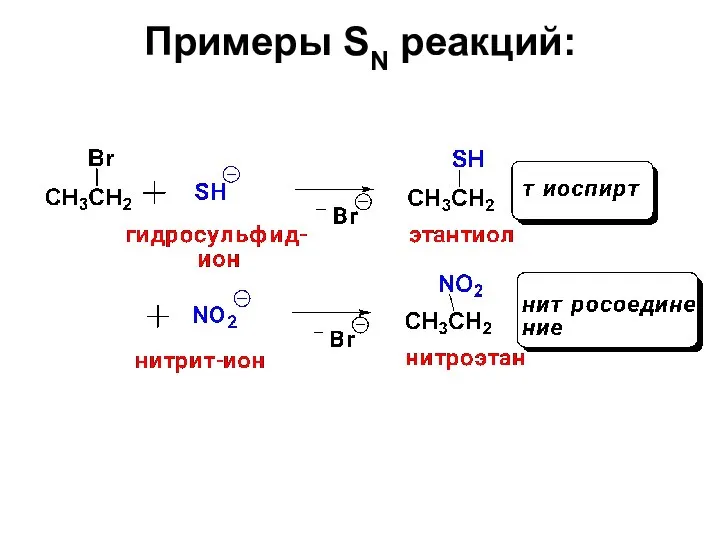
- 24. Примеры SN реакций:
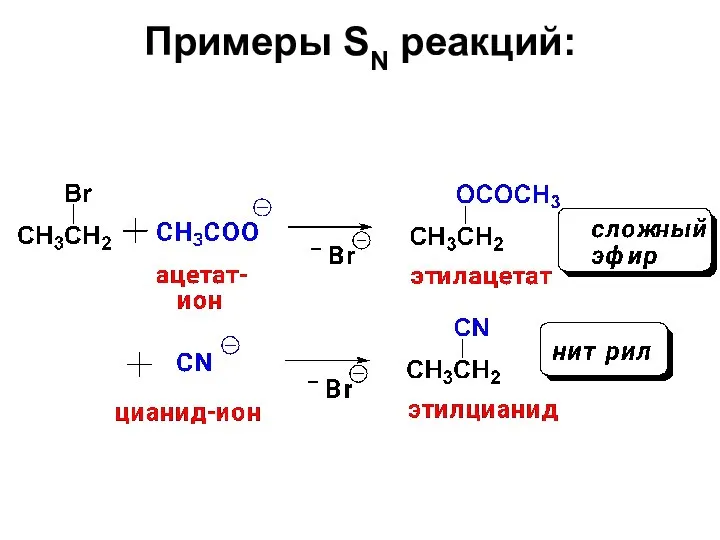
- 25. Примеры SN реакций:
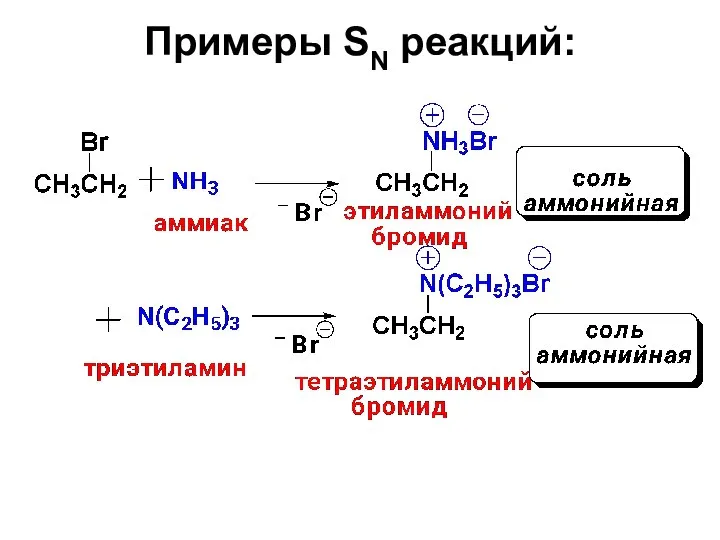
- 26. Примеры SN реакций:
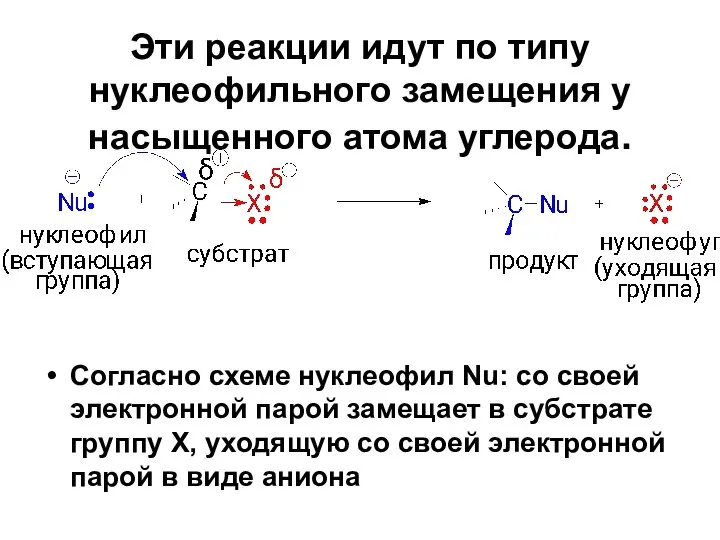
- 27. Эти реакции идут по типу нуклеофильного замещения у насыщенного атома углерода. Согласно схеме нуклеофил Nu: со
- 28. Нуклеофильные реагенты - это частицы (атомы или молекулы) доноры электронной пары при образовании связи с любым
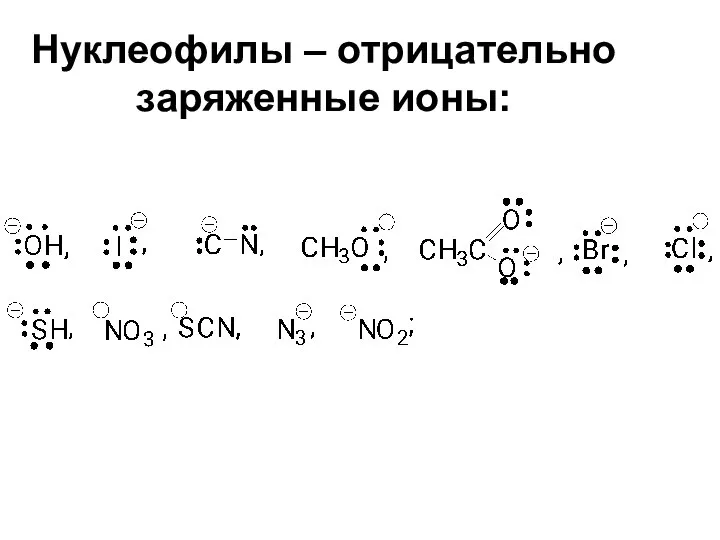
- 29. Нуклеофилы – отрицательно заряженные ионы:
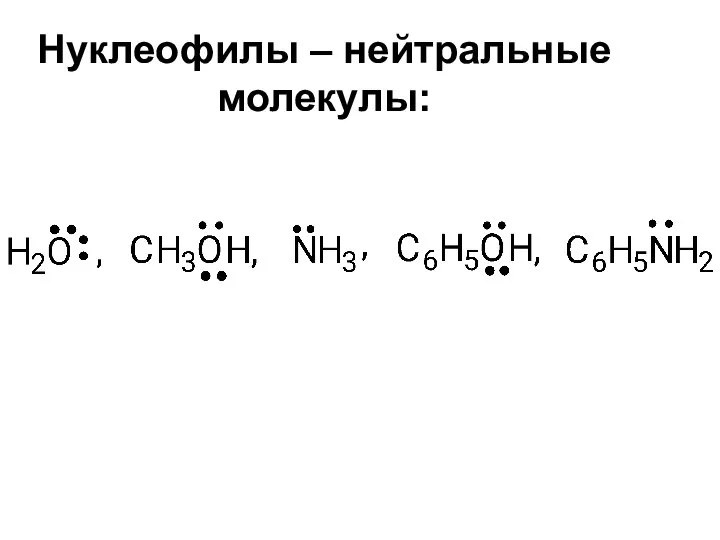
- 30. Нуклеофилы – нейтральные молекулы:
- 31. Реакции нуклеофильного замещения идут по одной из следующих схем: бимолекулярное нуклеофильное замещение (SN2); мономолекулярное нуклеофильное замещение
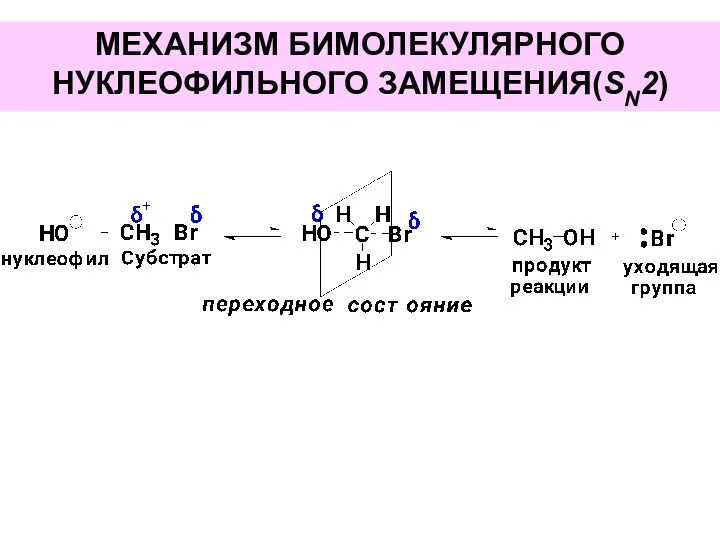
- 32. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
- 33. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
- 34. Кинетика реакции: V=k[субстрат] [реагент]
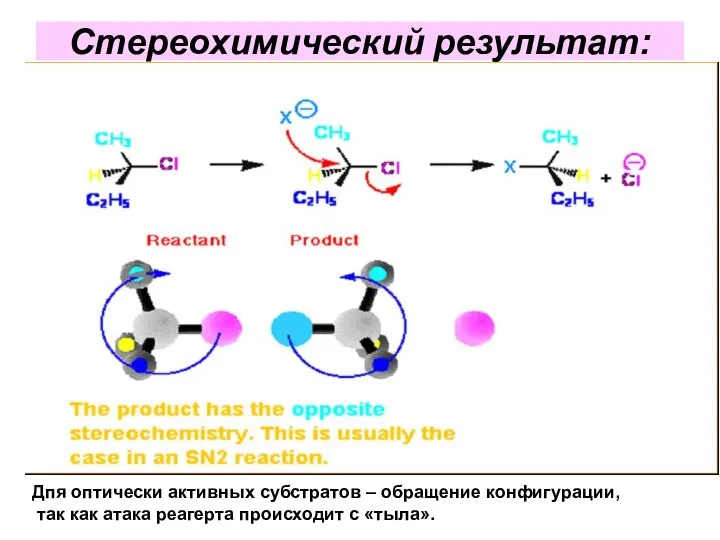
- 35. Стереохимический результат: Дпя оптически активных субстратов – обращение конфигурации, так как атака реагерта происходит с «тыла».
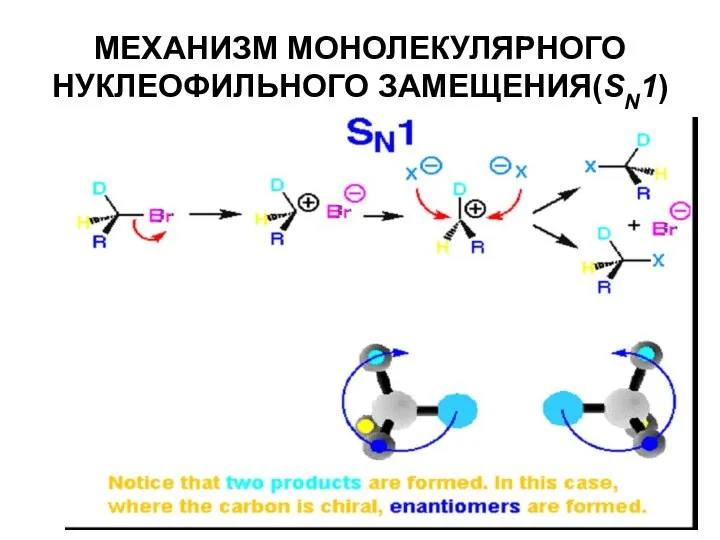
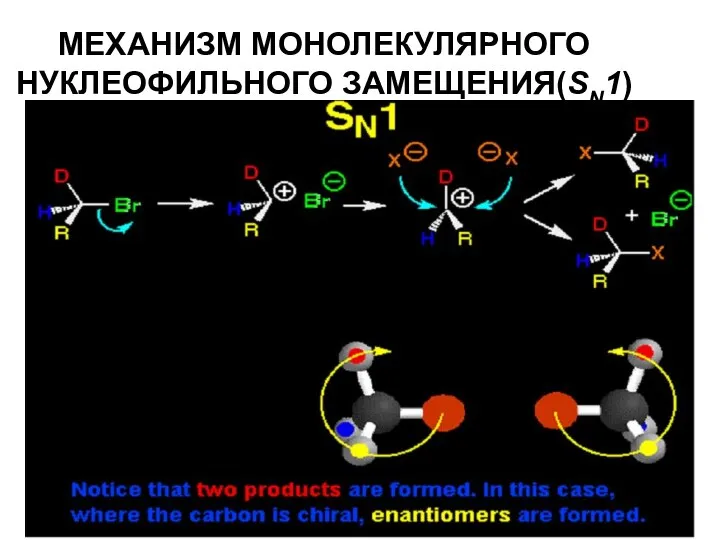
- 36. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
- 37. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
- 38. Пример такой реакции - щелочной гидролиз трет-бутилбромида: Реакция асинхронна, разрыв связи С-Br и образование новой связи
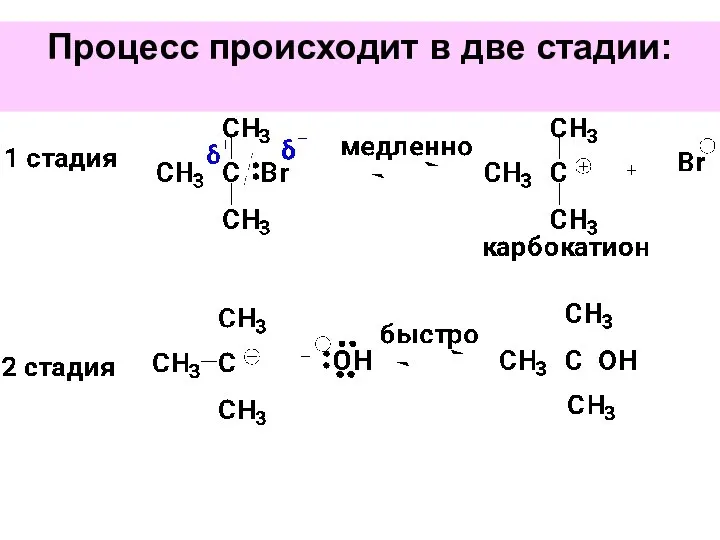
- 39. Процесс происходит в две стадии:
- 40. Кинетика реакции: V=k[субстрат] Концентрация нуклеофила на скорость реакции не влияет.
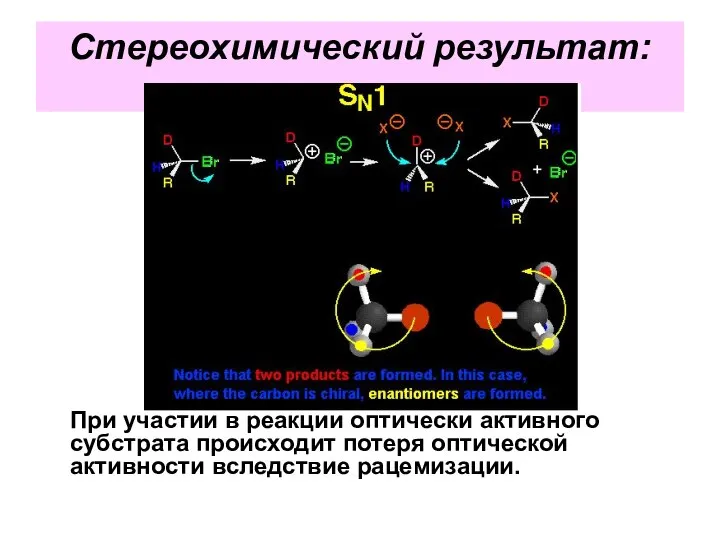
- 41. Стереохимический результат: При участии в реакции оптически активного субстрата происходит потеря оптической активности вследствие рацемизации.
- 42. Факторы,влияющие на ход нуклеофильного замещения 1. Строение субстрата. 2. Природа уходящей группы. 3. Природа растворителя. 4.
- 43. Строение субстрата. Природа углеводородного радикала, связанного с галогеном, играет важную роль. С точки зрения реакционной способности
- 44. а) Соединения с нормальной реакционной способностью (нормальной подвижностью галогена в SN реакциях); б) Соединения с пониженной
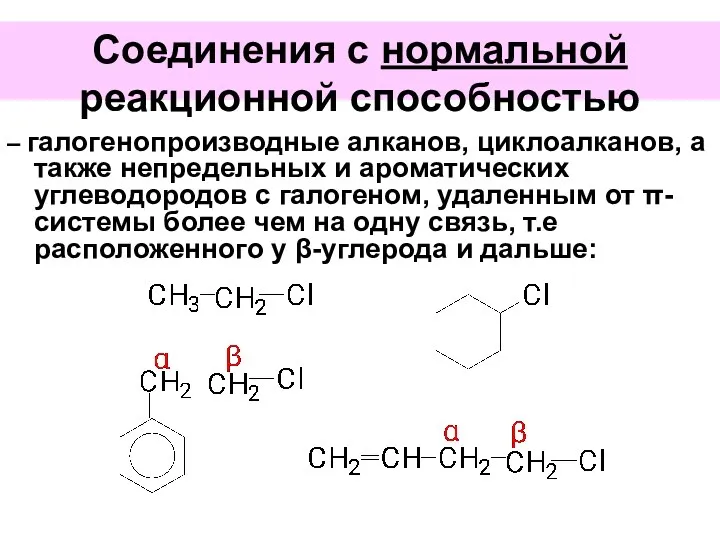
- 45. Соединения с нормальной реакционной способностью – галогенопроизводные алканов, циклоалканов, а также непредельных и ароматических углеводородов с
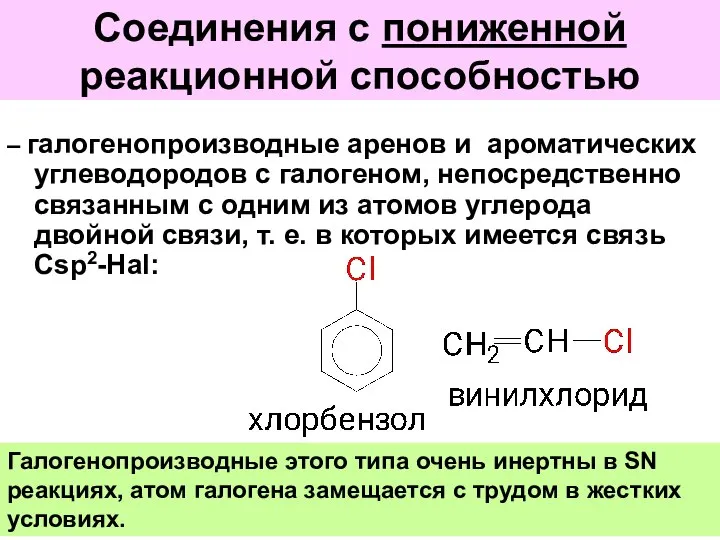
- 46. Соединения с пониженной реакционной способностью – галогенопроизводные аренов и ароматических углеводородов с галогеном, непосредственно связанным с
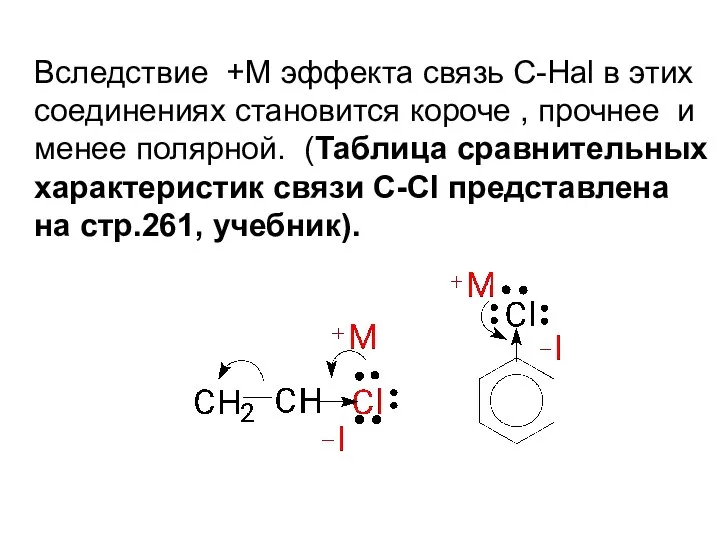
- 47. Вследствие +М эффекта связь С-Hal в этих соединениях становится короче , прочнее и менее полярной. (Таблица
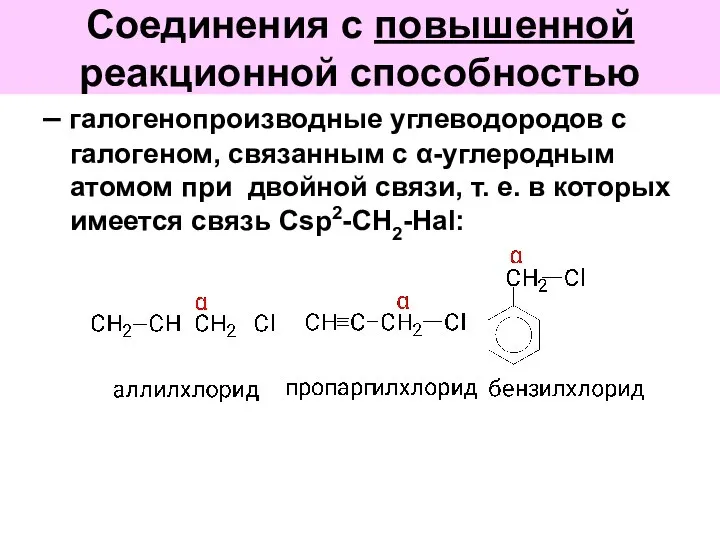
- 48. Соединения с повышенной реакционной способностью – галогенопроизводные углеводородов с галогеном, связанным с α-углеродным атомом при двойной
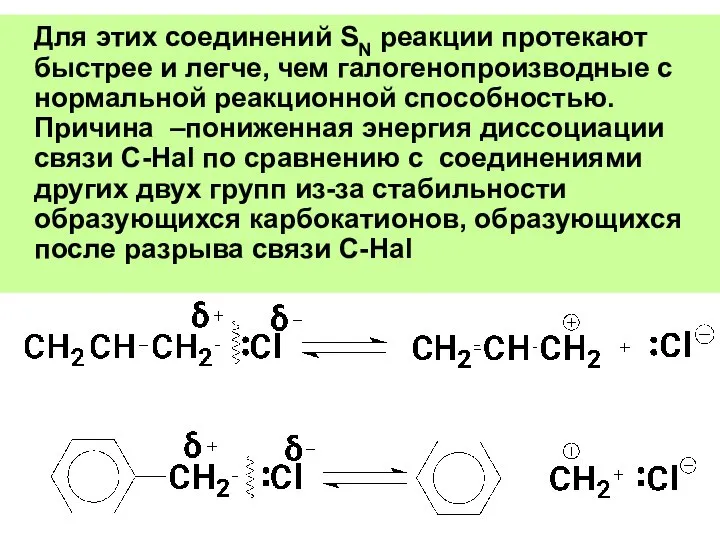
- 49. Для этих соединений SN реакции протекают быстрее и легче, чем галогенопроизводные с нормальной реакционной способностью. Причина
- 50. Природа R влияет и на предпочтительность реализации замещения по (SN1) или (SN2) механизмам. Склонность субстрата вступать
- 51. В случае SN2 реакции определяющим является стерический фактор: большие по объему R при атоме С уменьшают
- 52. SN1 Реакции могут протекать для тех субстратов, у которых связь С-Hal легко диссоциирует с образованием стабильного
- 53. Таким образом, третичные субстраты обычно вступают в SN1, а первичные – SN2-реакции. Субстраты вторичные, а также
- 54. Влияние природы уходящей группы (нуклеофуга) Хорошие уходящие группы бедны энергией, т.е. являются устойчивыми ионами или нейтральными
- 55. Влияние природы растворителя. Роль полярного растворителя: 1) принимает участие в ионизации молекул исходных веществ; 2) стабилизирует
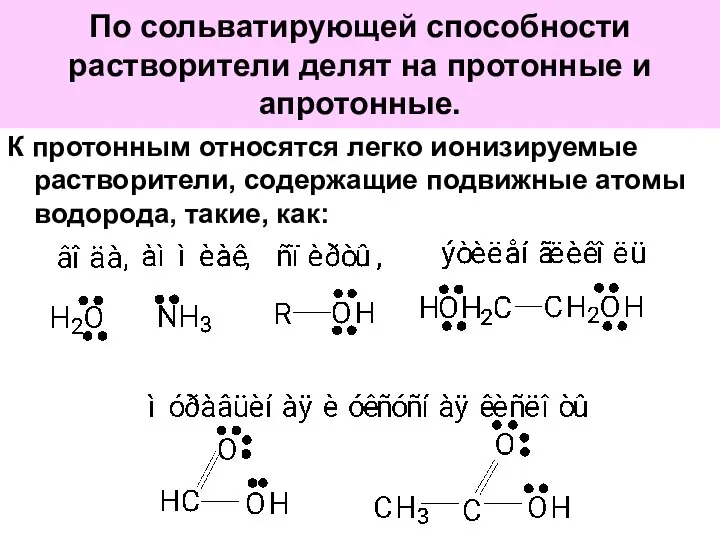
- 56. По сольватирующей способности растворители делят на протонные и апротонные. К протонным относятся легко ионизируемые растворители, содержащие
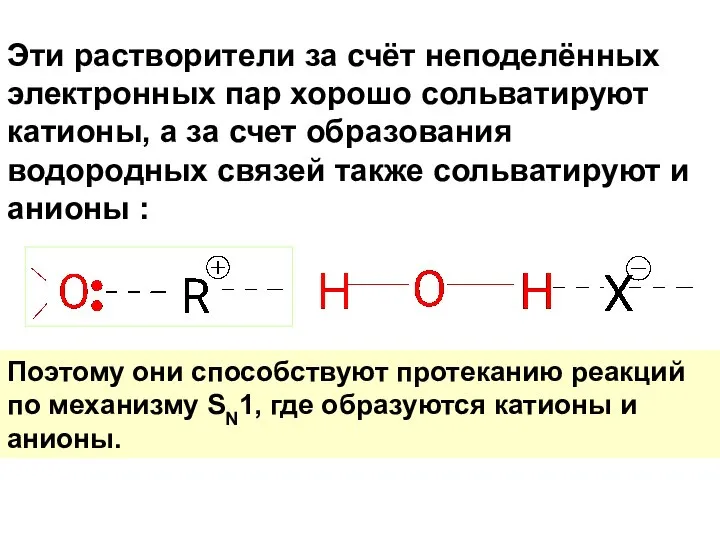
- 57. Эти растворители за счёт неподелённых электронных пар хорошо сольватируют катионы, а за счет образования водородных связей
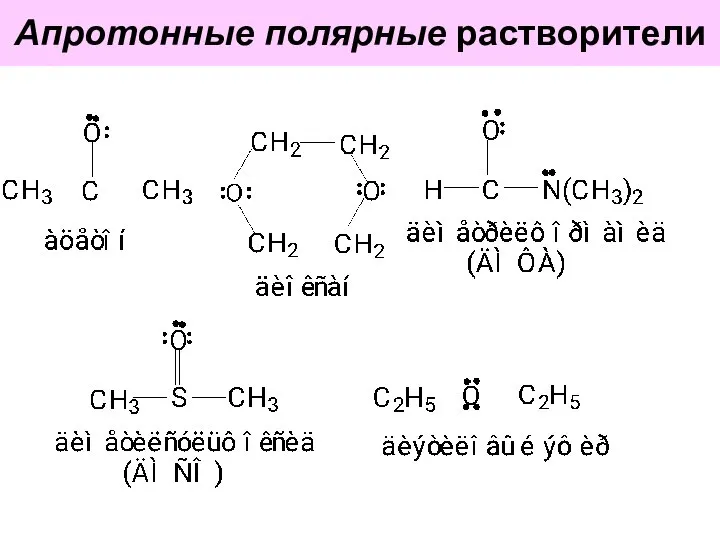
- 58. Апротонные полярные растворители
- 59. Апротонные полярные растворители за счёт неподелённых электронных пар гетероатомов хорошо сольватируют катионы. Анионы не сольватируют,т.к. они
- 60. Таким образом, характер растворителя оказывает существенное влияние на скорость реакций и её механизм. Это позволяет, подбирая
- 61. Влияние нуклеофильности реагента. Активность нуклеофила сказывается на скорости реакций типа SN2, поскольку он принимает участие в
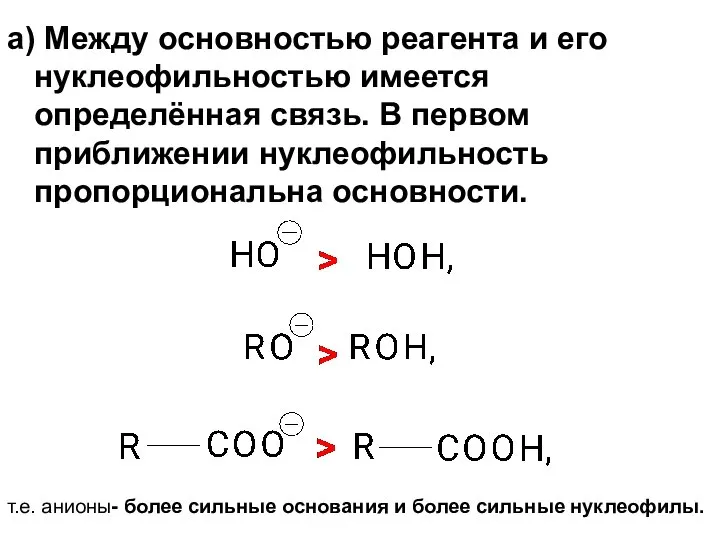
- 62. а) Между основностью реагента и его нуклеофильностью имеется определённая связь. В первом приближении нуклеофильность пропорциональна основности.
- 63. б) Нуклеофильность определяется ещё и поляризуемостью. Чем больше размер атома, тем выше его нуклеофильность. Легкополяризуемые реагенты
- 64. в) На нуклеофильность слабополяризуемых ионов значительное влияние оказывает природа растворителя. В полярных растворителях ионы находятся в
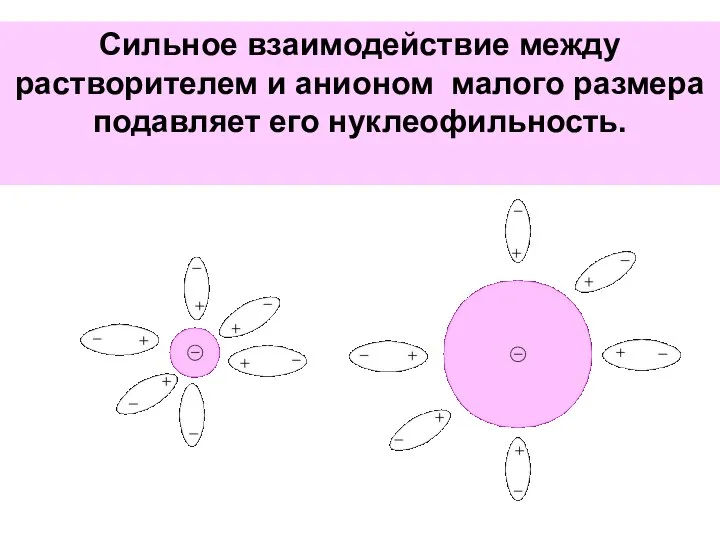
- 65. Сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность.
- 66. Реагенты по возрастанию их нуклеофильности в SN2-реакциях в протонных растворителях можно расположить таким образом:
- 67. Апротонный растворитель не способен сольватировать анионы за счёт образования водородных связей с ними, поэтому анионы в
- 68. Порядок нуклеофильности в апротонном растворителе диметилформамиде (ДМФА) становится следующим: Таблица сравнения SN1- и SN2-реакций представлена на
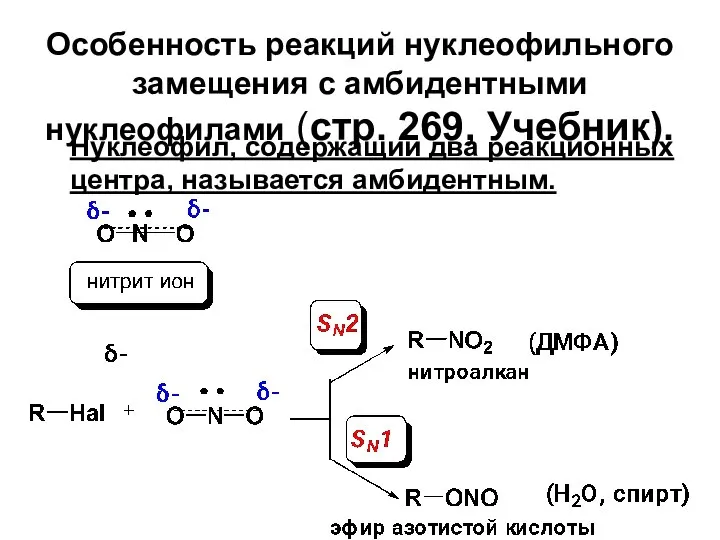
- 69. Особенность реакций нуклеофильного замещения с амбидентными нуклеофилами (стр. 269, Учебник). Нуклеофил, содержащий два реакционных центра, называется
- 71. Правило Корнблюма: В SN2-реакциях атакующим атомом амбидентного нуклеофила будет более нуклеофильный атом, а в SN1-реакциях –
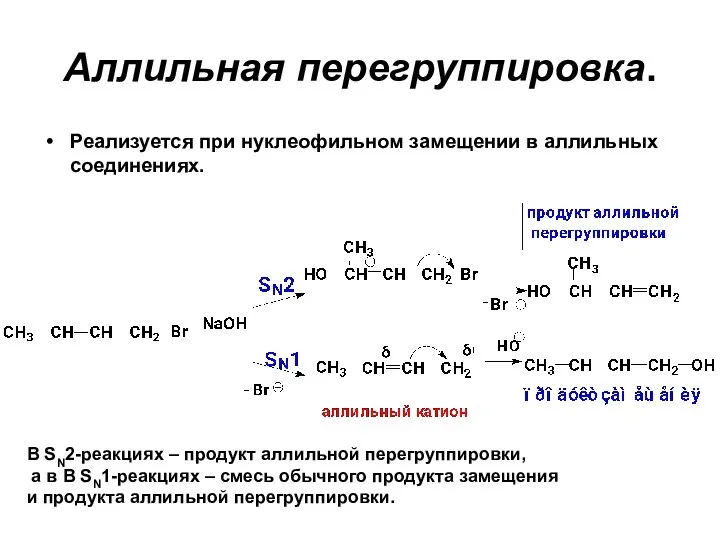
- 72. Аллильная перегруппировка. Реализуется при нуклеофильном замещении в аллильных соединениях. В SN2-реакциях – продукт аллильной перегруппировки, а
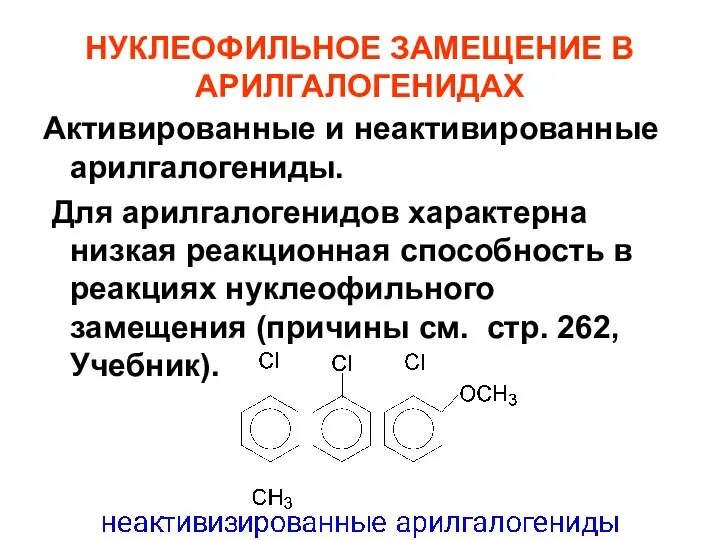
- 73. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРИЛГАЛОГЕНИДАХ Активированные и неактивированные арилгалогениды. Для арилгалогенидов характерна низкая реакционная способность в реакциях
- 74. Подвижность галогена можно увеличить введением в о- или п-положение сильных электроноакцепторных групп, обладающих –I- и –М-эффектами
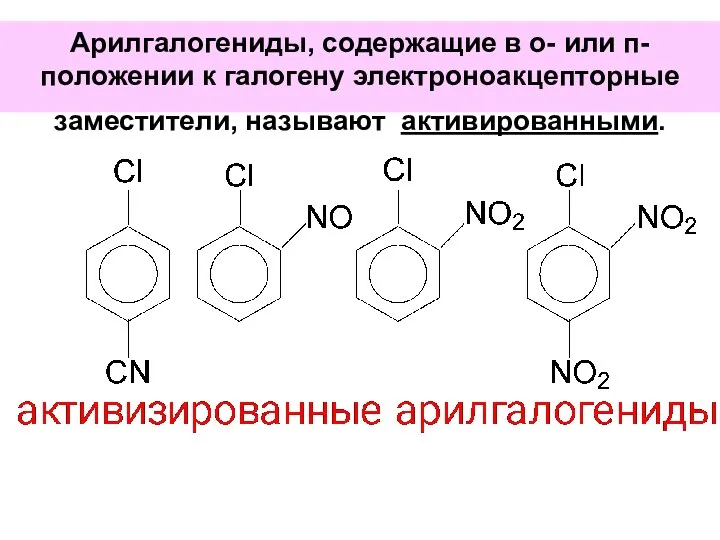
- 75. Арилгалогениды, содержащие в о- или п-положении к галогену электроноакцепторные заместители, называют активированными.
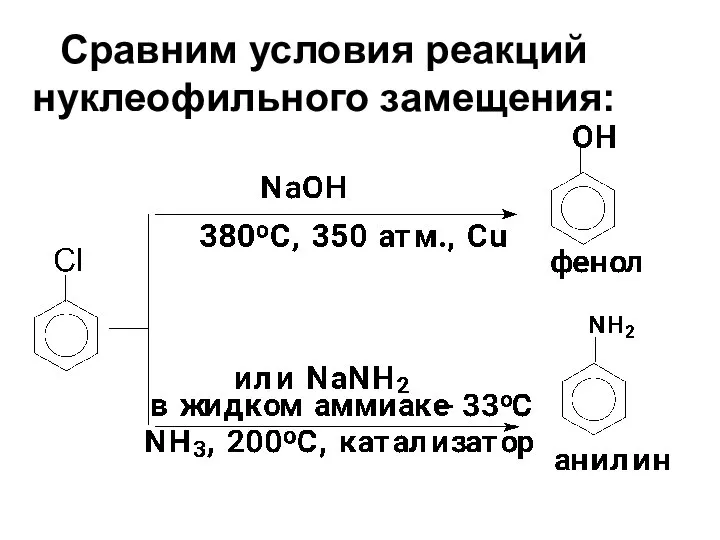
- 76. Сравним условия реакций нуклеофильного замещения:
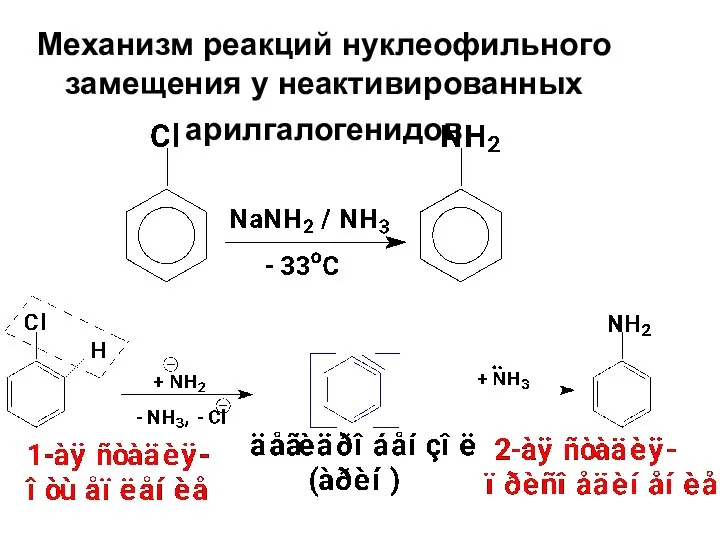
- 78. Механизм реакций нуклеофильного замещения у неактивированных арилгалогенидов
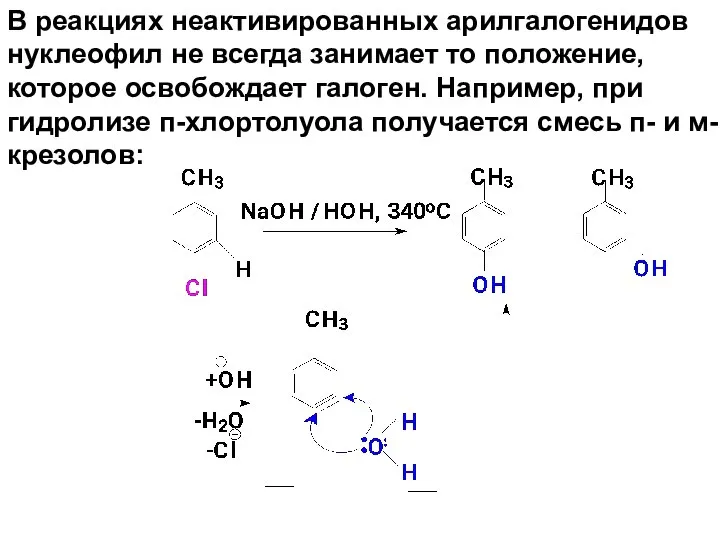
- 79. В реакциях неактивированных арилгалогенидов нуклеофил не всегда занимает то положение, которое освобождает галоген. Например, при гидролизе
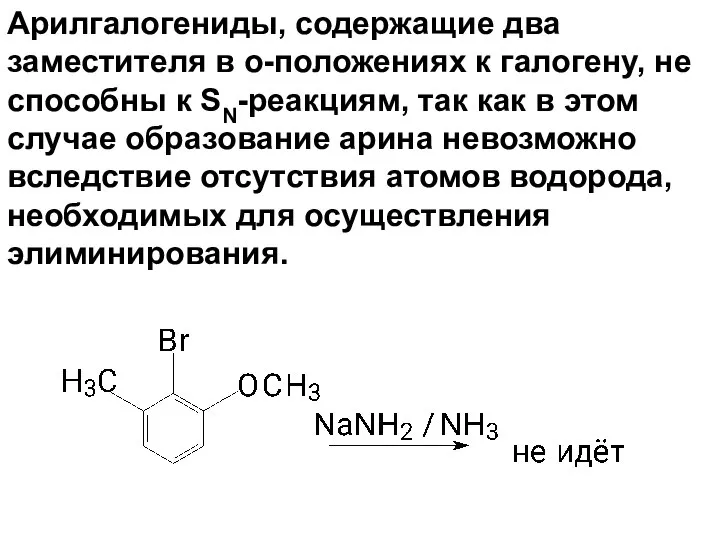
- 80. Арилгалогениды, содержащие два заместителя в о-положениях к галогену, не способны к SN-реакциям, так как в этом
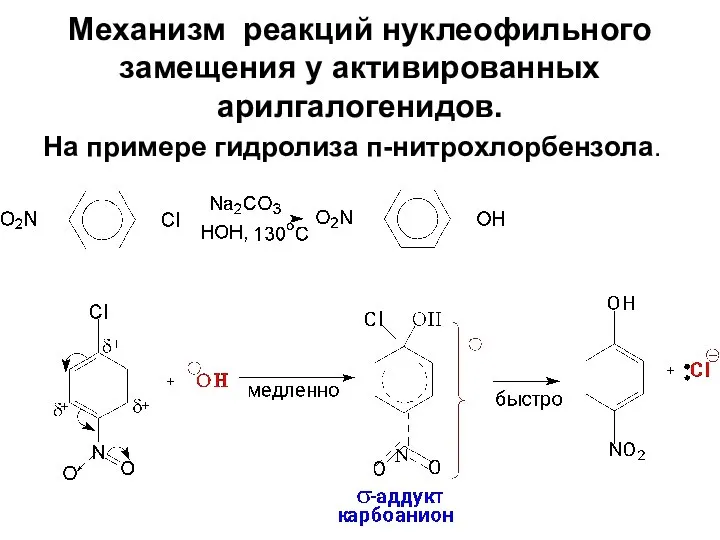
- 81. Механизм реакций нуклеофильного замещения у активированных арилгалогенидов. На примере гидролиза п-нитрохлорбензола.
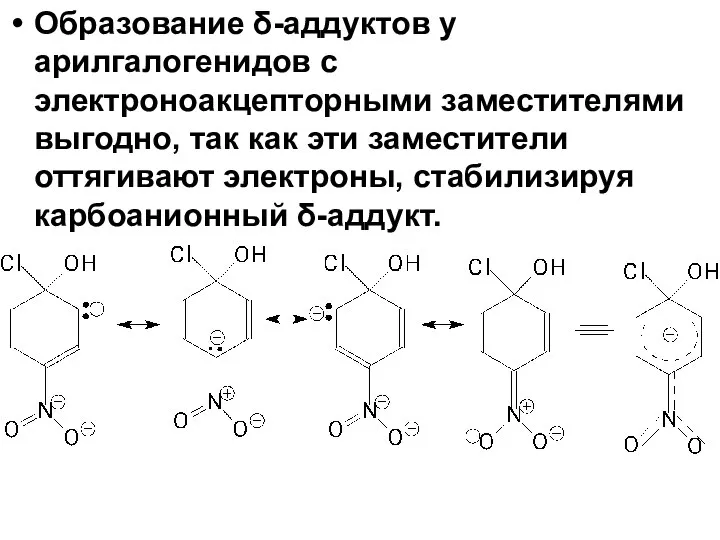
- 82. Образование δ-аддуктов у арилгалогенидов с электроноакцепторными заместителями выгодно, так как эти заместители оттягивают электроны, стабилизируя карбоанионный
- 83. Т.к. в lim-стадии участвуют два вещества реакция по своему типу относится к SN2аром. Сравнение реакций SN2аром
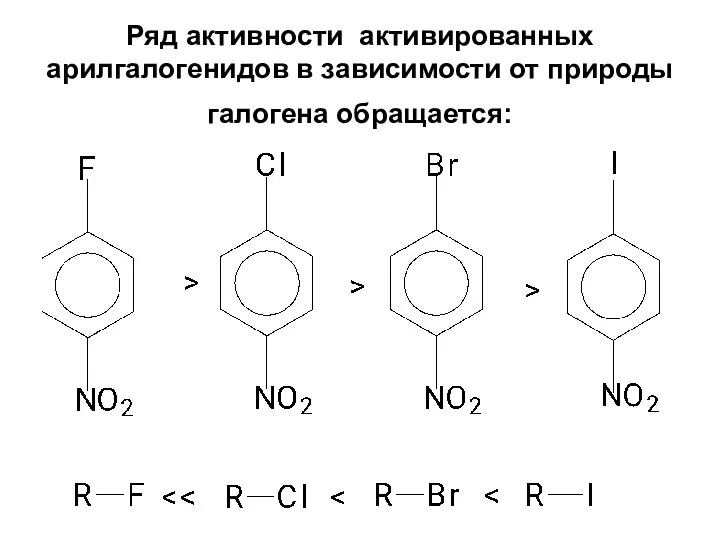
- 84. Ряд активности активированных арилгалогенидов в зависимости от природы галогена обращается:
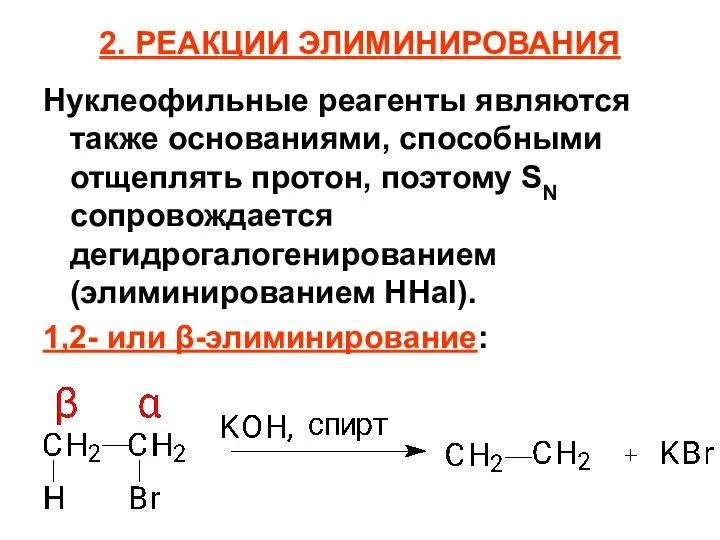
- 85. 2. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ Нуклеофильные реагенты являются также основаниями, способными отщеплять протон, поэтому SN сопровождается дегидрогалогенированием (элиминированием
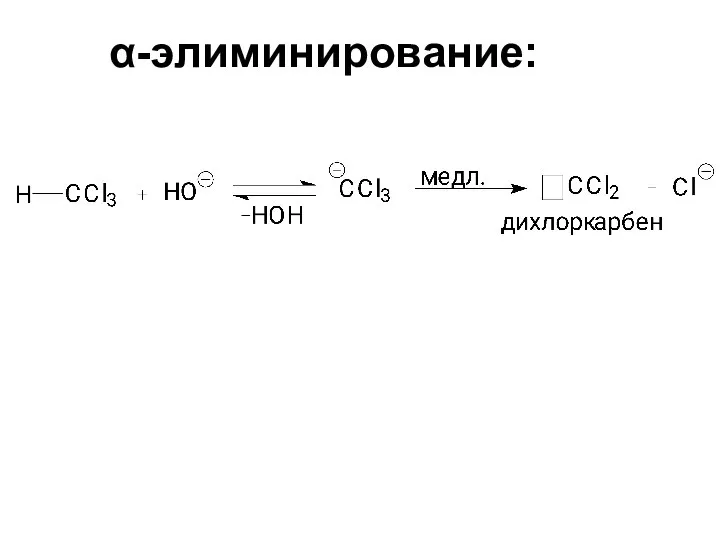
- 86. α-элиминирование:
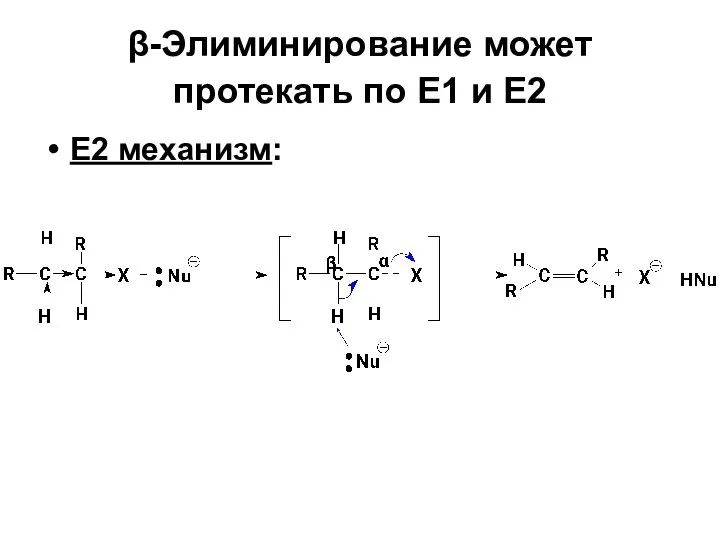
- 87. β-Элиминирование может протекать по Е1 и Е2 Е2 механизм:
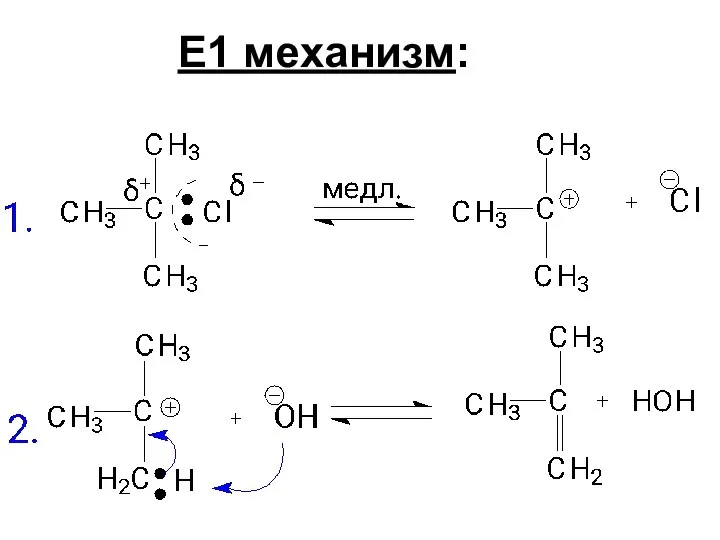
- 88. Е1 механизм:
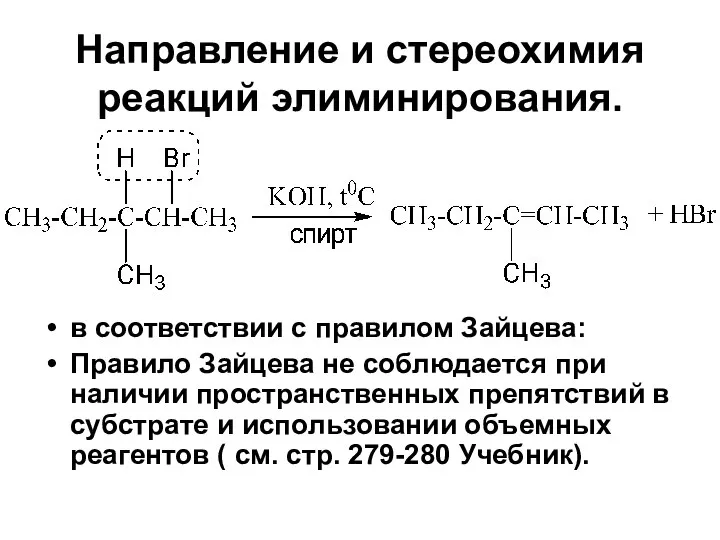
- 89. Направление и стереохимия реакций элиминирования. в соответствии с правилом Зайцева: Правило Зайцева не соблюдается при наличии
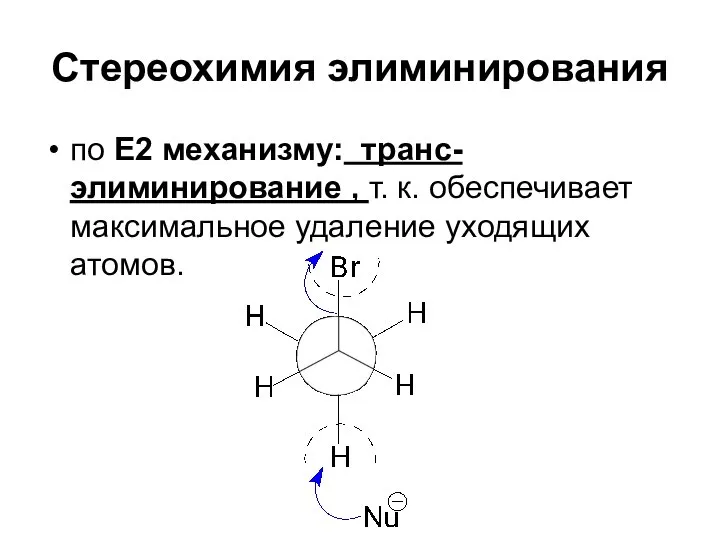
- 90. Стереохимия элиминирования по Е2 механизму: транс-элиминирование , т. к. обеспечивает максимальное удаление уходящих атомов.
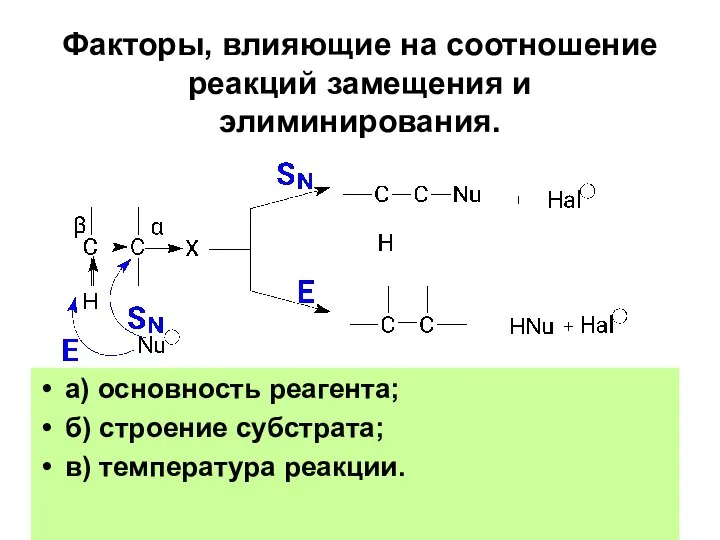
- 91. Факторы, влияющие на соотношение реакций замещения и элиминирования. а) основность реагента; б) строение субстрата; в) температура
- 92. а) Основность реагента как сродство к протону увеличивает вклад Е-реакций:
- 93. б) строение субстрата В зависимости от природ Hal при одинаковом R скорость отщепления изменяется в соответствии
- 94. в) температура реакции. Повышение температуры увеличивает вклад Е-реакций.
- 95. 3.РЕАКЦИИ ГАЛОГЕНПРОИЗВОДНЫХ С МЕТАЛЛАМИ Алкил- и арилгалогениды реагируют с металлами с образованием металлоорганических соединений. Происходит образование
- 96. Li образует ковалентную связь с угдеродом, в то время как Na-производные в основном ионные соединения. Они
- 97. При переходе от R-Ha1 к Li - и Na-органическим соединениям происходит обращение поляризации атома углерода от
- 98. Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия). Роль диэтилового эфира : 1) эфир растворяет
- 99. Реакции магнийорганических соединений. В реактивах Гриньяра связь достаточно полярна, что определяет карбанионный характер атома углерода ,
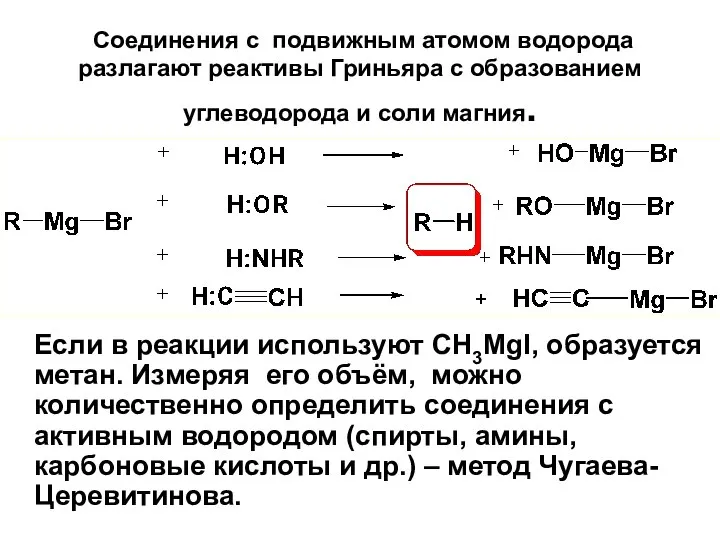
- 100. Соединения с подвижным атомом водорода разлагают реактивы Гриньяра с образованием углеводорода и соли магния. Если в
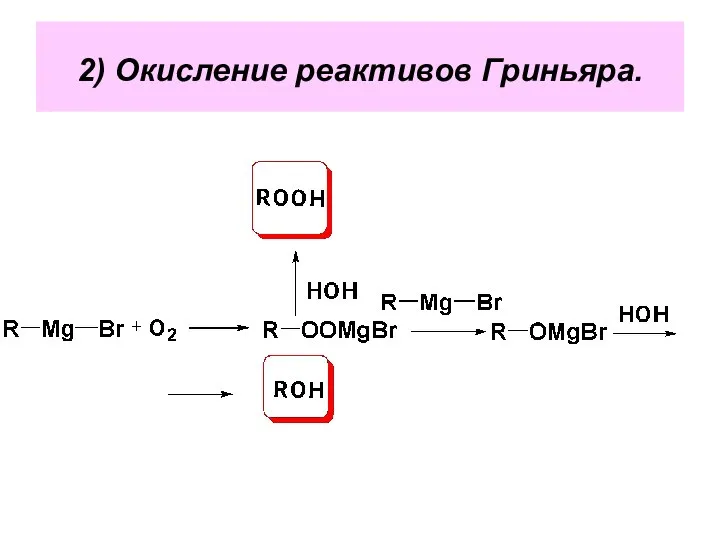
- 101. 2) Окисление реактивов Гриньяра.
- 103. Скачать презентацию











![Кинетика реакции: V=k[субстрат] [реагент]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407972/slide-33.jpg)

![Кинетика реакции: V=k[субстрат] Концентрация нуклеофила на скорость реакции не влияет.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407972/slide-39.jpg)






























 Электрическая проводимость растворов
Электрическая проводимость растворов Coordination compounds
Coordination compounds Periodic Table of the Elements
Periodic Table of the Elements Скандий
Скандий Липиды. Составные части липидов
Липиды. Составные части липидов Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста Марганец и его свойства
Марганец и его свойства Строение, особенности химического поведения алкалоидов, обладающих биологической активностью
Строение, особенности химического поведения алкалоидов, обладающих биологической активностью Равновесие в растворах электролитов
Равновесие в растворах электролитов Типы химических реакций
Типы химических реакций Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n
КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n  Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Электролитическая диссоциация
Электролитическая диссоциация Презентация по Химии "Моющие и чистящие средства" - скачать смотреть
Презентация по Химии "Моющие и чистящие средства" - скачать смотреть  Презентація уроку «Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія» Підготувала: учитель хімії вищої категорії Христин
Презентація уроку «Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія» Підготувала: учитель хімії вищої категорії Христин Положение металлов в ПС, особенности строения их атомов, физические свойства
Положение металлов в ПС, особенности строения их атомов, физические свойства Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Тепловой баланс котла
Тепловой баланс котла Электрохимия. Физико –химические свойства ионных систем. (Лекция 13)
Электрохимия. Физико –химические свойства ионных систем. (Лекция 13) Поліетилен
Поліетилен Алмаз
Алмаз Применение алкенов
Применение алкенов Алкены. Пропилен
Алкены. Пропилен Набухание наполненных полимеров
Набухание наполненных полимеров Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Углеводы. Дисахариды и полисахариды
Углеводы. Дисахариды и полисахариды