Содержание
- 2. В 1-4 Задания В1 – В4 считаются выполненными верно, если в каждом из них правильно указана
- 3. В1 (2010)Периодический закон Д.И. Менделеева. Закономерности в изменении свойств элементов и их соединений в связи с
- 4. В1 (2011) В ряду химических элементов Si – Ge – Sn 1) увеличивается число электронных слоев
- 5. В2 (2010) Химические свойства простых веществ и оксидов Оксид меди (II) реагирует с 1) водой 2)
- 6. В2 (2011) Первоначальные сведения об органических веществах Метан 1) является составной частью природного газа 2) относится
- 7. В3 (2010)Степень окисления химических элементов. ОВР. Окислитель, восстановитель Установите соответствие между изменением степени окисления атома серы
- 8. В3 (2011)Степень окисления химических элементов. ОВР. Окислитель, восстановитель Установите соответствие между схемой превращения и изменением степени
- 9. В4 Задание В4 считается выполненным верно, если правильно установлено 3 соответствия; частично верным, если установлено 2
- 10. В4 (2010)Химические свойства кислот, оснований, солей (средних) Установите соответствие между исходными веществами и продуктами реакции. ИСХОДНЫЕ
- 11. В4 (2011)Химические свойства кислот, оснований, солей (средних) Установите соответствие между веществом и реагентами, с которыми оно
- 12. БЛОК С Уровень: высокий 1 задание – 4 балла 2 задание – 3 балла 3 задание
- 13. С1 Взаимосвязь различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления. Проверяемые умения и
- 14. Дана схема превращений: Cu → Cu(NO3)2 → X → CuO Напишите молекулярные уравнения реакций, с помощью
- 15. С2 Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества по
- 16. После пропускания через раствор гидроксида калия 1,12 л углекислого газа (н.у.) получили 138 г раствора карбоната
- 17. С3 Химические свойства простых веществ Химические свойства сложных веществ. Качественные реакции на ионы в растворе (хлорид-,
- 19. Скачать презентацию
















 Хімічні властивості кислот
Хімічні властивості кислот Химический элемент. Неон
Химический элемент. Неон Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно
Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно Дегтярева М.О. Московская область г. Королёв АОУ ЛНИП 242-645-771
Дегтярева М.О. Московская область г. Королёв АОУ ЛНИП 242-645-771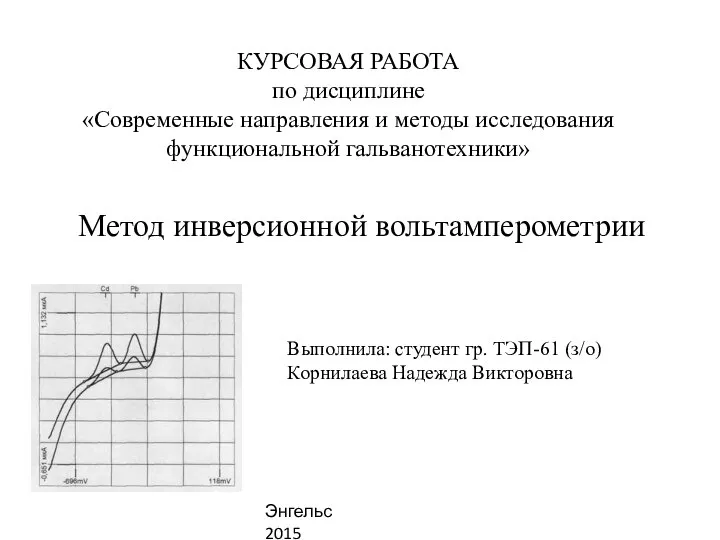 Метод инверсионной вольтамперометрии
Метод инверсионной вольтамперометрии Аморфные тела
Аморфные тела Получение силикагеля, модифицированного бензоксазолами
Получение силикагеля, модифицированного бензоксазолами Липиды. Составные части липидов
Липиды. Составные части липидов Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате
Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате Ниобий. Химические свойства
Ниобий. Химические свойства Биохимия лёгких
Биохимия лёгких Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Типы химических реакции
Типы химических реакции Кристаллы
Кристаллы Синтетический каучук
Синтетический каучук Презентация по Химии "Путешествие в неограниченную химию" - скачать смотреть
Презентация по Химии "Путешествие в неограниченную химию" - скачать смотреть  Химия актиноидов
Химия актиноидов Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления Метаболизм глицерофосфолипидов. Метаболизм холестерола. (Лекция 10)
Метаболизм глицерофосфолипидов. Метаболизм холестерола. (Лекция 10) Вторичная переработка углеводородов
Вторичная переработка углеводородов Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Оксид азота(2) NO
Оксид азота(2) NO Жидкие кристаллы
Жидкие кристаллы Важнейшие бинарные соединения
Важнейшие бинарные соединения Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы «Человек в мире веществ, материалов и химических реакций». «Химические вещества как строительные и поделочные материалы». М
«Человек в мире веществ, материалов и химических реакций». «Химические вещества как строительные и поделочные материалы». М