Содержание
- 2. Цели: Обобщить и систематизировать знания о щелочноземельных металлах Уметь характеризовать элементы по положению в периодической таблице
- 3. Положение в периодической таблице. Строение атома В периодической системе находятся в главной подгруппе II группы. Являются
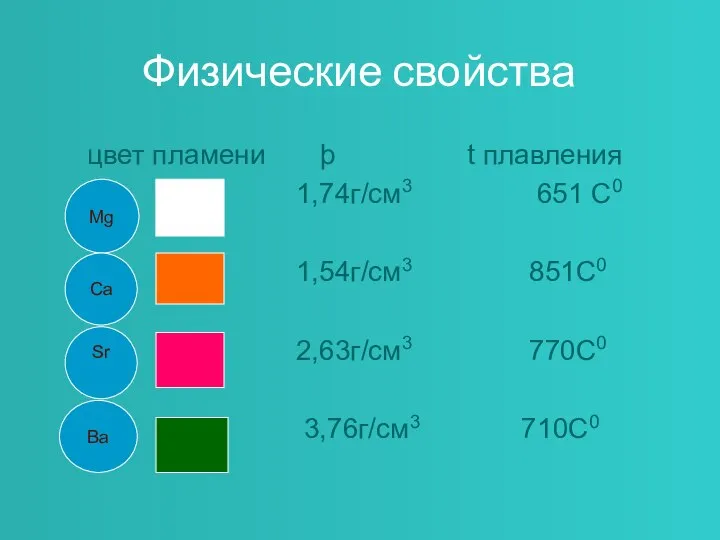
- 4. Физические свойства цвет пламени þ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0
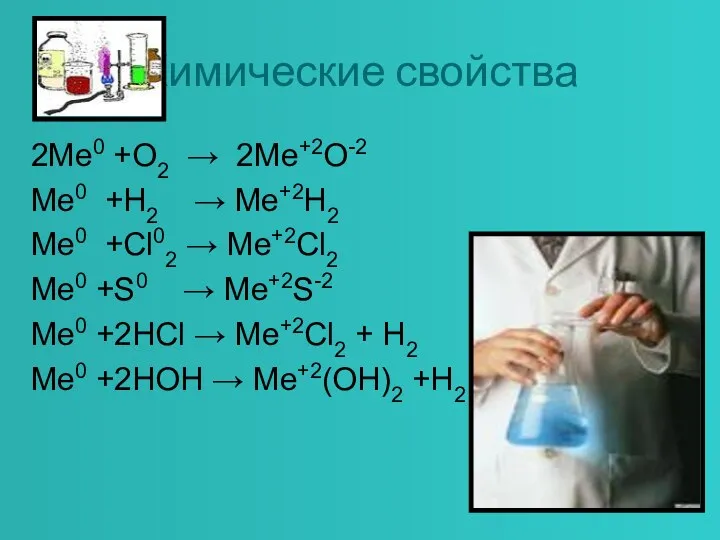
- 5. Химические свойства 2Me0 +O2 → 2Me+2O-2 Me0 +H2 → Me+2H2 Me0 +Cl02 → Me+2Cl2 Me0 +S0
- 6. Соединения щелочноземельных металлов Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.
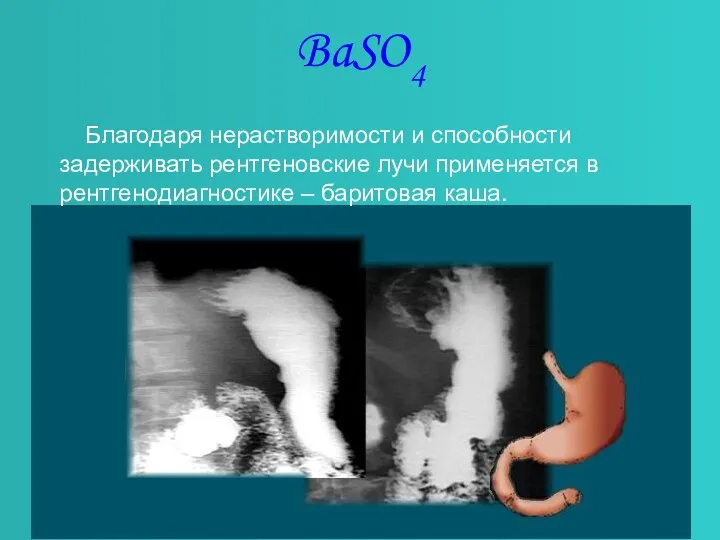
- 7. BaSO4 Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
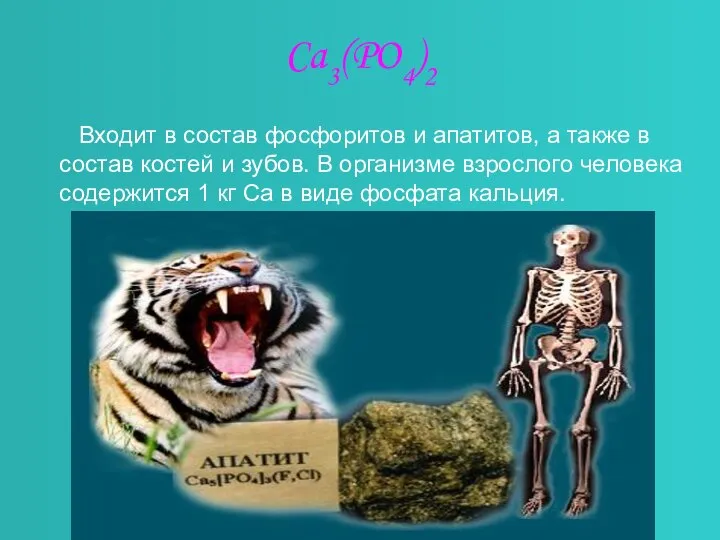
- 8. Ca3(PO4)2 Входит в состав фосфоритов и апатитов, а также в состав костей и зубов. В организме
- 9. CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные породы –
- 10. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в
- 11. MgCO3 Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы
- 12. Са(ОН)2 Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется
- 13. Проверка знаний Сравните атомы элементов, поставив знаки или = вместо *: а) заряд ядра: Mg *
- 14. Проверь себя (самостоятельная работа ) Дополните схемы взаимодействия щелочноземельных металлов с неметаллами общими формулами и названиями
- 15. Домашнее задание: § 12. упр. № 5, 8 Написать уравнения реакций с помощью которых можно осуществить
- 17. Скачать презентацию










 Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Презентация по Химии "Неорганические кислоты" - скачать смотреть
Презентация по Химии "Неорганические кислоты" - скачать смотреть  АЛОТРОПНІ ФОРМИ КАРБОНУ АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 9-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕ
АЛОТРОПНІ ФОРМИ КАРБОНУ АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 9-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕ Металлический водород
Металлический водород Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу
Аминокислоты «Единственный путь, ведущий к знанию – это деятельность» Б. Шоу Горные породы: гранит, базальт
Горные породы: гранит, базальт Ниобий. Физиологическое действие
Ниобий. Физиологическое действие Обмен холестерола
Обмен холестерола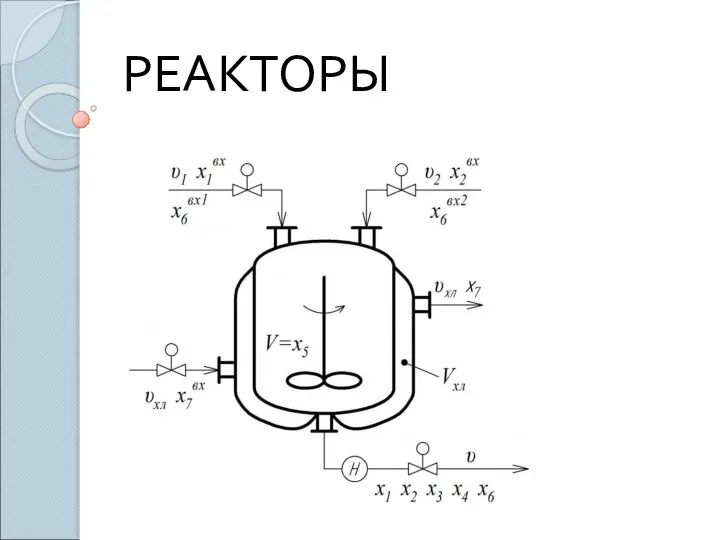 Реакторы. Основные требования к промышленным реакторам
Реакторы. Основные требования к промышленным реакторам Полімери
Полімери Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Ауыр металдар
Ауыр металдар Основные способы получения солей. Отдельные представители солей
Основные способы получения солей. Отдельные представители солей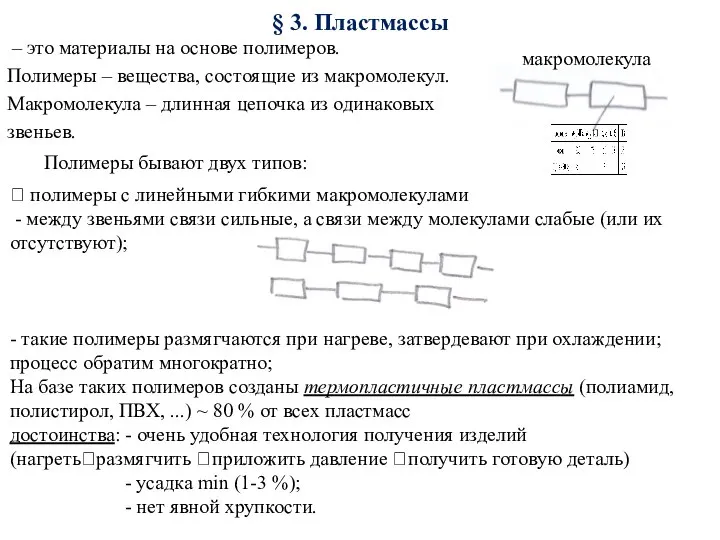 Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы
Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы Полисахариды. Крахмал. Целлюлоза
Полисахариды. Крахмал. Целлюлоза Щелочноземельные металлы
Щелочноземельные металлы Сероводород в природе. Получение сероводорода синтетическим способом
Сероводород в природе. Получение сероводорода синтетическим способом Периодическая система химических элементов. Простые и сложные вещества
Периодическая система химических элементов. Простые и сложные вещества Аналитическая химия стойких органических загрязнителей
Аналитическая химия стойких органических загрязнителей Презентация по химии Аналитическая химия
Презентация по химии Аналитическая химия Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Презентация по Химии "Амфотерные свойства воды" - скачать смотреть
Презентация по Химии "Амфотерные свойства воды" - скачать смотреть  История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Интеррактивный кроссворд на тему: Химическая посуда и лабораторное оборудование
Интеррактивный кроссворд на тему: Химическая посуда и лабораторное оборудование Алюминий
Алюминий Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Презентация по Химии "РАДИОИЗОТОПНЫЙ КОМПЛЕКС РИЦ-80. РАЗРАБОТКА НОВЫХ МЕТОДОВ ПОЛУЧЕНИЯ ГЕНЕРАТОРНОГО ИЗОТОПА Sr-82 И ДРУГИХ МЕДИ
Презентация по Химии "РАДИОИЗОТОПНЫЙ КОМПЛЕКС РИЦ-80. РАЗРАБОТКА НОВЫХ МЕТОДОВ ПОЛУЧЕНИЯ ГЕНЕРАТОРНОГО ИЗОТОПА Sr-82 И ДРУГИХ МЕДИ