Гидролизу не подвергается нерастворимые соли и соли, образованные сильным основанием (щёлочи)
и сильной кислотой (HCl, HClO4, HNO3, H2SO4 ), среда раствора нейтральная, рН=7.
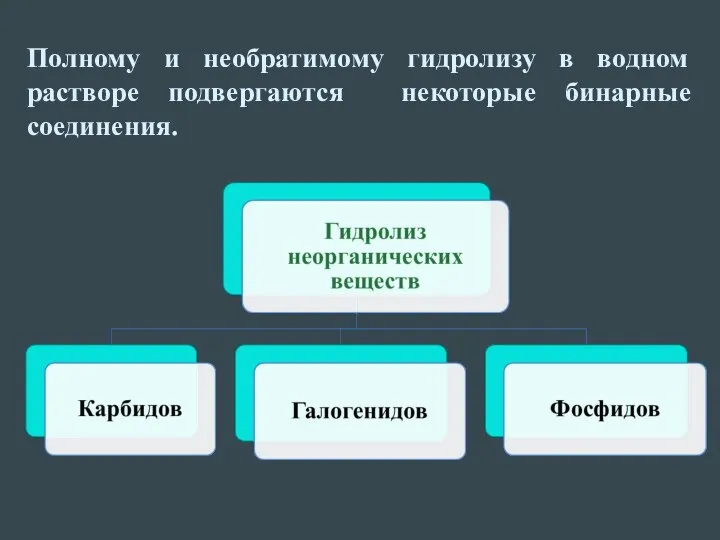
Гидролизу подвергается:
1) соль, образованная сильным основанием и слабой кислотой (HClO, HNO2, H2S, H2SiO3, H2CO3 включая органические кислоты), гидролиз по аниону, среда щелочная, рН>7.
2) соль, образованная слабым основанием (NH3∙H2O, органические амины, нерастворимые гидроксиды металлов) и сильной кислотой, гидролиз по катиону, среда раствора кислая, рН<7.
3) соль, образованная слабым основанием и слабой кислотой, гидролиз по катиону и аниону. Реакция среды определяется сравнением Кд слабых электролитов. Среда определяется большим значением Кд , но близка к нейтральной.
Свойства








 Свинец. Строение атома свинца
Свинец. Строение атома свинца Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Утворення кристалів у природі
Утворення кристалів у природі  ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ
ЗОЛОТОЙ ВЕК ГОЛЛАНДСКОЙ ЖИВОПИСИ  Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3 Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1 Опал
Опал Механизм старения масел
Механизм старения масел Алкины
Алкины Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Медь и сплавы
Медь и сплавы Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Ап-конверсионная люминесценция в наностеклокерамике
Ап-конверсионная люминесценция в наностеклокерамике Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Газификация тяжёлых нефтяных остатков. Конверсия природного газа
Газификация тяжёлых нефтяных остатков. Конверсия природного газа Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Геохимия агроландшафтов
Геохимия агроландшафтов Көмірсулар. Моносахаридтер
Көмірсулар. Моносахаридтер Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения
Азотсодержащие и гетероциклические соединения. Низкомолекулярные биологическиактивные соединения Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА Органическая химия
Органическая химия Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Материаловедение. Основы металловедения
Материаловедение. Основы металловедения Презентация по Химии "Органические вещества" - скачать смотреть бесплатно
Презентация по Химии "Органические вещества" - скачать смотреть бесплатно Галогены. Галогеноводородные кислоты и их соли
Галогены. Галогеноводородные кислоты и их соли