Содержание
- 2. Признаки характеристики кислоты по содержанию атомов кислорода в молекуле по основности по растворимости по степени электролитической
- 3. Физические свойства кислоты Жидкость. Бесцветная, маслянистая. Растворима в воде в любых пропорциях. плотность кислоты 1,83г/мл. В
- 4. А как правильно ? Сначала вода, потом кислота. Иначе будет большая беда!
- 5. Химические( общие) свойства серной кислоты H2SO4 реагирует: с металлами, стоящими в электрохимическом ряду до водорода с
- 6. Опыт №1 Взаимодействие кислоты с металлами Возьмите пробирку. Аккуратно опустите в неё кусочек цинка. Прилейте по
- 7. Взаимодействие кислоты с металлами 0 +1 +2 0 Zn + H2S04 = ZnS04 + H2
- 8. Взаимодействие кислоты с металлами, стоящими после водорода 0 +6 +2 +4 Сu + H2S04 = CuS04
- 9. Опыт №2 Взаимодействие кислоты с оксидами металлов Возьмите чистую пробирку Насыпьте немного оксида меди (порошок черного
- 10. Качественная реакция на сульфат - ион Ba2+ +SO42- = BaSO4 белый осадок «Молоко»
- 12. ПЕЧЬ ДЛЯ ОБЖИГА
- 13. Для успешного проведения процесса обжига пирита необходимо соблюдать следующие условия: 1) Увеличивают концентрацию реагентов – вместо
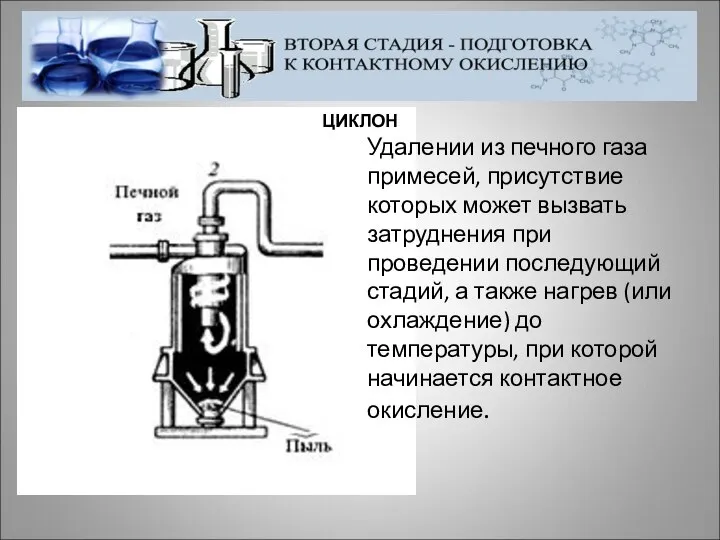
- 14. ЦИКЛОН Удалении из печного газа примесей, присутствие которых может вызвать затруднения при проведении последующий стадий, а
- 15. ЭЛЕКТРОФИЛЬТР Обжиговый или печной газ, полученный сжиганием колчедана в печах КС содержит большое количество огарковой пыли
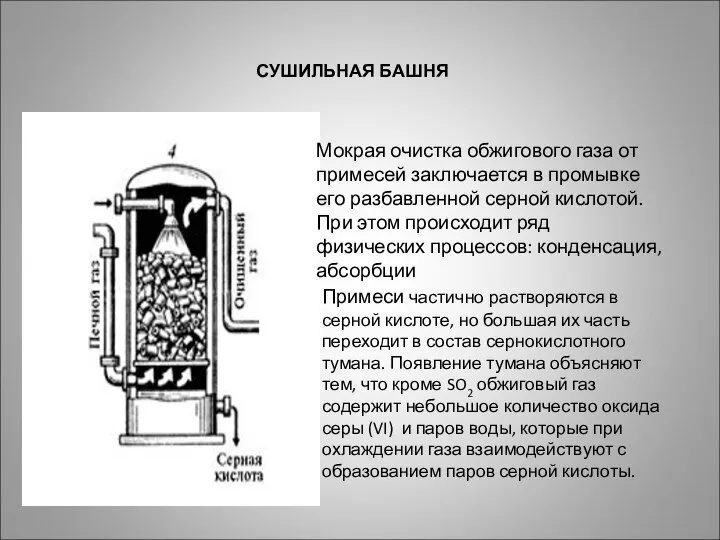
- 16. Мокрая очистка обжигового газа от примесей заключается в промывке его разбавленной серной кислотой. При этом происходит
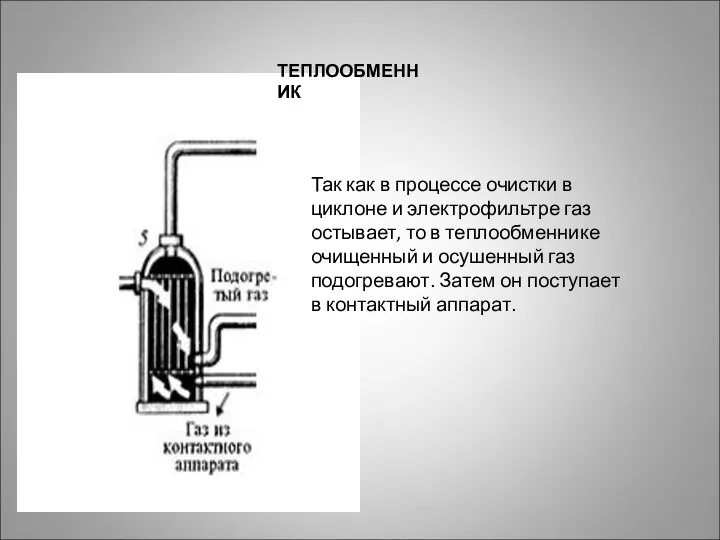
- 17. ТЕПЛООБМЕННИК Так как в процессе очистки в циклоне и электрофильтре газ остывает, то в теплообменнике очищенный
- 18. КОНТАКТНЫЙ АППАРАТ 2SO2 + O2 → 2SO3 +197кДж Реакция окисления диоксида серы возможна лишь в присутствии
- 19. Выводы: Подводя итог сказанному следует сделать вывод - для успешного проведения процесса производства серной кислоты на
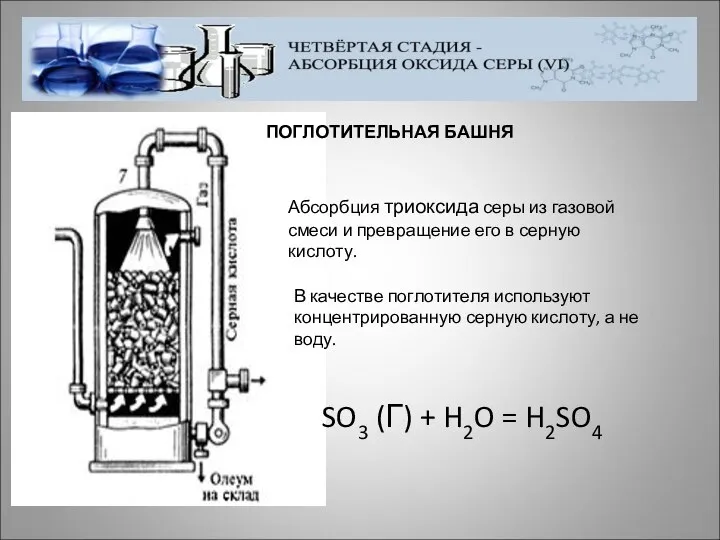
- 20. ПОГЛОТИТЕЛЬНАЯ БАШНЯ Абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. В качестве
- 22. Скачать презентацию















 Химия и сельское хозяйство
Химия и сельское хозяйство  Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Свойства простых веществ 8 класс
Свойства простых веществ 8 класс  Природа и классификация химических связей
Природа и классификация химических связей Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс
Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс  Спирты. Номенклатура спиртов
Спирты. Номенклатура спиртов Биохимическая классификация гормонов
Биохимическая классификация гормонов Таблица Менделеева
Таблица Менделеева Элементы V А группы. Азот и его соединения
Элементы V А группы. Азот и его соединения Деструкция углеводородов
Деструкция углеводородов Гибридизация атома углерода
Гибридизация атома углерода Алкины. Строение алкинов
Алкины. Строение алкинов Вода. Растворимость, растворы
Вода. Растворимость, растворы ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ. Глицерин. Свойства и применение
Глицерин. Свойства и применение Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Влияние кислотной и щелочной среды на развитие растений
Влияние кислотной и щелочной среды на развитие растений Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт) Chemical equilibrium. (Chapter 3)
Chemical equilibrium. (Chapter 3) Группа рассеянных химических элементов
Группа рассеянных химических элементов Медь. Содержание в природе
Медь. Содержание в природе Генетическая связь между основными классами органических соединений
Генетическая связь между основными классами органических соединений Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Углеводы: простые и сложные. Строение, свойства и биологическая роль
Углеводы: простые и сложные. Строение, свойства и биологическая роль Водороды
Водороды Первые русские женщины-химики
Первые русские женщины-химики Хімічнi елементи
Хімічнi елементи Нітрати та нітриди та їх вплив на навколишнє середовище
Нітрати та нітриди та їх вплив на навколишнє середовище