Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Содержание
- 2. ЦЕЛИ ТУРНИРА: ВЫЯВИТЬ НАИБОЛЕЕ ПОДГОТОВЛЕННЫХ УЧАЩИХСЯ, ИМЕЮЩИХ ОСОБЫЕ СПОСОБНОСТИ И СКЛОННОСТИ К ПРЕДМЕТУ химия ПОДДЕРЖАТЬ И
- 3. ПРЕДМЕТНЫЕ СЕКЦИИ 8 КЛАСС 11 КЛАСС 10 КЛАСС 9 КЛАСС
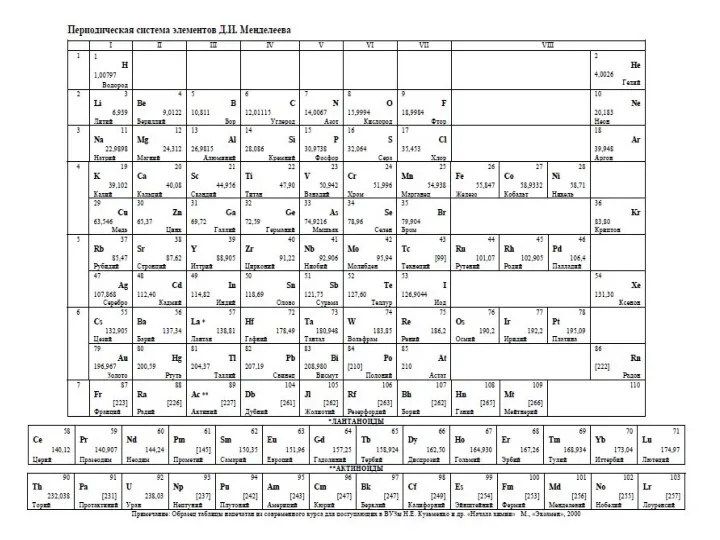
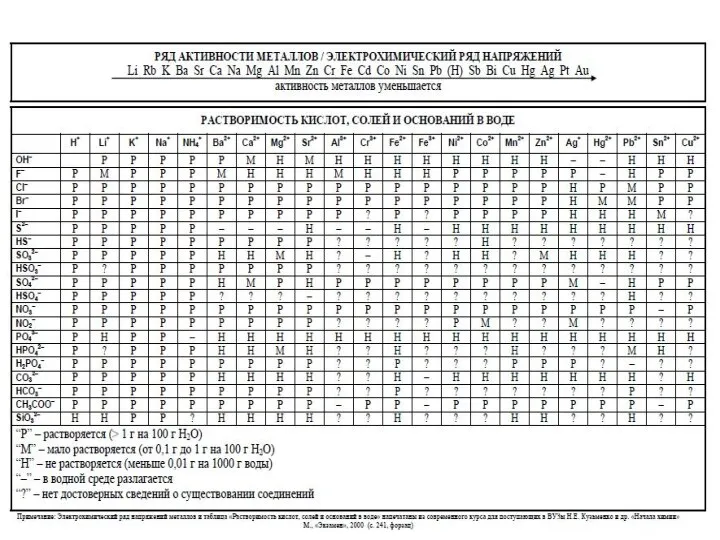
- 4. Дополнительные материалы На Турнире можно использовать таблицы: “Периодическая система химических элементов Д.И. Менделеева” “Растворимость оснований, кислот
- 7. Правила округления Округление результата измерения достигается простым отбрасыванием цифр, если первая из отбрасываемых цифр меньше 5.
- 8. В случае получения ответа в виде числа его необходимо округлить до десятых (использую правила округления) и
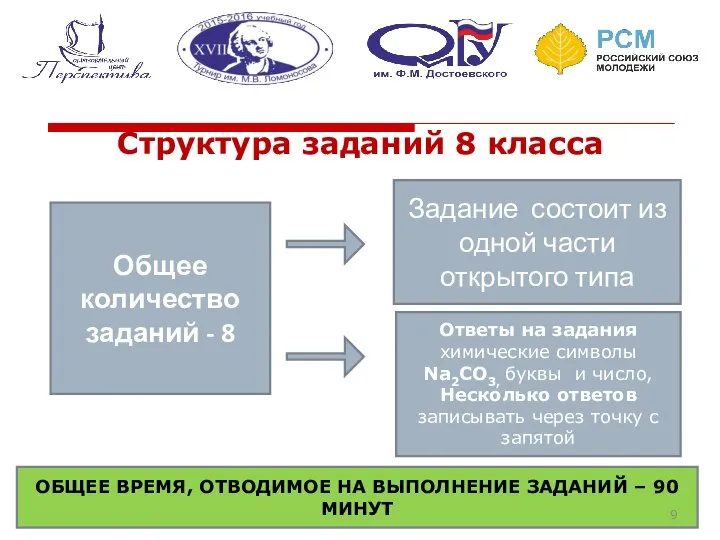
- 9. Структура заданий 8 класса Общее количество заданий - 8 Задание состоит из одной части открытого типа
- 10. Перечень проверяемых умений в задание по темам Вычисление массовых долей (процентного содержания) элементов в сложном веществе
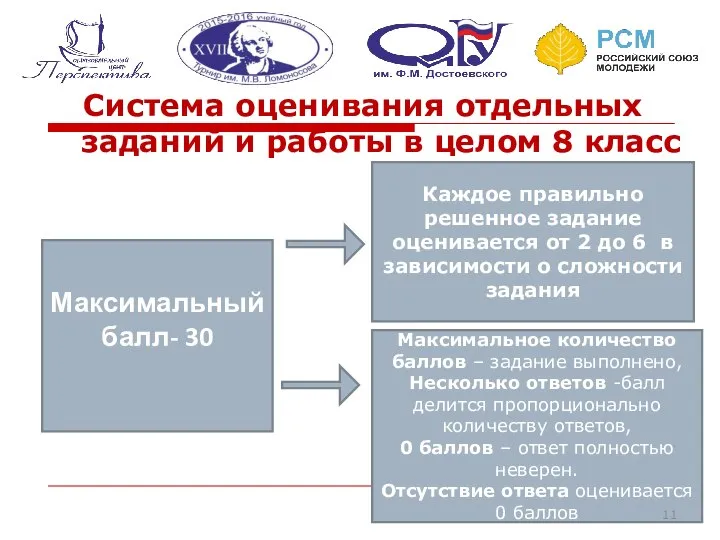
- 11. Система оценивания отдельных заданий и работы в целом 8 класс Максимальный балл- 30 Каждое правильно решенное
- 12. Определить массовую долю раствора полученного при смешивании 1 кг 5% раствора хлорида меди и 100г 10%
- 13. Определить массовую долю раствора полученного при смешивании 1 кг 5% раствора хлорида меди и 100г 10%
- 14. Массовая доля азота в оксиде азота равна 36,84 % . Найти формулу данного оксида. Решение: 1.
- 15. Определите, какова масса 1 моля H2S, какой объём занимают (н.у.) и сколько атомов водорода содержат данное
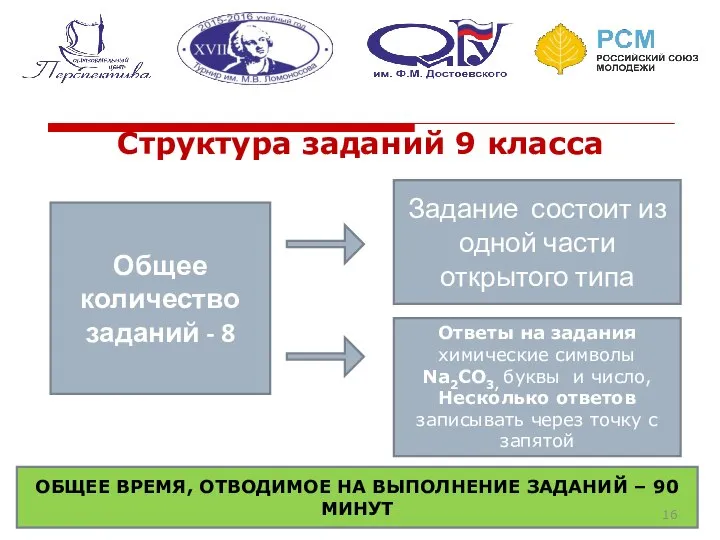
- 16. Структура заданий 9 класса Общее количество заданий - 8 Задание состоит из одной части открытого типа
- 17. Перечень проверяемых умений в задание по темам Вычисление массовых долей (процентного содержания) элементов в сложном веществе
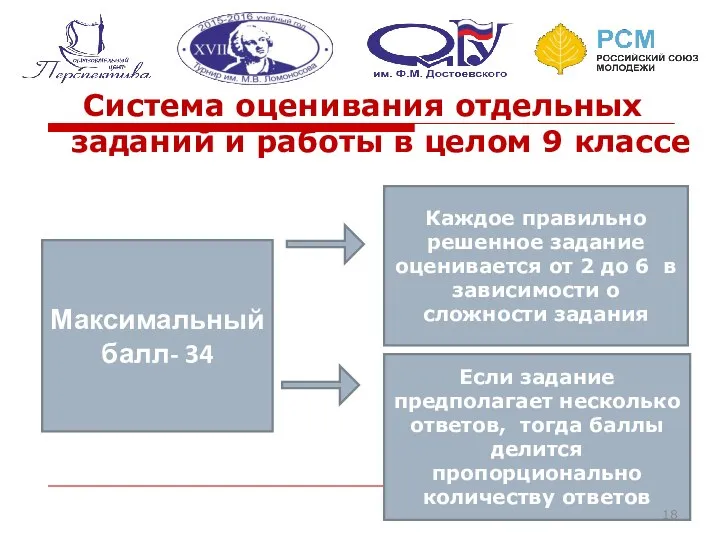
- 18. Система оценивания отдельных заданий и работы в целом 9 классе Максимальный балл- 34 Каждое правильно решенное
- 19. Используя метод электронного баланса, составьте уравнение реакции, в ответе укажите сумму коэффициентов правой частей уравнения реакции.
- 20. Разновидности заданий для 10 класса Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5
- 21. Какова процентная концентрация раствора сернистой кислоты, полученной растворением 1 л (н.у) сернистого газа в 100 мл
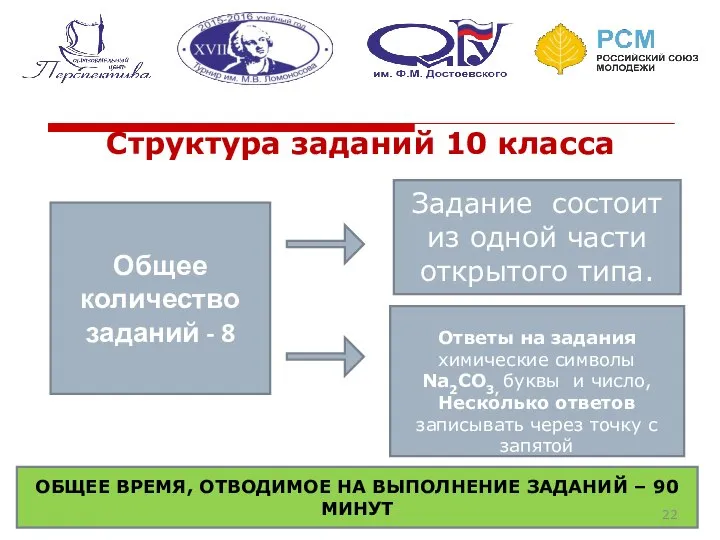
- 22. Структура заданий 10 класса Общее количество заданий - 8 Задание состоит из одной части открытого типа.
- 23. Перечень проверяемых умений в задание по темам Вычисление массовой доли растворенного вещества в растворе, если известна
- 24. Перечень проверяемых умений в задание по темам Вычисление массы продукта реакции по известной массе одного из
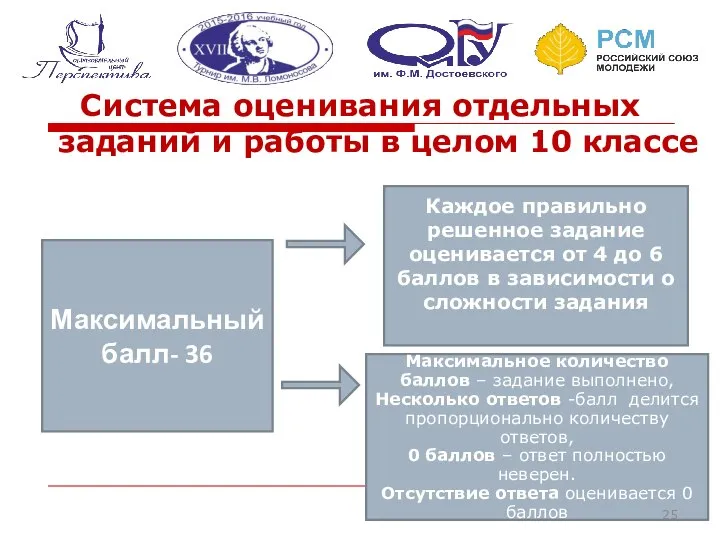
- 25. Система оценивания отдельных заданий и работы в целом 10 классе Максимальный балл- 36 Каждое правильно решенное
- 26. Разновидности заданий для 10 класса Масса фенолята натрия, который образуется при взаимодействии 9,4 г фенола с
- 27. Расставьте степени окисления, уравняйте реакцию, в ответе укажите коэффициент перед окислителем. C6H12O6 + K2Cr2O7 + H2SO4
- 28. При сгорании 7,2 г вещества образовалось 9,9 г углекислого газа и 8,1 г воды. Плотность паров
- 29. Осуществить следующие превращения и в ответе указать вещества Х и У Al4C3 → Х→ CH3Cl →
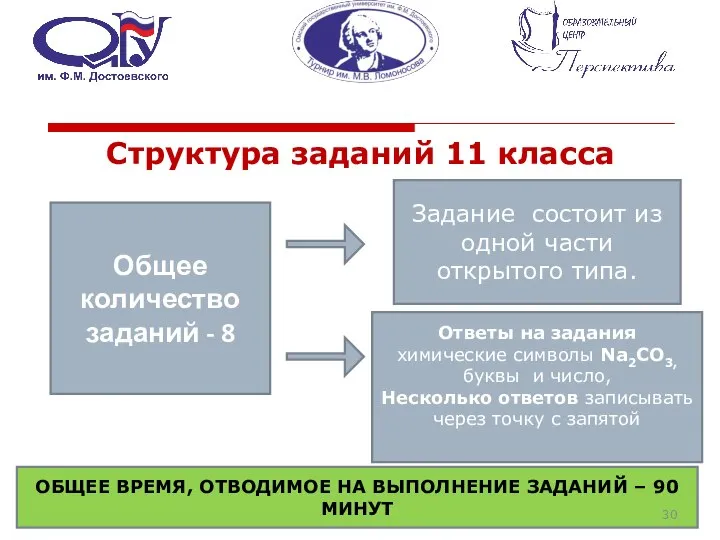
- 30. Структура заданий 11 класса Общее количество заданий - 8 Задание состоит из одной части открытого типа.
- 31. Перечень проверяемых умений в задание по темам Строение атома. Химическая связь. Кинетические и энергетические закономерности протекания
- 32. Перечень проверяемых умений в задание по темам Вычисление относительной плотности газообразных веществ. Вычисление объема (массы) определенного
- 33. Система оценивания отдельных заданий и работы в целом 11 классе Максимальный балл- 46 Каждое правильно решенное
- 34. Разновидности заданий для 11 класса При гидрировании 1 моль циклогексена выделяется 28,5 ккал тепла, а при
- 35. В раствор нитрата серебра погрузили медную пластинку массой 80 г. После полного вытеснения серебра масса пластинки
- 36. Смесь этина и пропина объемом 1,108 л (н.у.) подвергли гидратации в присутствии сульфата ртути (II). При
- 37. Рекомендуемая литература http://www.chem.msu.su/rus/elibrary Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. М.: Высшая
- 39. Скачать презентацию


























 Обмен липидов
Обмен липидов Цифровые лаборатории «Архимед» в изучении биологии и химии
Цифровые лаборатории «Архимед» в изучении биологии и химии Комплексные соединения
Комплексные соединения Автоматизированное управление химико-технологическими процессами
Автоматизированное управление химико-технологическими процессами Методика решения части С2 ГИА 9 класс
Методика решения части С2 ГИА 9 класс Природній газ
Природній газ  Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Спін-спінова взаємодія в спектрах ямр
Спін-спінова взаємодія в спектрах ямр Строение белков
Строение белков Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно
Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно Metals
Metals Наполнители и армирующие элементы полимерных композиционных материалов. (Тема 4)
Наполнители и армирующие элементы полимерных композиционных материалов. (Тема 4) Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Растворы. Теория электролитической диссоциации. Гидролиз
Растворы. Теория электролитической диссоциации. Гидролиз Сложные эфиры Урок химии в 10 классе
Сложные эфиры Урок химии в 10 классе Алмазы
Алмазы Соединения алифатического ряда
Соединения алифатического ряда Особенности ионообменных реакций с участием биологически активных веществ. Ионообменная сорбция пептидов и белков
Особенности ионообменных реакций с участием биологически активных веществ. Ионообменная сорбция пептидов и белков Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Штучні і синтетичні волокна
Штучні і синтетичні волокна  Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Жидкие кристаллы
Жидкие кристаллы История изучения структуры белка Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру
История изучения структуры белка Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру Химический турнир «Химия –наука чудес и превращений»
Химический турнир «Химия –наука чудес и превращений» Аморфные тела
Аморфные тела Микрокристаллоскопия. Микрокристаллоскопический анализ
Микрокристаллоскопия. Микрокристаллоскопический анализ Структура периодической системы элементов
Структура периодической системы элементов Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно