Содержание
- 2. Химическая связь–электростатич. взаимодействие связывающее атомы в ионы, молекулы, кристаллы Основное условие - понижение полной энергии многоатомной
- 3. Характеристики связи
- 4. Длина химической связи (l св) - расстояние между ядрами атомов в соед-ях В однотипных соед-ях длина
- 5. Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим. связи или расходуемая на её разрыв
- 6. Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов O Cl — Be — Cl H
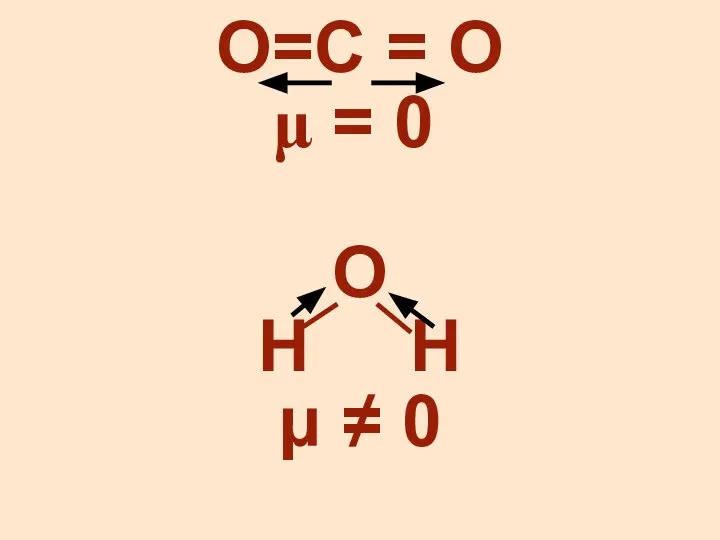
- 8. Дипольный момент – колич-ная характеристика полярности связи μ = ∑qэфф⋅lдип qэфф– эффект. заряд, lдип – длина
- 9. О=С = О = 0 О Н Н μ ≠ 0
- 10. Типы химических связей Распределение электронной плотности между взаимод-ми атомами определяет тип химической связи: ковалентная ионная металлическая
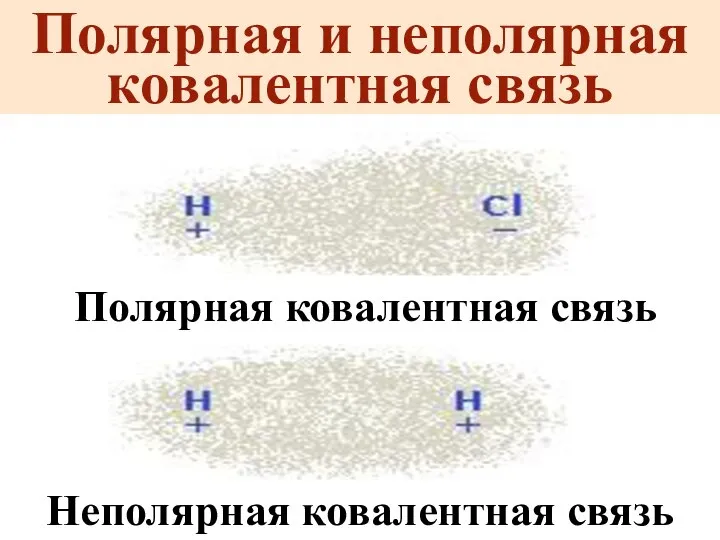
- 11. Типы химических связей Ковалентная неполярная – это связь образующаяся между атомами с одинаковой электроотрицательностью. Н –
- 12. Полярная и неполярная ковалентная связь Полярная ковалентная связь Неполярная ковалентная связь
- 13. Ковалентная связь Для объяснения механизма образования ковалентной хим. связи разработано несколько методов Наиболее применимые: - метод
- 14. Метод валентных связей (ВС) Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или
- 15. Основные положения метода ВС Ков. связь образуют два электрона с противоположными спинами, принадлежащие двум атомам При
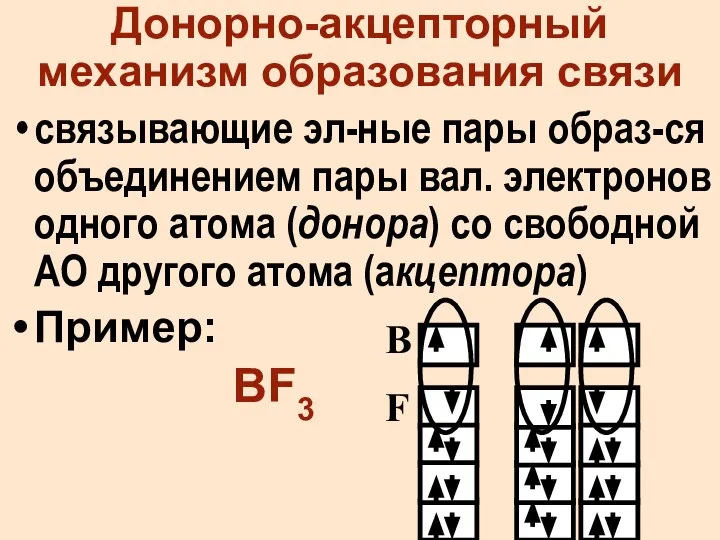
- 16. Донорно-акцепторный механизм образования связи связывающие эл-ные пары образ-ся объединением пары вал. электронов одного атома (донора) со
- 17. Свойства ковалентной связи
- 18. Направленность хим. связи обусловлена перекрыванием электронных облаков - соединение атомов между собой при образовании общих электронных
- 19. Насыщаемость – макс. возможное число связей, определяемое общим числом задействованных орбиталей 1-й период - макс. валентность
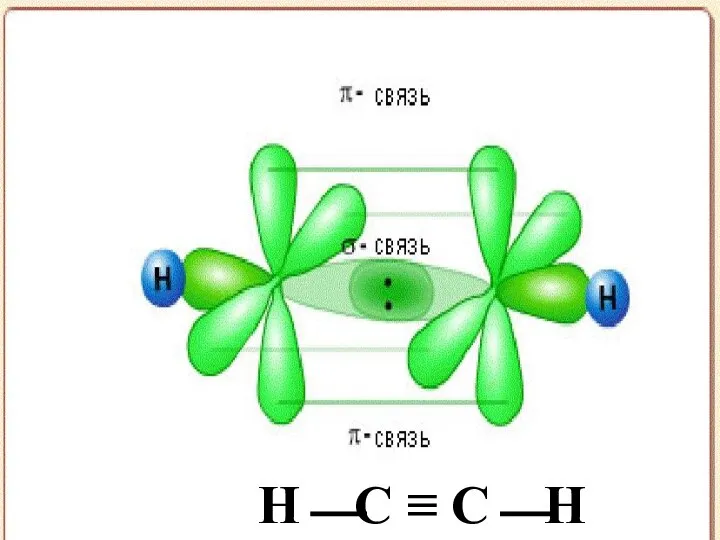
- 20. Типы перекрывания атомных АО σ -взаимодействие возникает при перекрывании орбиталей s – s, s – p,
- 22. H⎯C ≡ C⎯H
- 23. δ - (дельта) взаимодействие, при которой перекрываются d-орбитали четырьмя лепестками По прочности химического взаимодействия располагаются в
- 24. Кратность хим. связи - число общих электронных пар, реализующих связь между двумя атомами Чем выше кратность
- 25. Гибридизация АО Это мат-ий прием отыскания новых волновых функций, удовлетворяющих условию равнопрочности образуемых связей и уменьшению
- 26. Основные положения гибридизации Гибридизуются только орбитали центрального атома Гибридизуются АО с близкой энергией Число гибридных орбиталей
- 27. Гибридные орбитали более вытянуты в пространстве и обеспечивают более полное перекрывание с соседними атомами Гибридные орбитали
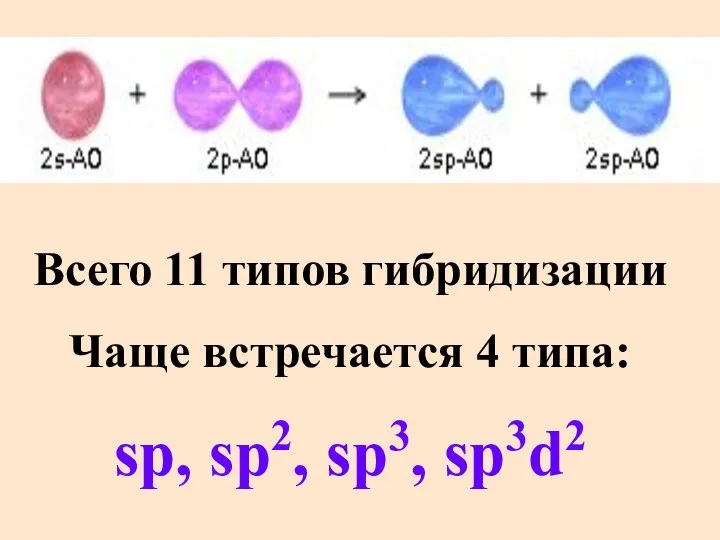
- 28. Всего 11 типов гибридизации Чаще встречается 4 типа: sp, sp2, sp3, sp3d2
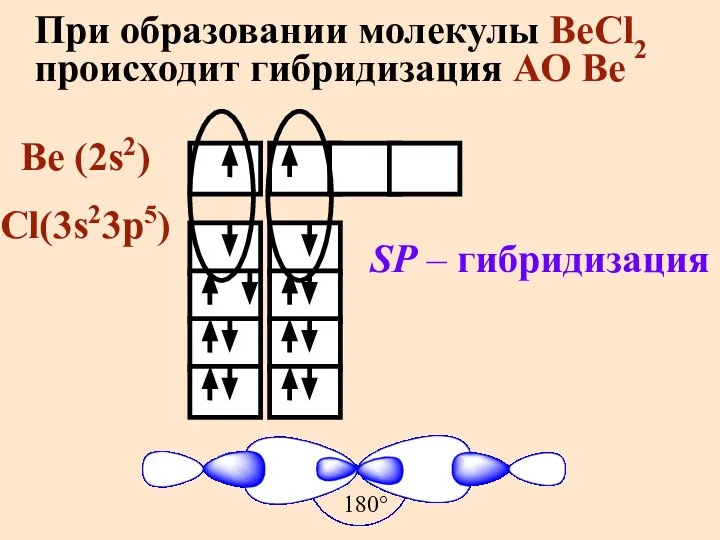
- 29. При образовании молекулы BeCl2 происходит гибридизация АО Be Be (2s2) Cl(3s23p5) SP – гибридизация 180°
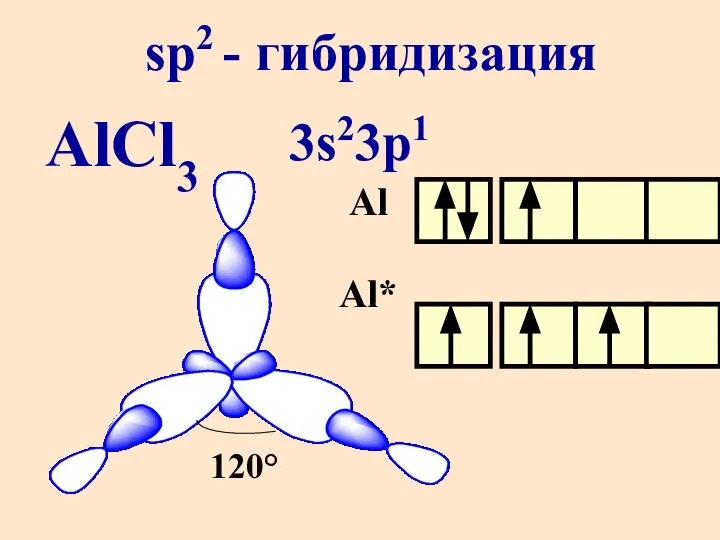
- 30. AlCl3 sp2 - гибридизация 3s23p1 Al Al* 120°
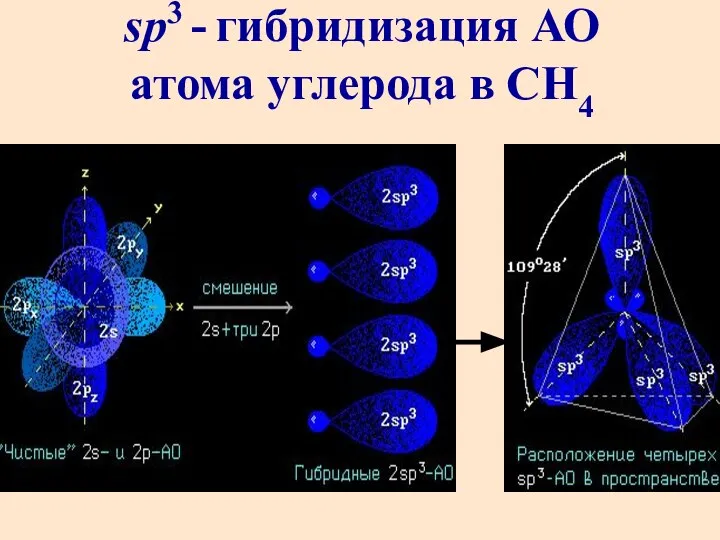
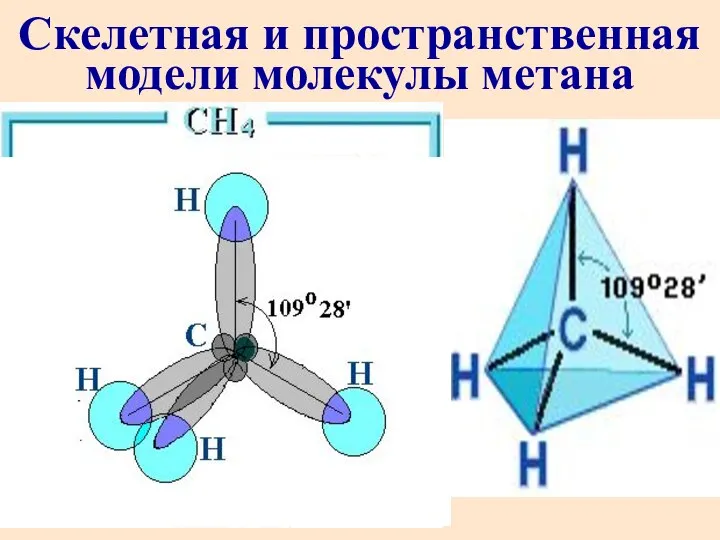
- 31. sp3 - гибридизация АО атома углерода в СН4
- 32. Скелетная и пространственная модели молекулы метана
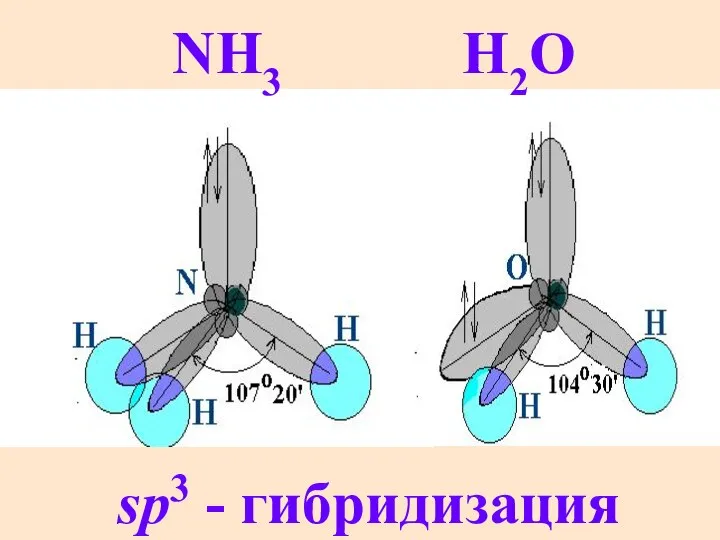
- 33. NH3 H2O sp3 - гибридизация
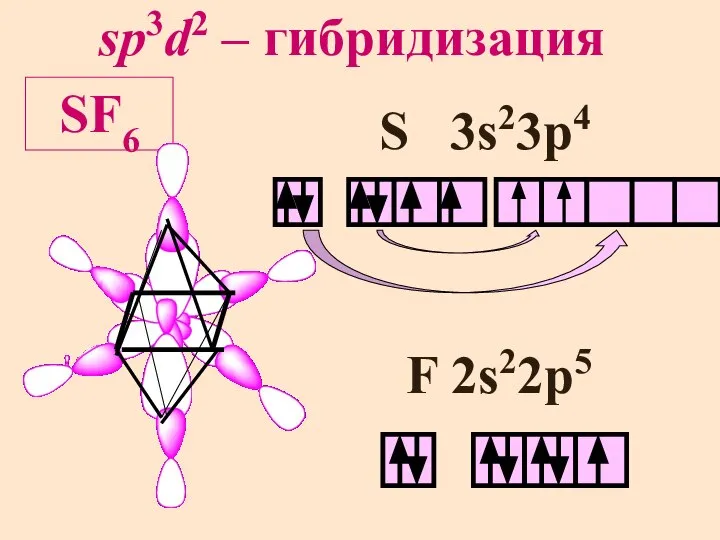
- 34. sp3d2 – гибридизация SF6 S 3s23p4 F 2s22p5
- 35. В гибридизации могут участвовать: Одноэлектронные орбитали Орбитали со спаренными электронами Орбитали без электронов Геометрия молекул и
- 36. Ионная связь Это предельный случай полярной ковалентной связи, когда степень ионности > 50% или ΔЭО >
- 37. Ионная связь Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов Ионные соединения состоят из огромного
- 38. Свойства ионной связи
- 39. Ненаправленность и ненасыщаемость Ненаправленность – способность иона данного знака (+,-) притягивать к себе ионы другого знака
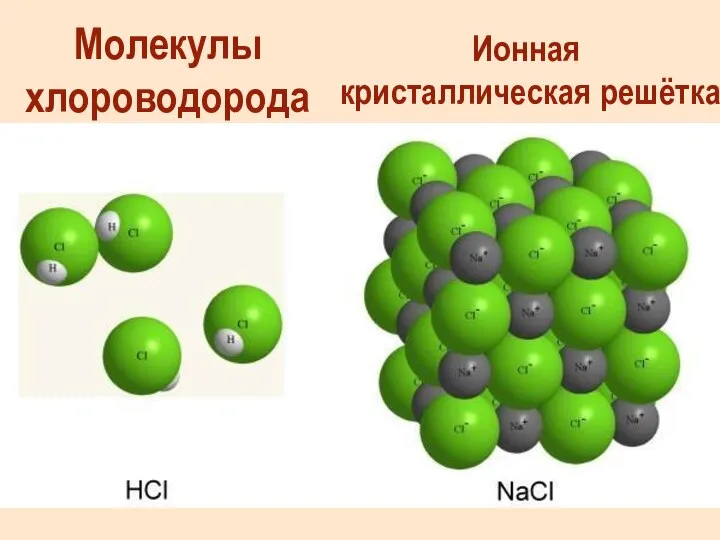
- 40. Молекулы хлороводорода Ионная кристаллическая решётка
- 41. Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества При плавлении и растворении
- 42. Поляризация Это влияние друг на друга ионов, которое приводит к деформации электронных оболочек Причина - действие
- 43. Поляризуемость - деформация электронного облака в электрическом поле Поляризующая способность - деформирующее влияние на другие ионы
- 44. Поляризуемость иона возрастает с ув-м размеров иона Li+ – Na+ – K+ – Rb+ – Cs+
- 45. Поляризующая способность ионов зависит от заряда, размера и типа иона Чем > заряд иона, тем >
- 46. Влияние поляризации на свойства соединений: растворимость термич. устойчивость окраску
- 47. Пример AgCl хуже растворим в воде, чем NaCl и KСl Причина более сильное поляризующее действие Ag+
- 48. Металлическая связь образуется в металлах и их сплавах Осуществляется между ионами, атомами металлов и делокализованными электронами
- 49. Природа металлической связи основана на обобществлении валентных электронов, т.к. валентных электронов меньше, чем вакантных орбиталей, валентные
- 50. Теория электронного газа Все валентные электроны свободны и принадлежат всей крист. решетке. Совокупность электронов наз-ся электронным
- 51. Межмолекулярные взаимодействия с энергией 0,8 — 8,16 кДж/моль называют силами Ван дер Ваальса Обеспечивает переход из
- 52. Водородная связь бывает внутримолекулярная (чаще в орг. молекулах) и межмолекулярная (HF, NH3, H2O, H2O2, H2SO4, H3PO4)
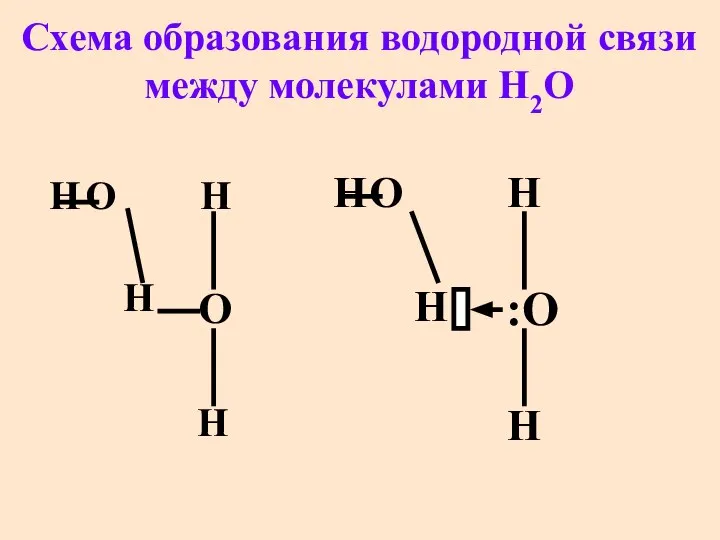
- 53. Cхема образования водородной связи между молекулами H2O Н О Н О Н Н Н О Н
- 55. Скачать презентацию







































 Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Неметаллы: общая характеристика
Неметаллы: общая характеристика Химический состав земной коры
Химический состав земной коры Презентация по Химии "Сульфатна кислота." - скачать смотреть бесплатно_
Презентация по Химии "Сульфатна кислота." - скачать смотреть бесплатно_ Химия - наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования
Химия - наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования Презентація на тему: “Охорона навколишнього середовища під час виробництва і застосування металів”. Виконала учениця 10 класу Каленчук Марія.
Презентація на тему: “Охорона навколишнього середовища під час виробництва і застосування металів”. Виконала учениця 10 класу Каленчук Марія.  Получение хлортетрациклина
Получение хлортетрациклина Катализаторы. Ферменты
Катализаторы. Ферменты Введение в химическую термодинамику
Введение в химическую термодинамику Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т.А. КОМАРОВА
Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т.А. КОМАРОВА Карбоновые кислоты
Карбоновые кислоты Химические реакторы
Химические реакторы Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Азот
Азот Основы органической химии. Кислородсодержащие органические соединения
Основы органической химии. Кислородсодержащие органические соединения Предмет химии. Вещества
Предмет химии. Вещества Строение вещества. Молекулы
Строение вещества. Молекулы Модифицирование структуры полисахаридов гидрофобными заместителями: твердофазный синтез, исследование структуры и свойств
Модифицирование структуры полисахаридов гидрофобными заместителями: твердофазный синтез, исследование структуры и свойств Биосинтез ДНК
Биосинтез ДНК Разложение солей
Разложение солей Термодинамика химического равновесия
Термодинамика химического равновесия Гидрогенизационные процессы переработки нефти и газа
Гидрогенизационные процессы переработки нефти и газа Электролитическая диссоциация
Электролитическая диссоциация Презентация по Химии "Фосфор" - скачать смотреть бесплатно_
Презентация по Химии "Фосфор" - скачать смотреть бесплатно_ Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии Көмірсулар
Көмірсулар “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола
Подходы к отбору методического материала с учётом дифференцированного обучения на уроках химии. cЛукьянова Анастасия Никола