Содержание
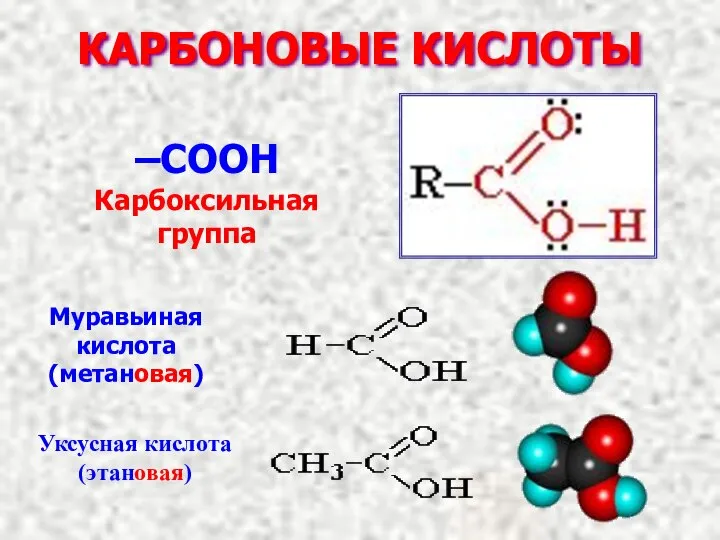
- 2. КАРБОНОВЫЕ КИСЛОТЫ –COOH Карбоксильная группа
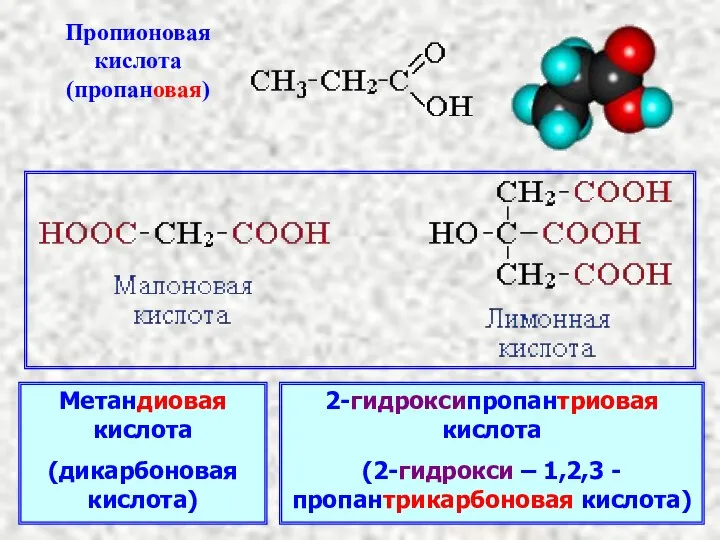
- 3. Метандиовая кислота (дикарбоновая кислота) 2-гидроксипропантриовая кислота (2-гидрокси – 1,2,3 -пропантрикарбоновая кислота)
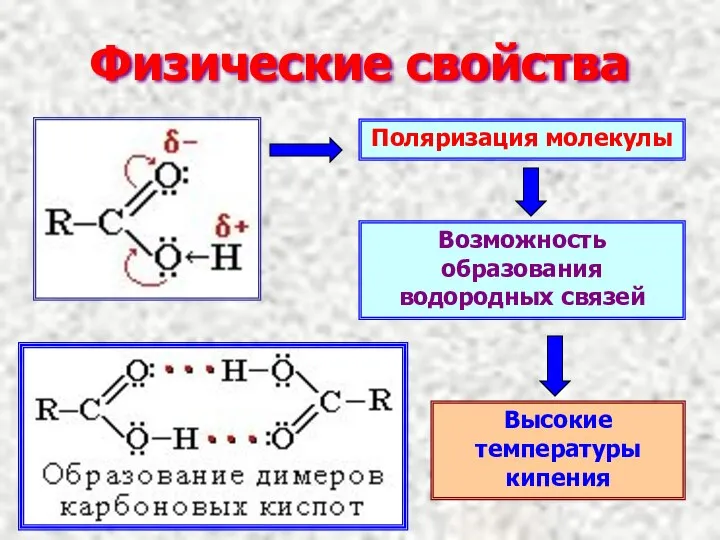
- 5. Физические свойства Поляризация молекулы Возможность образования водородных связей Высокие температуры кипения
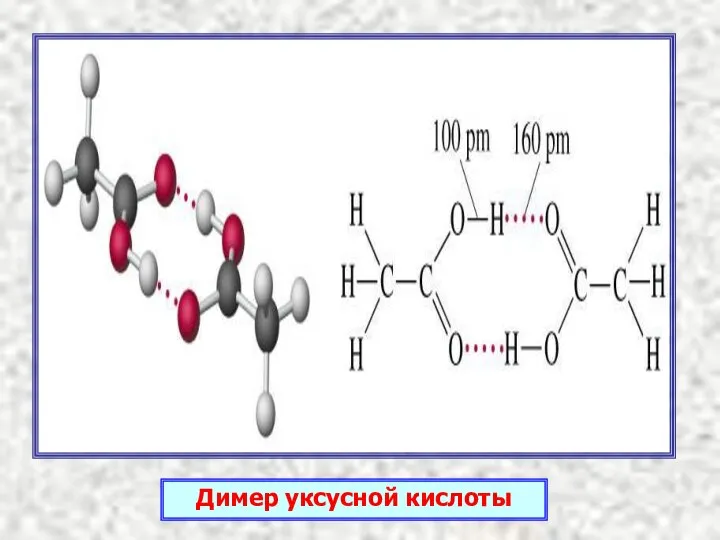
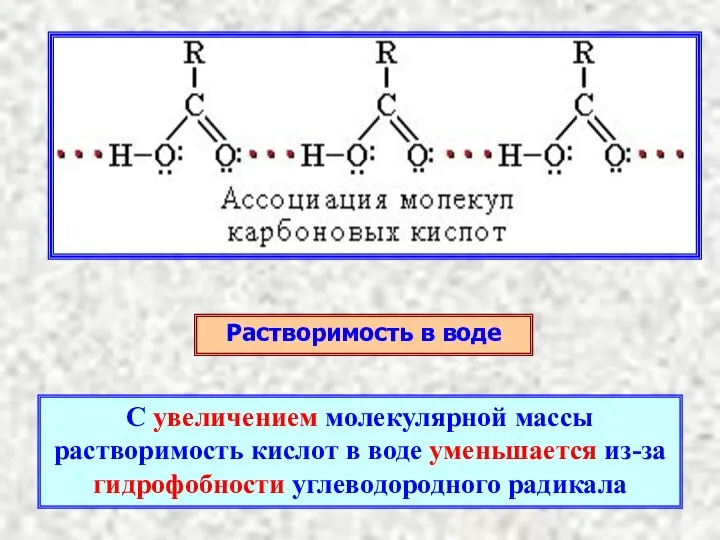
- 6. Димер уксусной кислоты
- 7. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
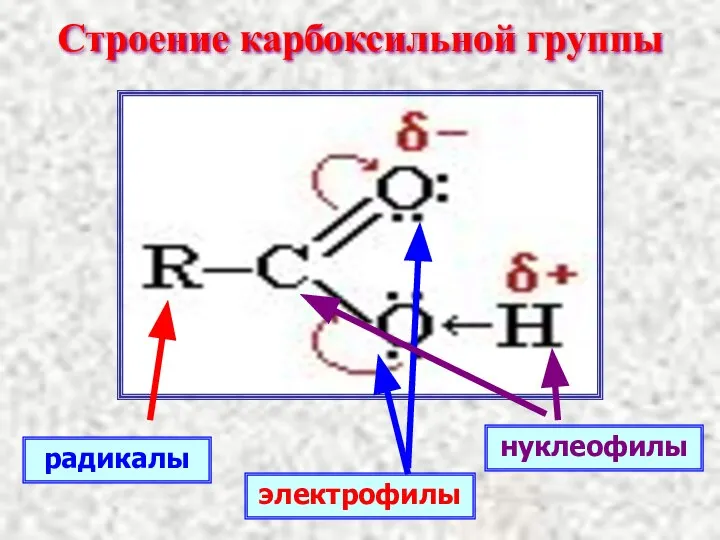
- 8. Строение карбоксильной группы радикалы нуклеофилы электрофилы
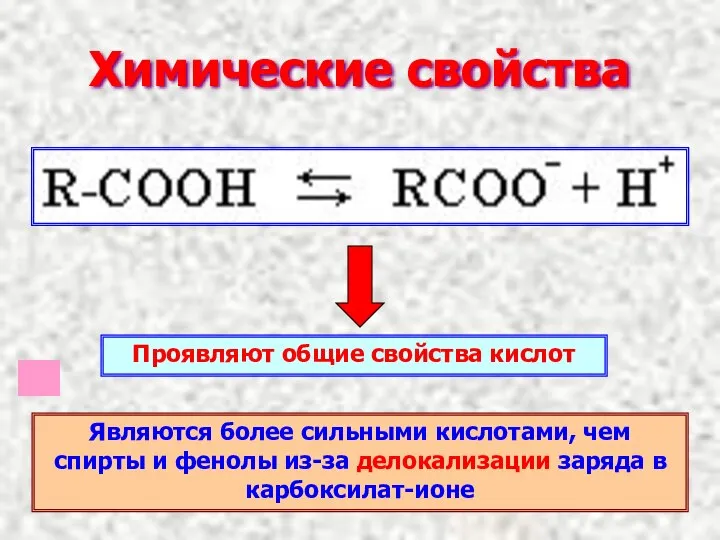
- 9. Химические свойства Проявляют общие свойства кислот Являются более сильными кислотами, чем спирты и фенолы из-за делокализации
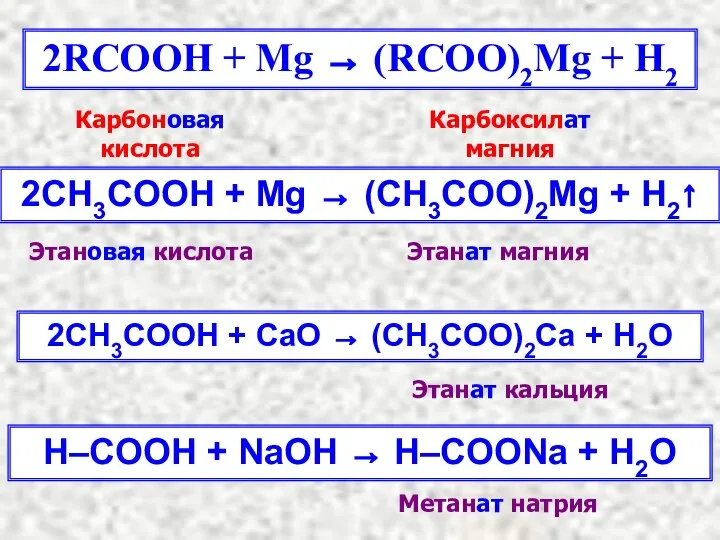
- 10. 2RCOOH + Mg → (RCOO)2Mg + H2 2СH3COOH + Mg → (CH3COO)2Mg + H2↑ Карбоновая кислота
- 11. Галогензамещенные кислоты + Br2 → Образуются при замещении водорода на галоген в углеводородном радикале Галогензамещённые кислоты
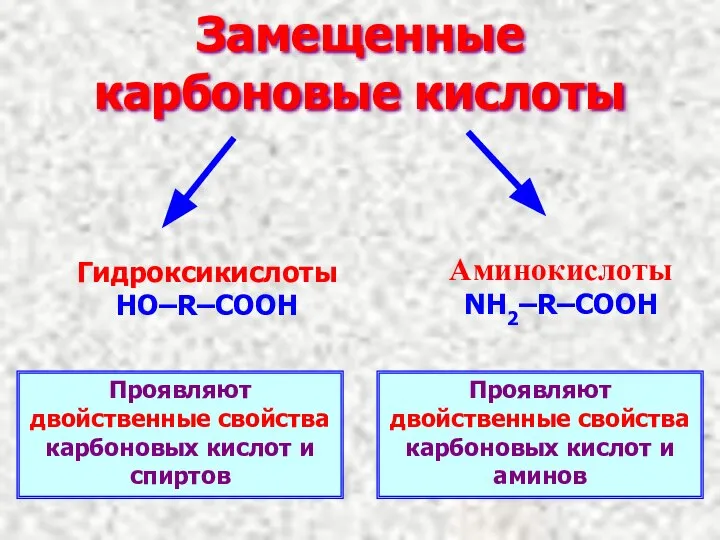
- 12. Замещенные карбоновые кислоты Гидроксикислоты HO–R–COOH Аминокислоты NH2–R–COOH Проявляют двойственные свойства карбоновых кислот и спиртов Проявляют двойственные
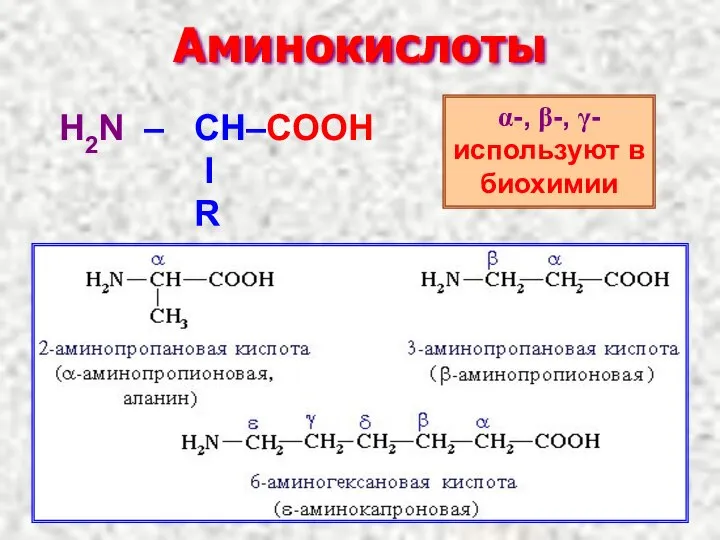
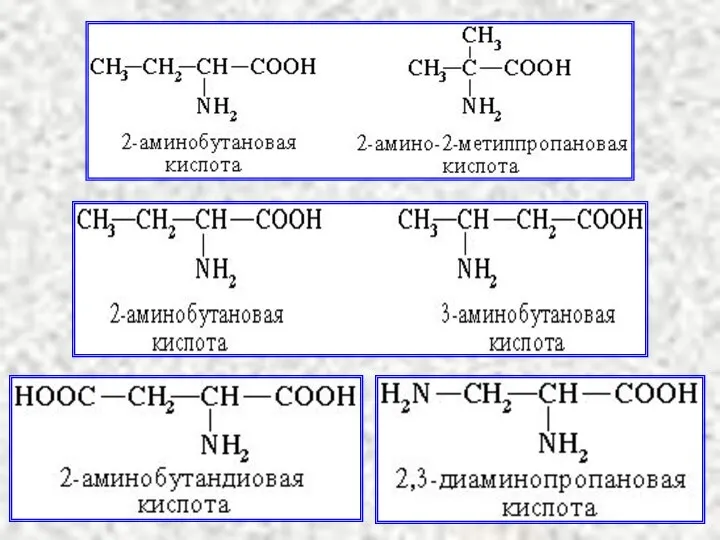
- 13. Аминокислоты α-, β-, γ- используют в биохимии
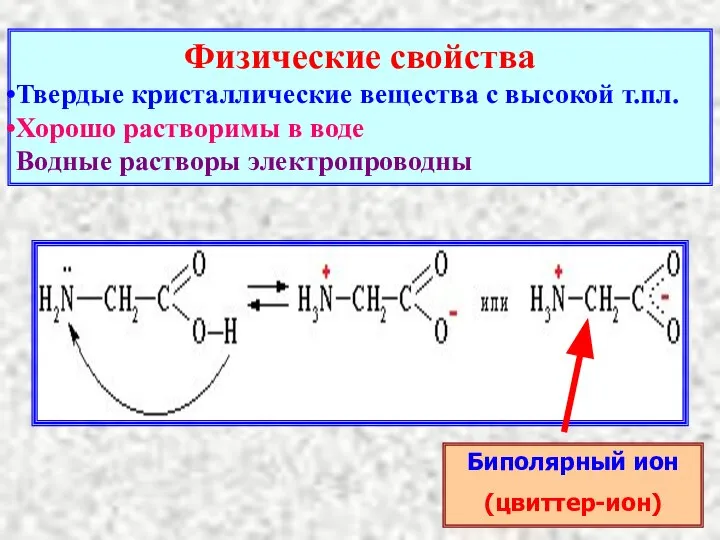
- 15. Физические свойства Твердые кристаллические вещества с высокой т.пл. Хорошо растворимы в воде Водные растворы электропроводны Биполярный
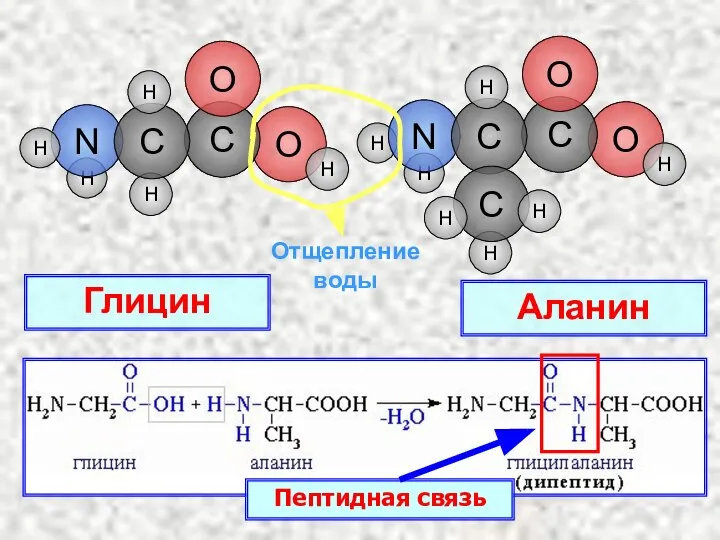
- 16. Химические свойства Аминокислоты являются амфотерными соединениями H2N–CH2–COOH + HCl → Cl− [H3N–CH2–COOH]+ Как основание H2N–CH2–COOH +
- 17. H O H H H H O C N O C H H C H H
- 19. Скачать презентацию



 Водород- зеленое топливо
Водород- зеленое топливо Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания
Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания Неметаллы. Положение неметаллов в ПСХЭ
Неметаллы. Положение неметаллов в ПСХЭ Методы синтеза коллоидных кристаллов. (Лекция 13)
Методы синтеза коллоидных кристаллов. (Лекция 13) Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Возможные роли АФК в старении
Возможные роли АФК в старении Амінокислоти
Амінокислоти Нітрати у харчових продуктах
Нітрати у харчових продуктах  Атом құрылысы Сu. Биологиялық маңызы
Атом құрылысы Сu. Биологиялық маңызы Презентация по Химии "Презентация Коррозия металлов" - скачать смотреть
Презентация по Химии "Презентация Коррозия металлов" - скачать смотреть  Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Подготовка к аттестации. ГОУ гимназия №1587ЮАО, Иванова Т.Ю.
Подготовка к аттестации. ГОУ гимназия №1587ЮАО, Иванова Т.Ю.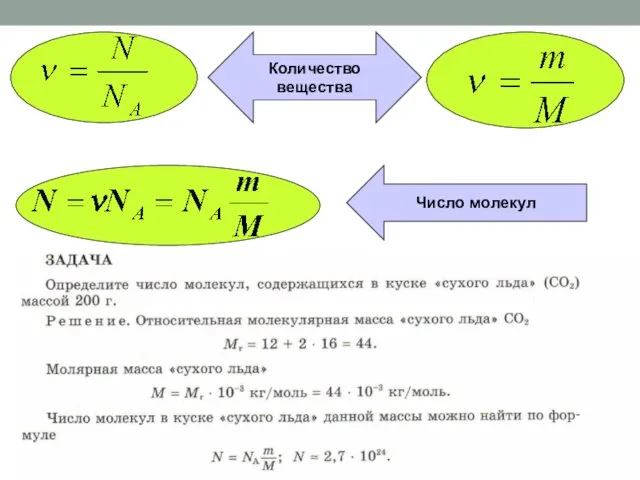 Виды состояния вещества
Виды состояния вещества Гидролиз солей
Гидролиз солей Электрохимия. Электродные потенциалы
Электрохимия. Электродные потенциалы ПРЕЗЕНТАЦІЯ НА ТЕМУ “МІНЕРАЛЬНІ ДОБРИВА”
ПРЕЗЕНТАЦІЯ НА ТЕМУ “МІНЕРАЛЬНІ ДОБРИВА”  Коллигативные свойства растворов
Коллигативные свойства растворов Дисперсные системы и растворы
Дисперсные системы и растворы Производство азотной кислоты
Производство азотной кислоты Каталітичний крекінг. Основні етапи становлення технології каталітичного крекінгу. Каталізатор крекінгу
Каталітичний крекінг. Основні етапи становлення технології каталітичного крекінгу. Каталізатор крекінгу Сталь
Сталь Инновационная технология производства биоэтанола из целлюлозосодежащих продуктов
Инновационная технология производства биоэтанола из целлюлозосодежащих продуктов Галогенидные и полигалогенидные комплексы постпереходных элементов
Галогенидные и полигалогенидные комплексы постпереходных элементов Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С
Витамины. Общая характеристика. Классификация. Витамины алифатического строения. Витамин С Радиоакивные металлы
Радиоакивные металлы