Содержание
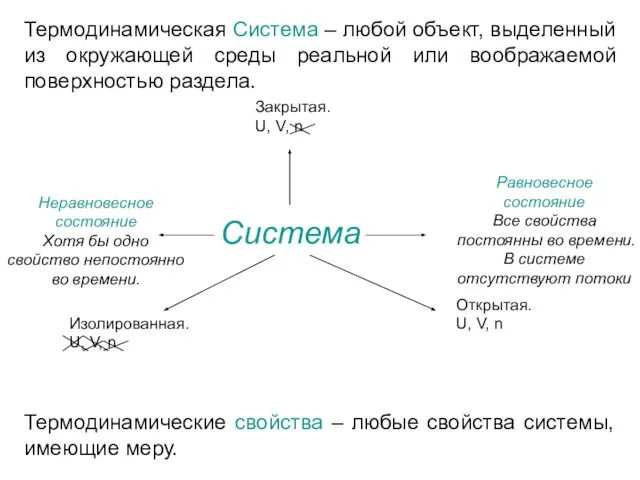
- 2. Термодинамическая Система – любой объект, выделенный из окружающей среды реальной или воображаемой поверхностью раздела. Система Открытая.
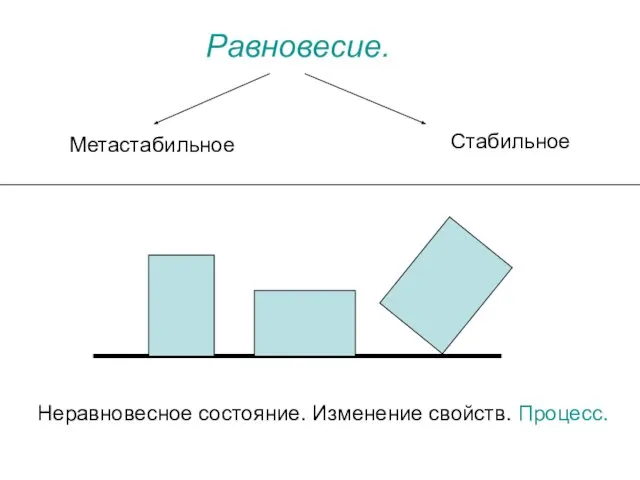
- 3. Равновесие. Стабильное Метастабильное Неравновесное состояние. Изменение свойств. Процесс.
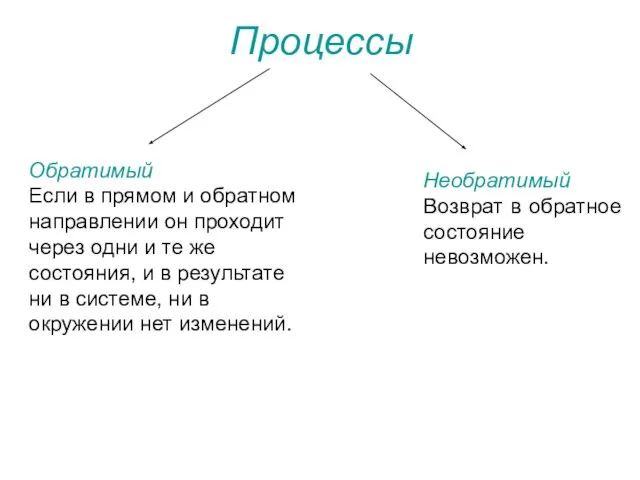
- 4. Процессы Обратимый Если в прямом и обратном направлении он проходит через одни и те же состояния,
- 5. Равновесие. Константа равновесия. Химическое равновесие – состояние химической системы, в котором обратимо протекает одна или несколько
- 6. Принцип Ле Шателье. Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо условие (температура, давление,
- 7. Принцип Ле Шателье. N2 + 3 H2 ↔ 2 NH3 Давление. При повышении давления химическое равновесие
- 8. Принцип Ле Шателье. N2 + 3 H2 ↔ 2 NH3 Концентрации. При повышении концентрации одного из
- 9. 1-ый и 2-ой Постулаты термодинамики 1. О равновесии. Любая термодинамическая система, будучи изолирована от внешнего воздействия,
- 10. Первый Закон Термодинамики ∆U=A+Q U - внутр. энергия системы A - работа Q - количество теплоты
- 11. Энтальпия U - внутр. энергия системы Q - количество теплоты ΔH = ΔU + P ΔV
- 12. Закон Гесса Тепловой эффект реакции не зависит от способа осуществления процесса и определяется только начальным и
- 13. Следствие из закона Гесса U - внутр. энергия системы А - работа Q - количество теплоты
- 14. Второй Закон Термодинамики Существует S (энтропия) - функция, описывающая состояние термодинамической системы. При протекании в изолированной
- 16. Скачать презентацию










 Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Флюорит
Флюорит Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Хімічні та фізичні явища
Хімічні та фізичні явища Серебро в жизни и деятельности человека
Серебро в жизни и деятельности человека Будова атому Матеріали до теми:
Будова атому Матеріали до теми:  Аминокислоты
Аминокислоты Фонд вільних амінокислот
Фонд вільних амінокислот Презентация по Химии "«Алкены»" - скачать смотреть
Презентация по Химии "«Алкены»" - скачать смотреть  Предмет и значение органической химии. Сравнение органических веществ с неорганическими
Предмет и значение органической химии. Сравнение органических веществ с неорганическими Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_
Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_ Химические сдвиги ядер
Химические сдвиги ядер Азотная кислота
Азотная кислота Алканы. Области применения алканов
Алканы. Области применения алканов Основы кристаллического строения. Лекция 1
Основы кристаллического строения. Лекция 1 Соединительная ткань. Биохимия межклеточного матрикса. (Тема 8)
Соединительная ткань. Биохимия межклеточного матрикса. (Тема 8) Дисперсные системы
Дисперсные системы Организация физической защиты ДРМ
Организация физической защиты ДРМ Атом. Изотопы
Атом. Изотопы КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ Лекция по теме: «Обмен белко
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ Лекция по теме: «Обмен белко Реакции координированных лигандов
Реакции координированных лигандов Электронное строение атома. Занятие 5
Электронное строение атома. Занятие 5 Повторение основных вопросов курса неорганической химии 8 класса
Повторение основных вопросов курса неорганической химии 8 класса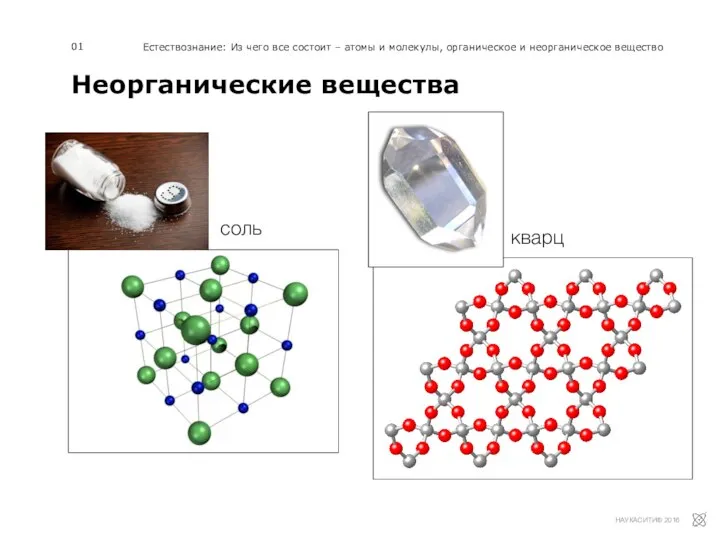 Неорганические вещества
Неорганические вещества Курс «Химия» Цели изучения курса: дать современное представление о веществе как одной из форм материи. дать запас знаний по хим
Курс «Химия» Цели изучения курса: дать современное представление о веществе как одной из форм материи. дать запас знаний по хим Растительное сырье содержащее флавоноиды
Растительное сырье содержащее флавоноиды Метод комплексонометрического титрования (лекция 8)
Метод комплексонометрического титрования (лекция 8)