Химическая связь, степень окисления, кристаллические решётки, расчётная задача. Контрольная работа №1
Содержание
- 2. Изобразите при помощи схем образование химических связей в соединениях: CO2 и Rb2Se. Назовите тип связи. C
- 3. Изобразите при помощи схем образование химических связей в соединениях: CO2 и Rb2Se. Назовите тип связи. Rb
- 4. Степень окисления. Условный заряд элемента, рассчитанный исходя из условия, что все связи в соединении ионные. H
- 5. Сумма всех С.О. атомов в молекуле = 0 H2 S O4 + -2 +6 (+1)∙2 +
- 6. С.О. водорода в соединениях с неметаллами «+1», в соединениях с металлами «-1» Постоянную степень окисления имеют
- 7. Решение задач Растворенное вещество, масса осадка.
- 8. К 132,5г раствора карбоната натрия с массовой долей растворённого вещества 40%, добавили избыток хлорида кальция. Рассчитайте
- 9. ωNa2CO3=40%(0,4) νNa2CO3=53г/106г/моль = 0,5 моль Mр-ра=132,5г Mосадка=? Na2CO3+CaCl2= CaCO3 + 2NaCl mNa2CO3= 132,5г ∙ 0,4 =
- 10. К 83,2г раствора хлорида бария с массовой долей растворённого вещества 25%, добавили избыток серной кислоты. Рассчитайте
- 11. ωBaCl2=25%(0,25) νBaCl2=20,8г/208г/моль = 0,1 моль Mр-ра=83,2г Mосадка=? BaCl2+H2SO4= BaSO4 + 2HCl mBaCl2 = 83,2г ∙ 0,25
- 12. К 265г раствора фосфата калия с массовой долей растворённого вещества 20%, добавили избыток нитрата бария. Рассчитайте
- 13. ωK3PO4=20%(0,2) νK3PO4=53г/212г/моль = 0,25 моль Mр-ра=265г Mосадка=? 2K3PO4+3Ba(NO3)2= Ba3(PO4)2 + 6KNO3 mK3PO4 = 265г ∙ 0,2
- 19. Скачать презентацию







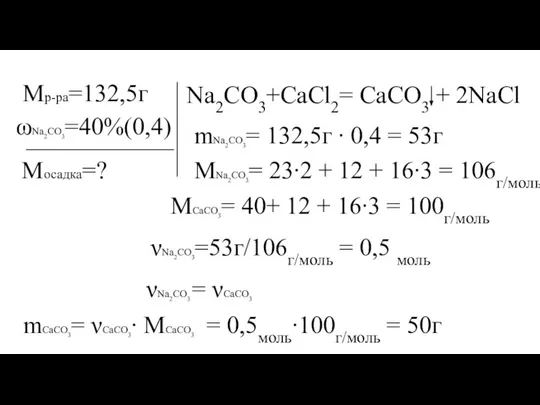








 Презентация по Химии "История развития химии" - скачать смотреть
Презентация по Химии "История развития химии" - скачать смотреть  Строение атома Подготовка к ЕГЭ
Строение атома Подготовка к ЕГЭ Производство каустической соды Дисциплина: Технология химических производств
Производство каустической соды Дисциплина: Технология химических производств Негосударственное образовательное учреждение частная школа «Радуга» Исследование чипсов Выполнил Ученик 10класса Борзов Ден
Негосударственное образовательное учреждение частная школа «Радуга» Исследование чипсов Выполнил Ученик 10класса Борзов Ден Химический элемент цинк
Химический элемент цинк Кислородсодержащие органические соединения. Предельные одноатомные спирты
Кислородсодержащие органические соединения. Предельные одноатомные спирты Энергетика химических процессов
Энергетика химических процессов Обмен аминокислот и белков
Обмен аминокислот и белков Разработка и добыча нефти и газа. (Тема 1.5)
Разработка и добыча нефти и газа. (Тема 1.5) Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно
Презентация по Химии "Химия. Классификация химических реакций" - скачать смотреть бесплатно Спирты. Классификация, номенклатура, изомерия. Спирты в природе
Спирты. Классификация, номенклатура, изомерия. Спирты в природе Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья
Хлороводород и соляная кислота. Свойства и применение. Подготовила: Ученица 8 класса МБОУ СОШ с.Фащёвка Столяренко Дарья  Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Презентация по Химии "Классификация химических реакций" - скачать смотреть
Презентация по Химии "Классификация химических реакций" - скачать смотреть  Кислород, его получение и физ свойства
Кислород, его получение и физ свойства Экзогенная серия. Группа выветривания
Экзогенная серия. Группа выветривания Цинк (Zn). Свойства
Цинк (Zn). Свойства Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов Подготовка к ЕГЭ
Подготовка к ЕГЭ Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2)
Закономерности протекания химических процессов. Основы химической термодинамики. (Лекция 2) Строение атома азота
Строение атома азота Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ
Общие вопросы аналитической химии. Химические методы обнаружения неорганических веществ Презентация по Химии "Чугуны. Классификация" - скачать смотреть
Презентация по Химии "Чугуны. Классификация" - скачать смотреть  Метаморфогенные месторождения
Метаморфогенные месторождения Оксиды. Физические свойства
Оксиды. Физические свойства