Содержание
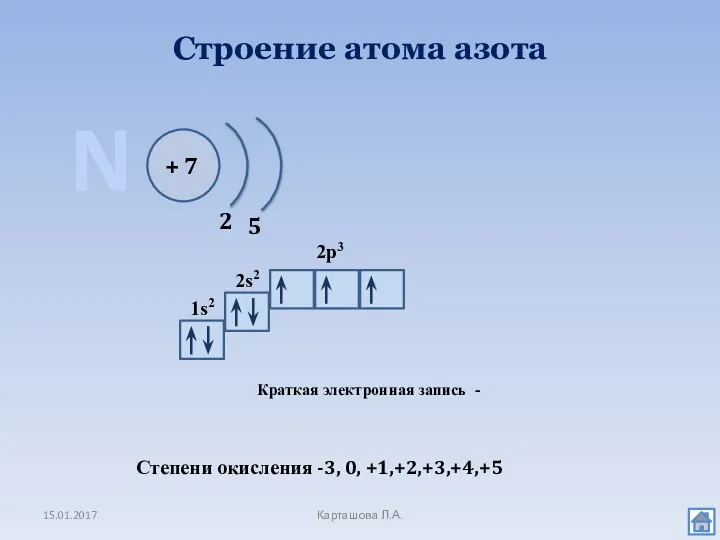
- 2. Строение атома азота 15.01.2017 Карташова Л.А. N + 7 2 5 1s2 2s2 2p3 Краткая электронная
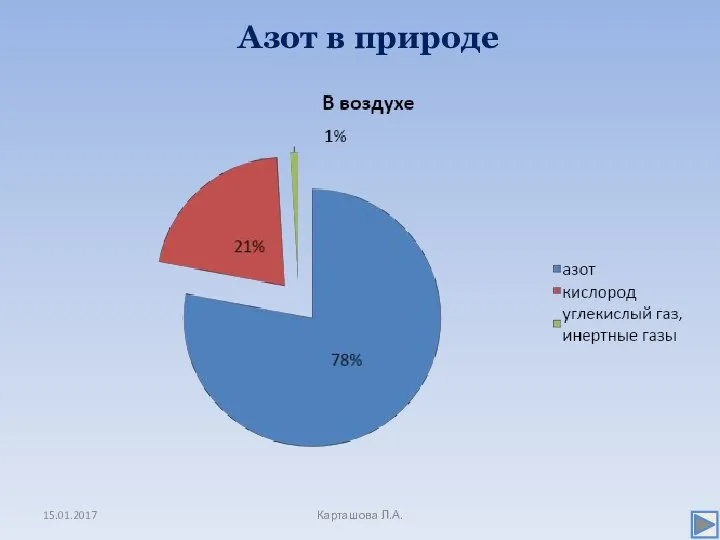
- 3. Азот в природе 15.01.2017 Карташова Л.А.
- 4. Круговорот азота в природе 15.01.2017 Карташова Л.А.
- 5. Свойства азота 15.01.2017 Карташова Л.А. В свободном состоянии азот существует в виде двухатомных молекул N2. В
- 6. При обычных условиях азот взаимодействует только с литием, образуя нитрид лития: 6Li+ N2 = 2Li3N С
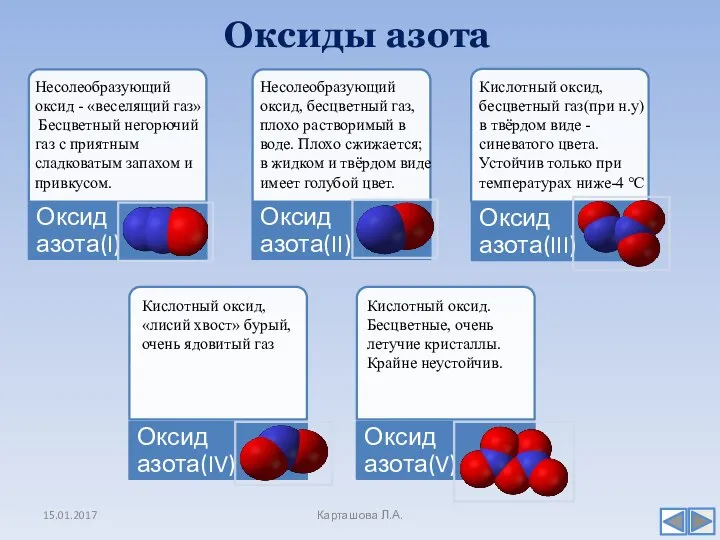
- 7. Оксиды азота 15.01.2017 Карташова Л.А. Несолеобразующий оксид - «веселящий газ» Бесцветный негорючий газ с приятным сладковатым
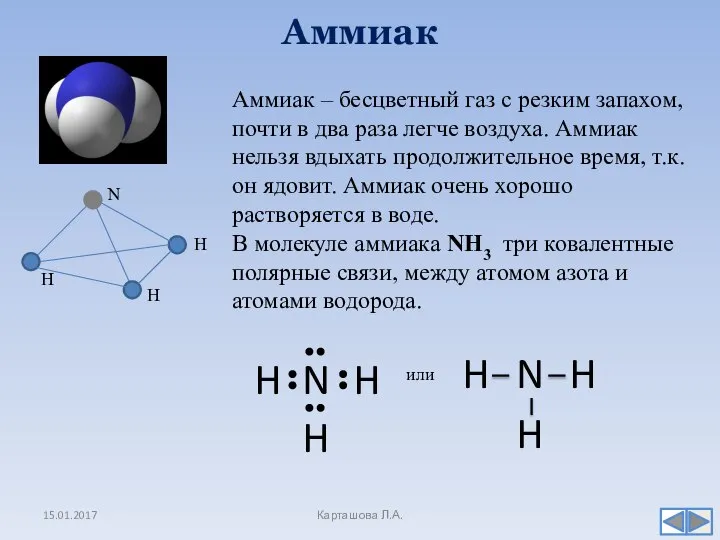
- 8. Аммиак 15.01.2017 Карташова Л.А. Аммиак – бесцветный газ с резким запахом, почти в два раза легче
- 9. 15.01.2017 Карташова Л.А. Получение аммиака в промышленности
- 10. Получение аммиака в лаборатории 15.01.2017 Карташова Л.А.
- 11. Использование аммиака в народном хозяйстве 15.01.2017 Карташова Л.А.
- 12. Азотная кислота 15.01.2017 Карташова Л.А. Азотная кислота - бесцветная, дымящая на воздухе жидкость, температура плавления −41,59
- 13. Химические свойства азотной кислоты 15.01.2017 Карташова Л.А. Типичные свойства: а) с основными и амфотерными оксидами: CuO
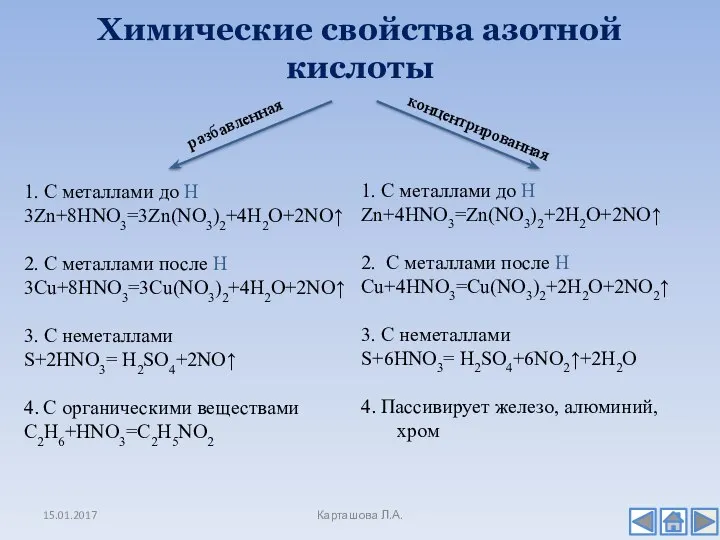
- 14. Химические свойства азотной кислоты 15.01.2017 Карташова Л.А. разбавленная концентрированная 1. С металлами до Н 3Zn+8HNO3=3Zn(NO3)2+4H2O+2NO↑ 2.
- 15. Соли азотной кислоты 15.01.2017 Карташова Л.А.
- 16. Вставьте пропущенные слова В периодической системе Д.И. Менделеева азот расположен в 2 периоде, V группе, главной
- 17. Распределите соединения азота по классам неорганических соединений 15.01.2017 Карташова Л.А. NH3 HNO3 NaNO3 N2O5 NO HNO2
- 19. Скачать презентацию











 Вещества
Вещества Хімія в побуті. Загальні правила поводження з побутовими хімікатами
Хімія в побуті. Загальні правила поводження з побутовими хімікатами ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 8 класс Презентация учителя химии МКОУ «СОШ №85» г. Тайшет Никитюк Л.Ф.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 8 класс Презентация учителя химии МКОУ «СОШ №85» г. Тайшет Никитюк Л.Ф. Аминокислоты. 10 класс
Аминокислоты. 10 класс Реакции соединения
Реакции соединения Молекулы. Свойства молекул
Молекулы. Свойства молекул Обмен липидов. (Часть 2)
Обмен липидов. (Часть 2) Производство ацетальдегида
Производство ацетальдегида Понятие об аминах
Понятие об аминах ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ 1. Метод валентных связей (ВС). 2. Теория кристаллического поля (ТКП). 3. Метод мо
ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ 1. Метод валентных связей (ВС). 2. Теория кристаллического поля (ТКП). 3. Метод мо Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Задачи Спирты. Альдегиды
Задачи Спирты. Альдегиды Презентация Химия и пища
Презентация Химия и пища Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды История открытия стекла Выполняла работу: Заривная Виктория 10 - Л
История открытия стекла Выполняла работу: Заривная Виктория 10 - Л  Презентация по Химии "Молоко" - скачать смотреть бесплатно
Презентация по Химии "Молоко" - скачать смотреть бесплатно Детский стиральный порошок «Ушастый нянь»
Детский стиральный порошок «Ушастый нянь» Значение теории химического строения А.М.Бутлерова
Значение теории химического строения А.М.Бутлерова  Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Интеллектуальная разминка HCl, H2SO4, H2CO3, H3PO4, HNO3. Al2O3 , CaO, Na2O, CO2, CuO. KOH, Ba(OH)2, Al(OH)3, Cu(OH)2, Fe(OH)3. BaСl2, ZnSO4, MgS, Ca(NO3)2.
Интеллектуальная разминка HCl, H2SO4, H2CO3, H3PO4, HNO3. Al2O3 , CaO, Na2O, CO2, CuO. KOH, Ba(OH)2, Al(OH)3, Cu(OH)2, Fe(OH)3. BaСl2, ZnSO4, MgS, Ca(NO3)2.  Chemical physics. Atomic structure
Chemical physics. Atomic structure Обмен нуклеотидов
Обмен нуклеотидов Биохимия почек и мочи. (Лекция 18)
Биохимия почек и мочи. (Лекция 18) Химические свойства воды (домашнее задание)
Химические свойства воды (домашнее задание) Хімія у житті суспільства
Хімія у житті суспільства  Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Неметаллы
Неметаллы Химия наука о веществах и законах их превращений
Химия наука о веществах и законах их превращений