Содержание
- 2. Теория строения А. М. Бутлерова 1. Химические вещества определенным образом построены, т.е. имеют строгий порядок в
- 3. Химическая связь в органических соединениях
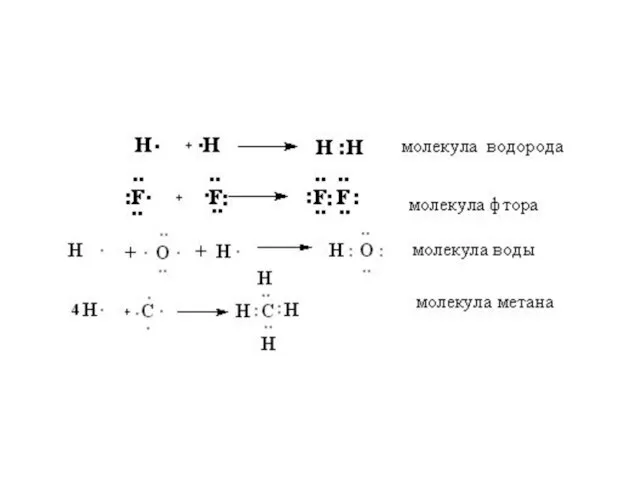
- 4. Классические представления о химической связи Теория Льюиса и Косселя: Связь между атомами осуществляется парой валентных электронов.
- 5. Электронный октет (или дублет) может образоваться двумя способами: Перенос электронов. 2. Обобществление электронов.
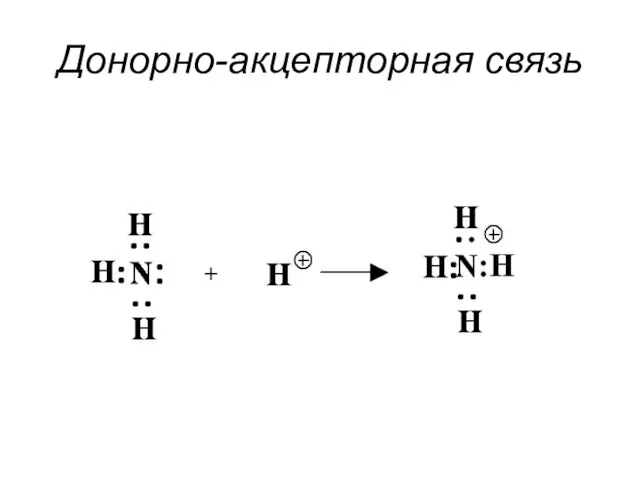
- 7. Донорно-акцепторная связь
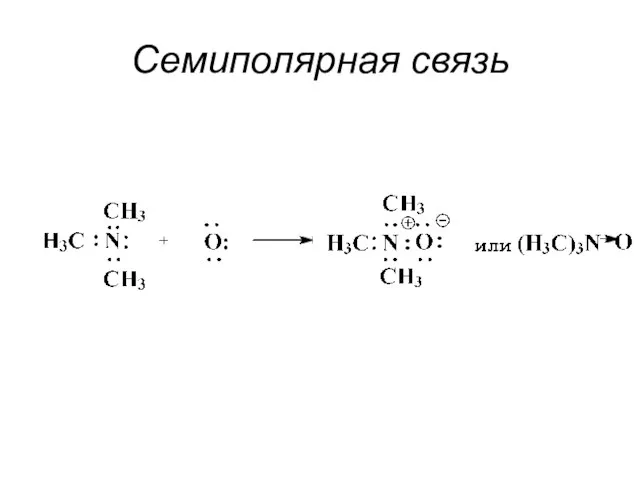
- 8. Семиполярная связь
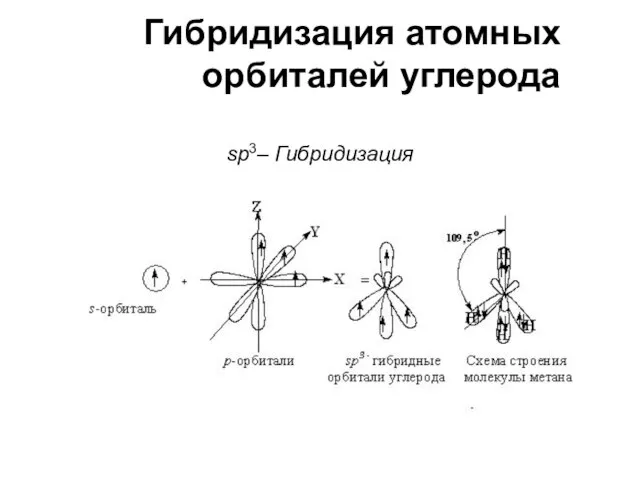
- 9. Гибридизация атомных орбиталей углерода sр3– Гибридизация
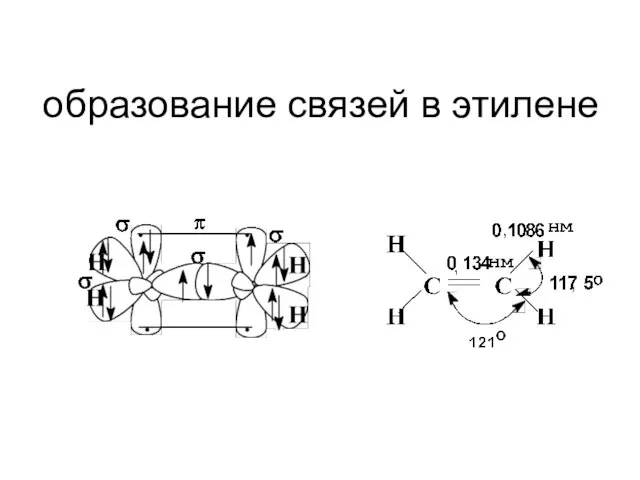
- 10. образование связей в этилене
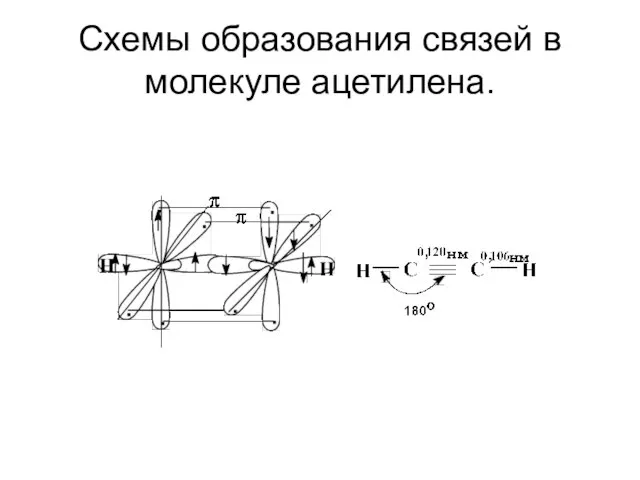
- 11. Схемы образования связей в молекуле ацетилена.
- 12. Гибридизация атомных орбиталей кислорода и азота
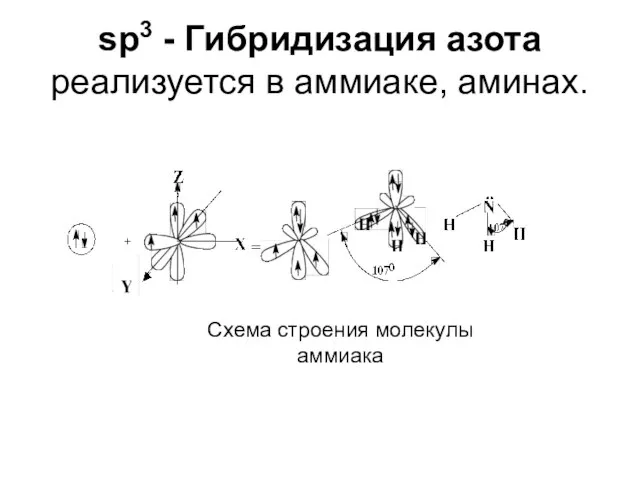
- 13. sp3 - Гибридизация азота реализуется в аммиаке, аминах. Схема строения молекулы аммиака
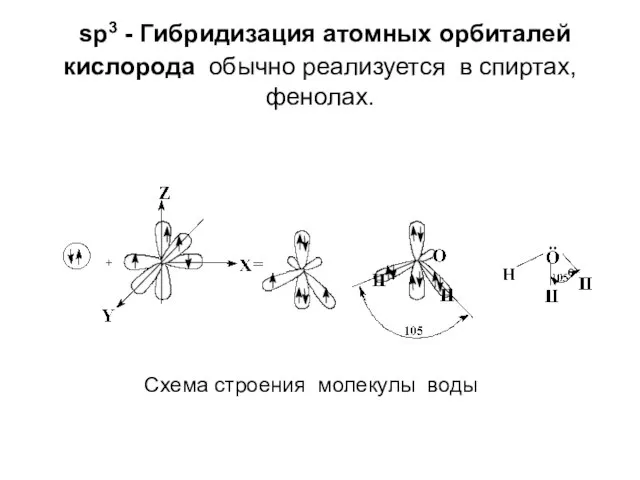
- 14. sp3 - Гибридизация атомных орбиталей кислорода обычно реализуется в спиртах, фенолах. Схема строения молекулы воды
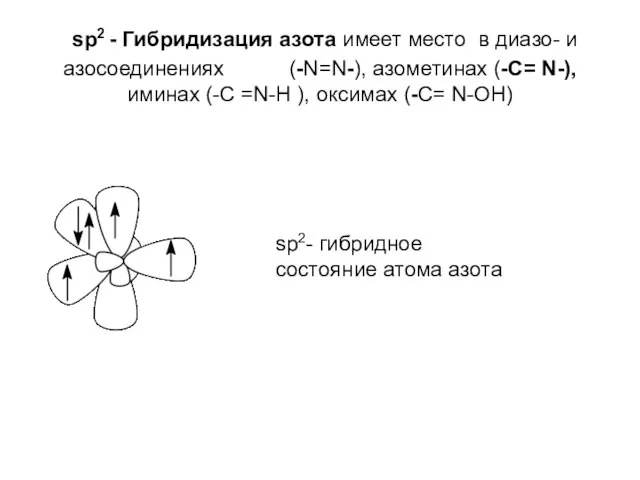
- 15. sp2 - Гибридизация азота имеет место в диазо- и азосоединениях (-N=N-), азометинах (-С= N-), иминах (-С
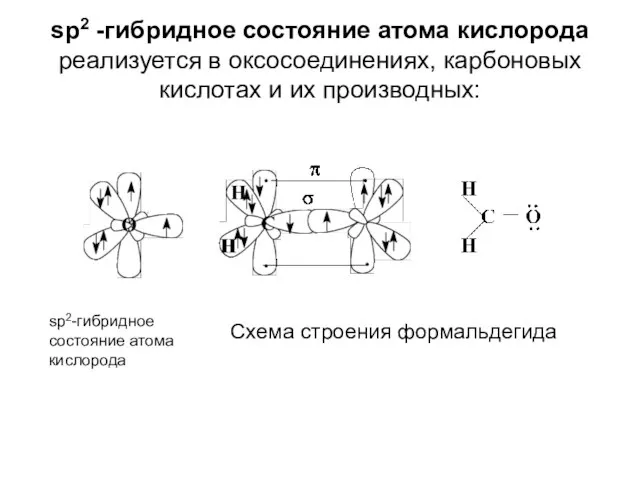
- 16. sp2 -гибридное состояние атома кислорода реализуется в оксосоединениях, карбоновых кислотах и их производных: sp2-гибридное состояние атома
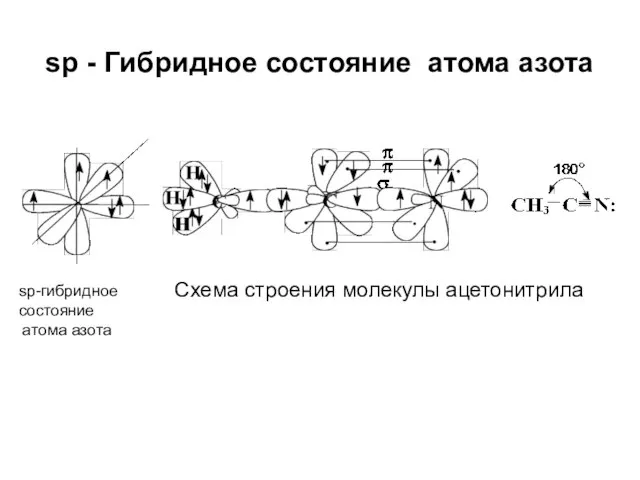
- 17. sp - Гибридное состояние атома азота sp-гибридное состояние атома азота Схема строения молекулы ацетонитрила
- 18. Механизмы распределения электронной плотности в молекулах органических соединений
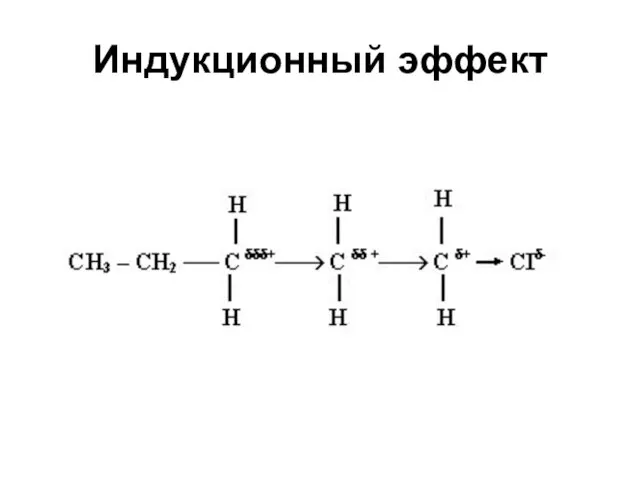
- 19. Индукционный эффект
- 20. Электроноакцепторные (-I-эффект) заместители
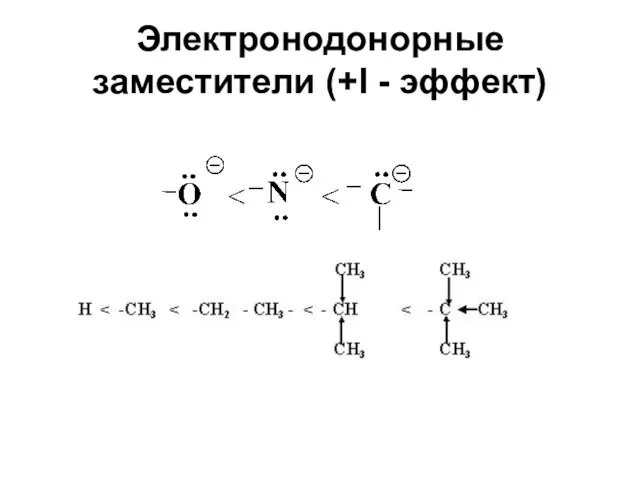
- 21. Электронодонорные заместители (+I - эффект)
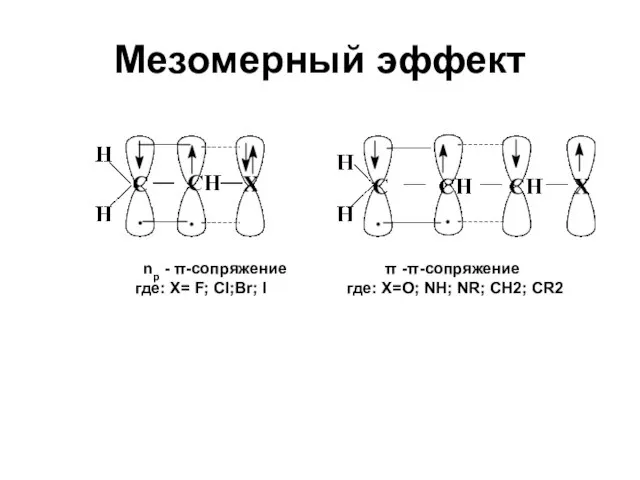
- 22. Мезомерный эффект nр - π-сопряжение π -π-сопряжение где: X= F; Cl;Br; I где: X=O; NH; NR;
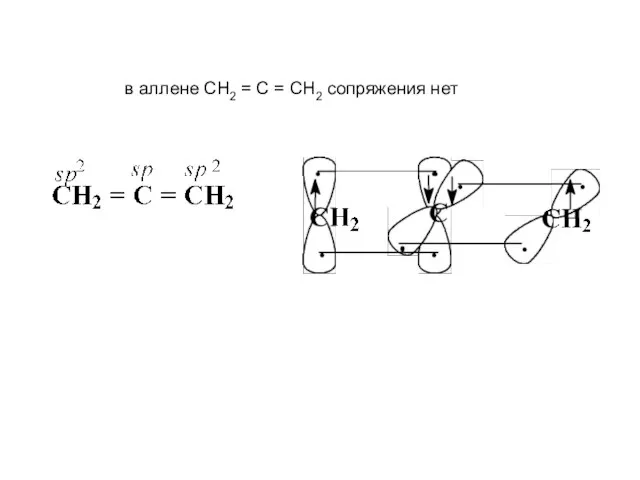
- 23. в аллене СН2 = С = СН2 сопряжения нет
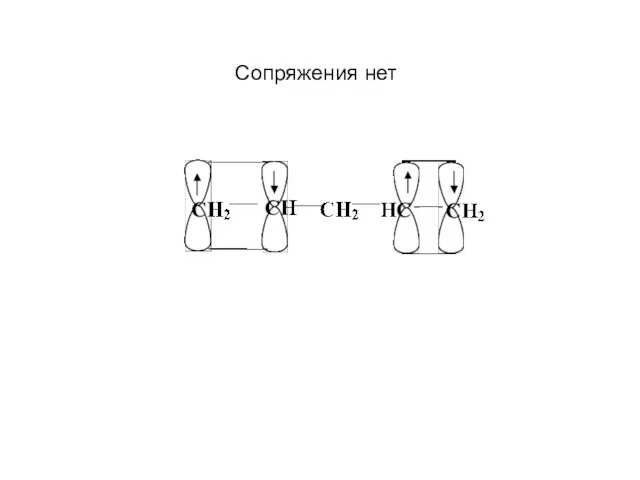
- 24. Сопряжения нет
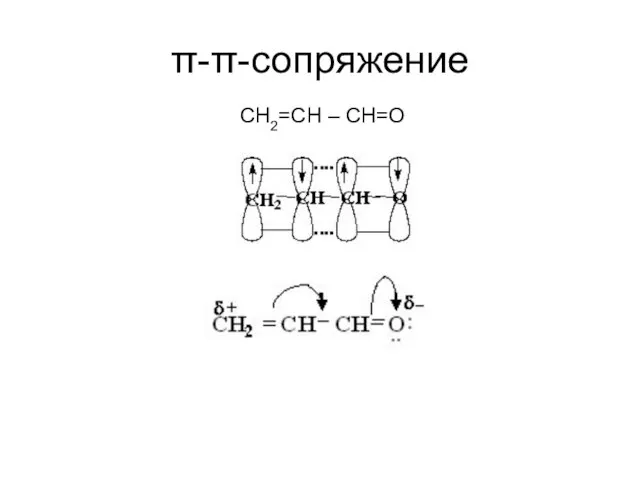
- 25. π-π-сопряжение СН2=СН – СН=О
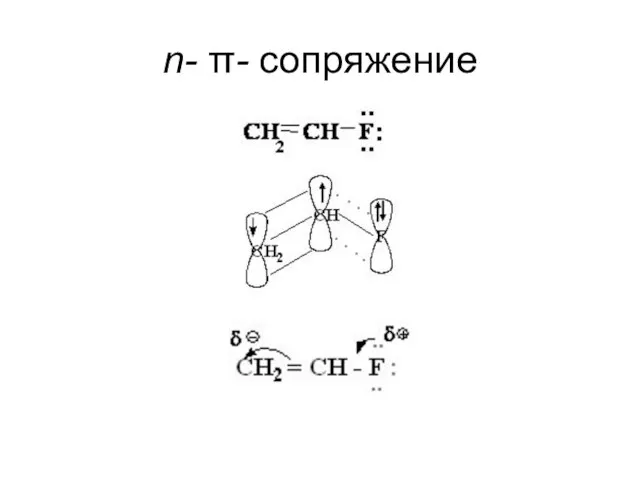
- 26. n- π- сопряжение
- 27. +М-эффект
- 29. Скачать презентацию







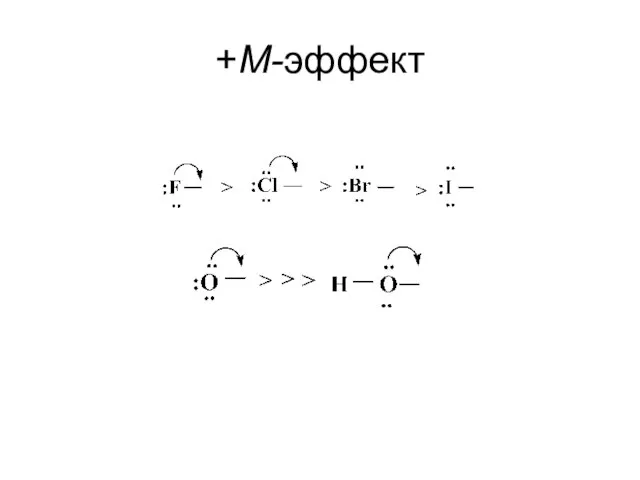
 Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Поверхностные явления и дисперсные системы
Поверхностные явления и дисперсные системы Презентация по Химии "Угольная кислота и ее соли" - скачать смотреть
Презентация по Химии "Угольная кислота и ее соли" - скачать смотреть  Необратимые электродные процессы. Часть 2
Необратимые электродные процессы. Часть 2 Химическая термодинамика и кинетика
Химическая термодинамика и кинетика Проблемно-исследовательские технологии обучения химии
Проблемно-исследовательские технологии обучения химии Молярный объём газов
Молярный объём газов Круговорот серы в природе
Круговорот серы в природе Презентация к уроку по теме: «Химические свойства кислот в свете теории электролитической диссоциации». Класс – 9, базовый у
Презентация к уроку по теме: «Химические свойства кислот в свете теории электролитической диссоциации». Класс – 9, базовый у Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие «Динамические модели». Кристаллы. Немолекулярные вещества. Простые вещества 9 класс (обязательный минимум по химии) ПОЛИМЕРЫ
9 класс (обязательный минимум по химии) ПОЛИМЕРЫ  Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Свойство металлов и сплавов
Свойство металлов и сплавов Количество вещества. 8 класс
Количество вещества. 8 класс Амоніак
Амоніак  МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор
МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор Законы Авогадро и Дальтона
Законы Авогадро и Дальтона Биологиялық жүйедегі осмос қысымының рөлі. Плазмолиз,гемолиз, тургор. Гипо-, изо-, және гипертонды ерітінділер
Биологиялық жүйедегі осмос қысымының рөлі. Плазмолиз,гемолиз, тургор. Гипо-, изо-, және гипертонды ерітінділер Знаки химических элементов
Знаки химических элементов Нетоксичні технології Підготувала збірна команда Київського району “Sunrise”
Нетоксичні технології Підготувала збірна команда Київського району “Sunrise”  Простые и сложные вещества
Простые и сложные вещества Уран. Получение урана
Уран. Получение урана Гидрогенизационные процессы переработки нефти и газа
Гидрогенизационные процессы переработки нефти и газа Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Иондық күшті анықтау
Иондық күшті анықтау Подготовка к итоговой контрольной работе. (9 класс)
Подготовка к итоговой контрольной работе. (9 класс) Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у
Фестиваль исследовательских и творческих работ учащихся «Портфолио» «Создание экспертной системы распознавания минеральных у