Содержание
- 2. Часть А. Тестовые задания. 1. Схема распределения электронов по энергетическим уровням в атоме химического элемента, образующего
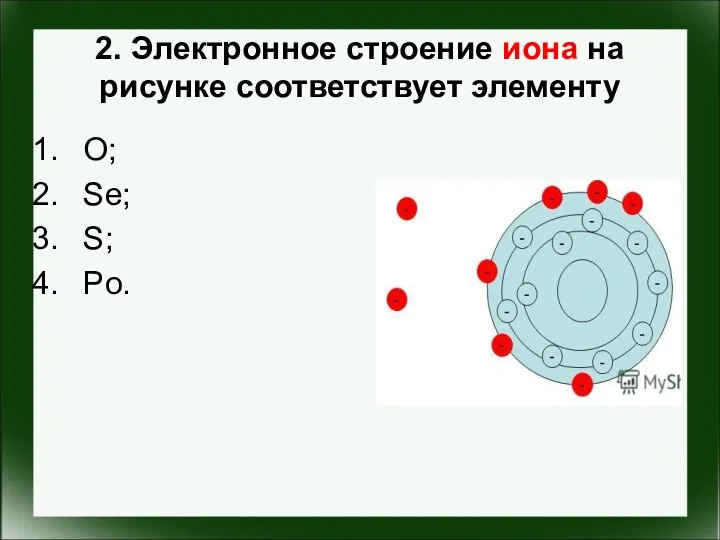
- 3. 2. Электронное строение иона на рисунке соответствует элементу O; Se; S; Po.
- 4. 3. Ряд элементов расположенных в порядке увеличения электроотрицательности: F-Cl-Br; K-Na-Li; C-Si-Ge; Si-Al-Mg.
- 5. 4. Вещество имеющее кристаллическое строение это: NaCl; H2O; HCl; CH3COOH.
- 6. 5. Оксид углерода (II) является: Амфотерным; Кислотным; Несолеобразующим; Основным.
- 7. 6. Ряд формул веществ реагирующих с гидроксидом калия: Al, CO2, HCl; H2SiO3, CuO, SO3; Na2SO4, S,
- 8. 7. Необратимая химическая реакция произойдёт при сливании растворов веществ, формулы которых: NaNO3 и H2SO4; KOH и
- 9. 8. Степень окисления серы S 2- в соединении формула которого: S; SO2; H2S; H2SO4.
- 10. 9. Уравнению реакции S+O2=SO2 соответствует схема превращения: S0→S-2; S+6→S0; S0→S-6; S0→S+4.
- 11. 10. Взаимодействию гидроксида бария и хлороводорода соответствует краткое ионное уравнение Ba2++2Cl-=BaCl2; OH-+H+=H2O; Ba2++2OH-+2H++2Cl-=Ba2+2Cl-+2H2O; 2OH-+2H+ =2H2O.
- 12. Часть Б. Задания со свободным ответом. 11. Составьте уравнения химических реакций между веществами формулы которых: K+
- 13. 12. По краткому ионному уравнению CO32-+2H+=H2O+CO2 составьте молекулярное уравнение.
- 14. 13. Дана схема превращений. Барий→Оксид бария→X→Карбонат бария Напишите молекулярные уравнения реакций, с помощью которых можно осуществить
- 16. Скачать презентацию












 Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Лаборатория в домашних условиях. Мастер-класс
Лаборатория в домашних условиях. Мастер-класс Магматичні родовища
Магматичні родовища Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Роль витаминов в обмене веществ
Роль витаминов в обмене веществ Химиялық пәндер. Алкалоидтар
Химиялық пәндер. Алкалоидтар СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ
СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ  Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Презентация Электролиты
Презентация Электролиты Менделеевский период
Менделеевский период Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Кількість речовини в хімії
Кількість речовини в хімії  Гігієна води. Лекція 6
Гігієна води. Лекція 6 Природные соединения кремния
Природные соединения кремния Очищение грязной воды
Очищение грязной воды Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Производство шампуня. Технология
Производство шампуня. Технология Роль побутової хімії у житті
Роль побутової хімії у житті Строение вещества. Химические элементы
Строение вещества. Химические элементы ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.
ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.  Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть
Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть  Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда ХІМІЯ В КОСМЕТИЦІ
ХІМІЯ В КОСМЕТИЦІ  Уксусная кислота
Уксусная кислота Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Спирты. Классификация спиртов
Спирты. Классификация спиртов Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Электрохимические производства
Электрохимические производства