Процессы — нагревания, кипения, диссоциации, вызывающие увеличение
беспорядка сопровождаются увеличением энтропии.
Кристаллизация, полимеризация
связана с уменьшением объема, сопровождаются уменьшением энтропии.
Чем тверже вещество, тем меньше его энтропия, чем мягче, тем энтропия больше.
По группам сверху вниз наблюдается увеличение энтропии. В отличие от всех других термодинамических функций энтропия имеет абсолютное значение.
Абсолютная энтропия идеального кристалла при ОК равна нулю.
В идеальном кристалле при О К все частицы находятся в одном энергетическом состоянии, т.к. кристалл упорядочен, тепловое движение отсутствует, то для идеального кристалла возможно только 1 состояние полной упорядоченности, т.е.
W=1






























 Презентация по Химии "Разнообразие веществ" - скачать смотреть
Презентация по Химии "Разнообразие веществ" - скачать смотреть  Нафта та продукти нафтопереробки
Нафта та продукти нафтопереробки  Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Алканы «Гексан»
Алканы «Гексан» ИЗ ОПЫТА ИСПОЛЬЗОВАНИЯ ИНТЕРАКТИВНОЙ ДОСКИ НА УРОКАХ ХИМИИ.
ИЗ ОПЫТА ИСПОЛЬЗОВАНИЯ ИНТЕРАКТИВНОЙ ДОСКИ НА УРОКАХ ХИМИИ. Применение наноматериалов
Применение наноматериалов Структура кристаллических полимеров
Структура кристаллических полимеров Решение 33 задания
Решение 33 задания Корреляция структуры ксенобиотика и его токсичности. Топологические индексы
Корреляция структуры ксенобиотика и его токсичности. Топологические индексы Предельные углеводороды
Предельные углеводороды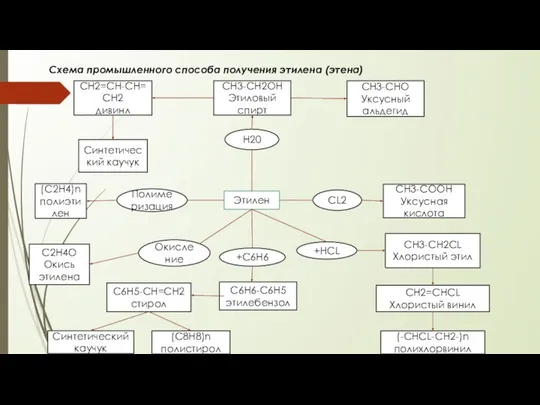 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена) Алюминий и его соединения
Алюминий и его соединения Химические знаки
Химические знаки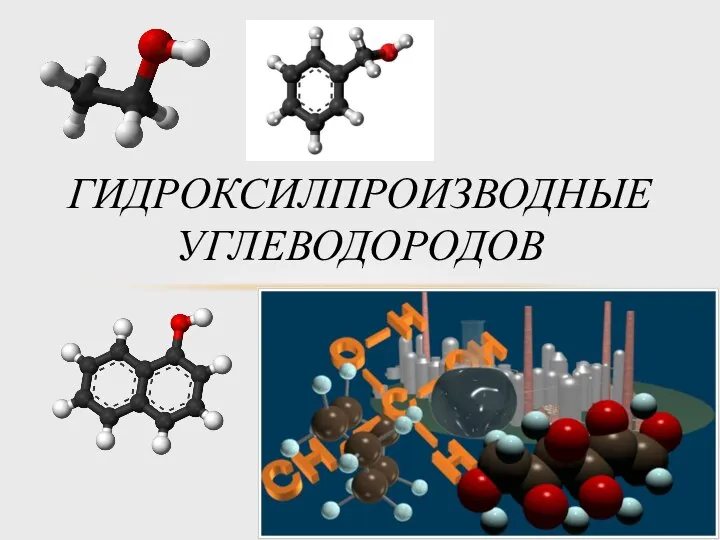 Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Застосуваня електролізу
Застосуваня електролізу Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно
Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно Соли. Классификация солей. Способы получения. Физические и химические свойства
Соли. Классификация солей. Способы получения. Физические и химические свойства Презентация по Химии "ПЛАСТМАССА" - скачать смотреть
Презентация по Химии "ПЛАСТМАССА" - скачать смотреть  Химия. D-элементтер
Химия. D-элементтер Гетероциклические соединения
Гетероциклические соединения Презентация по Химии "Знаки химических элементов" - скачать смотреть
Презентация по Химии "Знаки химических элементов" - скачать смотреть  Необычные минералы
Необычные минералы Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував
Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував  Технология адсорбционной осушки газа
Технология адсорбционной осушки газа Химия и современный быт человека
Химия и современный быт человека Фуллерены Квазикристаллы Использование кристаллов
Фуллерены Квазикристаллы Использование кристаллов Ток в жидкостях. Закон электролиза. Гальваностегия. Гальванопластика
Ток в жидкостях. Закон электролиза. Гальваностегия. Гальванопластика