В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления,
превращаясь из простых веществ в катионы:
Реакции металлов относятся к окислительно-восстановительным реакциям. Окислителями металлов являются неметаллы, ионы водорода, азотная кислота разной концентрации и концентрированная серная кислота.
Для металлов как восстановителей в соединениях характерны положительные степени окисления ( +1, +2, +3 – металлы главных подгрупп I – III групп).
Многим из них присущи переменные степени окисления – металлы побочных подгрупп (Fe, Cu и др.).
Химические свойства металлов различаются в зависимости от химической активности металла.
Общая характеристика металлов










 Соединения галогенов
Соединения галогенов Дибензодиазепин туындылары
Дибензодиазепин туындылары «РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА
«РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА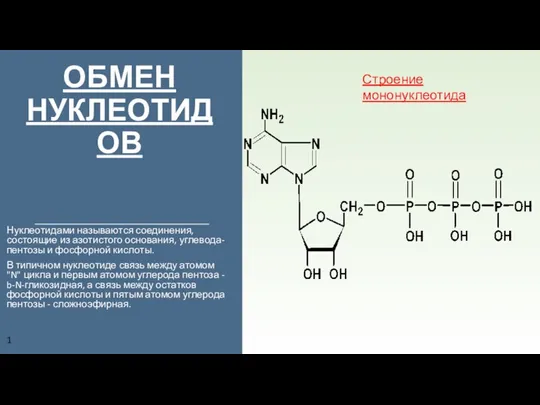 Обмен нуклеотидов. Строение мононуклеотида
Обмен нуклеотидов. Строение мононуклеотида Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна  Осмий. Нахождение в природе
Осмий. Нахождение в природе Аминокислоты. Стереохимия аминокислот
Аминокислоты. Стереохимия аминокислот Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот (цикл Кребса) Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности
Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности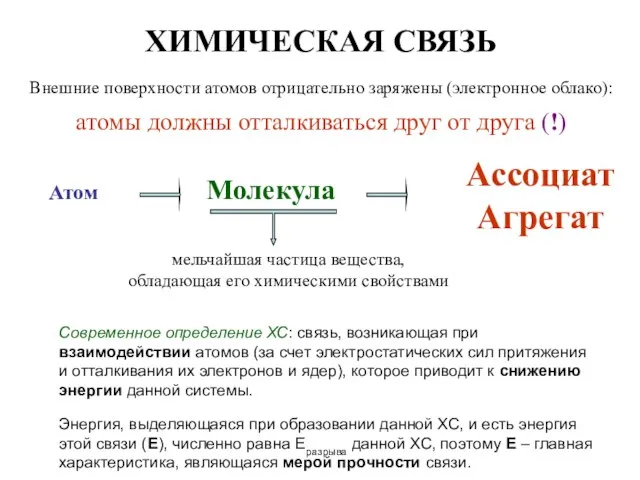 Химическая связь
Химическая связь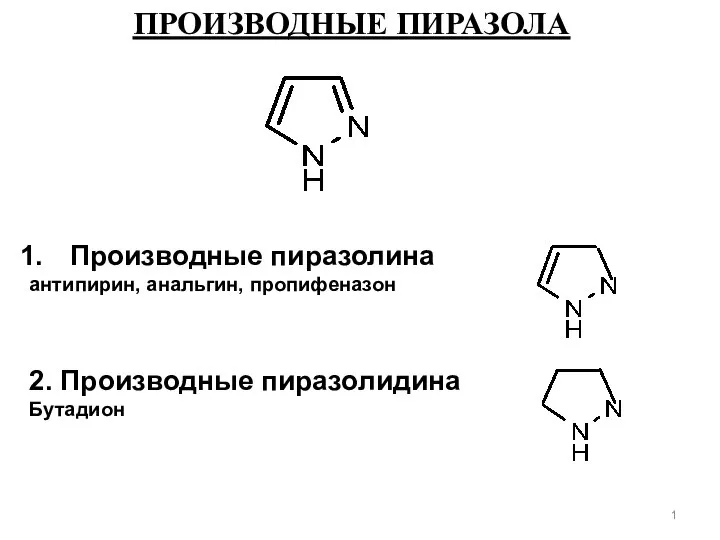 Производные пиразола
Производные пиразола Тест по неметаллам
Тест по неметаллам Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Кислотные дожди
Кислотные дожди  Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Химический элемент углерод
Химический элемент углерод Щелочноземельные металлы, берилий и магний
Щелочноземельные металлы, берилий и магний Презентация по Химии "Формы Выделения минералов" - скачать смотреть
Презентация по Химии "Формы Выделения минералов" - скачать смотреть  Звездный час «Знатоки химии»
Звездный час «Знатоки химии» Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар
Титриметриялық анализ. Жіктелуі. Қышқылдықнегіздік титрлеу. Алкалиметрия және ацидометрия. Реакцияларға қойылатын талаптар Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Фосге́н (дихлорангидрид угольной кислоты)
Фосге́н (дихлорангидрид угольной кислоты) Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Знакомство с лабораторным оборудованием. Практическая работа №1
Знакомство с лабораторным оборудованием. Практическая работа №1 Химический состав молока
Химический состав молока Угольная кислота и ее соли
Угольная кислота и ее соли Кислородосодержащие соединения - спирты
Кислородосодержащие соединения - спирты Тема: хімія та їжа
Тема: хімія та їжа